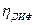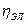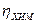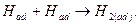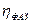что такое перенапряжение в химии
Что такое перенапряжение в химии
Как указывалось выше, напряжение разложения при электролизе не равно Eп, а превышает ее.
Так, например, стандартный потенциал серебряного электрода составляет 0,799 В и выделение на нем ионов Ag + из раствора AgNO3, в котором аАg + = 1, должно было бы происходить при отрицательном потенциале электрода, лишь немного превышающем указанную величину. При возникновении концентрационной поляризации для осуществления длительного электролиза необходимо наложение потенциалов от внешней э. д. с., существенно больших, чем равновесный потенциал электрода.
Концентрационная поляризация может быть устранена путем интенсивного перемешивания раствора. При этом, несмотря на отсутствие такой поляризации, в ряде случаев было найдено, что для электролиза необходимо увеличение потенциала на электроде на более или менее значительную величину по сравнению с равновесным потенциалом. Такое превышение потенциала над равновесным и называется перенапряжением (η) на данном электроде.
Это явление наблюдается главным образом в тех случаях, когда продуктами электролиза являются газы. Большое практическое значение имеет перенапряжение при выделении водорода на катодах из различных металлов. Существенно, что перенапряжение при прочих равных условиях зависит от материала и состояния электрода. Так, на платине, покрытой платиновой чернью, водород выделяется с малым перенапряжением, а на гладкой платине с большим. Значительным перенапряжением сопровождается выделение водорода на свинцовом и ртутном катодах, где по этой причине потенциал выделения сдвинут в отрицательную сторону.
Перенапряжение, таким образом, необходимо для того, чтобы скорость электролиза имела определенное конечное значение, т.е. чтобы через раствор шел более или менее сильный ток.
Рассмотрение процессов, происходящих при электролизе, целесообразно ограничить выяснением механизма явлений, имеющих место только на одном электроде, применив для этого неполяризующийся второй электрод.
На рис. Х.5 схематически показан прибор для измерения перенапряжения водорода, в котором определяется потенциал электрода в процессе электролиза. Для этого катод
K поляризуется внешней э. д. с. с использованием вспомогательного электрода B. При этом величина внешней э. д. с. изменяется с помощью реостата R, а сила тока, идущего через электролит, измеряется амперметром А. Потенциал электрода определяется по отношению ко второму вспомогательному электроду В2 при помощи потенциометра П.
Тафелем было найдено эмпирическое уравнение, связывающее плотность тока i и перенапряжение η:
При условии T = const это уравнение приводит к формуле Тафеля, эквивалентной уравнению (Х.9):
Так, для Pb, Hg, Zn, Сu, Pt в 1-н. растворах HCl при 20° C величины а соответственно равны 1,56; 1,415; 1,24; 0,80 и 0,1 В.
Оказывается, что численное значение а тем меньше, чем больше данный металл способен адсорбировать на своей поверхности атомы водорода, т.е. увеличение адсорбции снижает перенапряжение. Постоянная b приблизительно одинакова для всех металлов.
Потенциал разложения. Перенапряжение



Для того чтобы электролиз протекал с заметной скоростью, на клеммах электролитической ванны необходимо поддерживать определенное напряжение.
Та наименьшая величина электродного потенциала, при котором протекает процесс электролиза, называется потенциалом разложения Еразл. Эта величина измеряется в вольтах и находят её обычно опытным путем.
Например, для электролиза раствора хлорида никеля (II) NiCl2 c нерастворимым анодом теоретическое значение потенциала разложения Еразл(теор) = 1,59 В. Практически же найденная величина составила Еразл(практ) = 1,85 В.
Разность между потенциалом разложения, фактически необходимым для проведения электролиза в данной электрохимической системе, и её теоретическим значением называется перенапряжением Еп:
Еп = Еразл(практ) – Еразл(теор)
Еп = 1,85 – 1,59 = 0,26 В.
Следовательно, в данном случае перенапряжение составляет 0,26 В. Это вызвано процессами внутреннего сопротивления электролита и процессами поляризации, происходящими на аноде и катоде в ходе электролиза.
Перенапряжение ведет к перерасходу электрической энергии. Однако это компенсируется той пользой, которую оно приносит. А именно, благодаря перенапряжению оказалось возможным выделять при электролизе из водных растворов солей такие металлы, как Mn, Zn, Fe, Ni, Sn, Pb, т. к. перенапряжение этих металлов меньше, чем перенапряжение водорода на них. При электролизе из двух конкурирующих ионов на электроде будет разряжаться в первую очередь тот ион, у которого перенапряжение меньше.
Перенапряжение бывает анодным (на аноде) и катодным (на катоде). Именно явлением перенапряжения можно объяснить последовательность разрядки ионов на катоде и аноде при электролизе водных растворов соединений.
Последовательность электродных процессов
Часто в растворах электролитов присутствуют несколько видов катионов и анионов и недиссоциированных молекул, поэтому возможно протекание нескольких электродных реакций из-за конкуренции ионов, устремляющихся к электродам.
Катодные процессы. На катоде при электролизе растворов соединений протекают восстановительные процессы в зависимости от активности металлов.
Все металлы в ряду напряжений можно разделить на три части:
активные металлы (от Li до Al включительно);
В Химия. Учеб. пособие
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Перенапряжение (электрохимич.)
Перенапряж е ние электрохимическое, отклонение электродного потенциала от его равновесного (по отношению к приэлектродному составу раствора) термодинамического значения при поляризации электрода внешним током. При заметном удалении от равновесия перенапряжение ( h ) и плотность поляризующего тока (i) обычно связаны соотношением h = а + b lg i (уравнение Тафеля), где а и b — эмпирические постоянные. Перенапряжение зависит от температуры, природы электродного материала и состава раствора. Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов (см. Ингибиторы химические), что является одной из положительных сторон перенапряжения. В то же время перенапряжение в промышленном электролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.
Лит.: Кинетика электродных процессов М., 1952 (авторский колл. под рук. А. Н. Фрумкина); Скорчеллетти В. В. Теоретическая электрохимия, Л., 1959; Антропов Л. И., Теоретическая электрохимия, 2 изд., М., 1969.
Виды перенапряжения



В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения
1) Диффузионное перенапряжение
Диффузионным перенапряжением называют вид перенапряжения, связанный с торможением подвода реагентов к электроду или отвода продуктов реакции.
2) Электрохимическое перенапряжение
Электрохимическим перенапряжением называют вид перенапряжения, связанный со стадией замедленного (то есть имеющего конечную скорость) перехода электронов от элетрода к реагирующей частице или от реагирующей частицы к электроду.
Используются также термины перенапряжение перехода, активационное перенапряжение и перенапряжение разряда.
3) Перенапряжение химической реакции
Перенапряжением химической реакции называют вид перенапряжения, обусловленный конечной скоростью химической реакции, которая может быть одной из стадий сложного электродного процесса.
Примером может служить образование молекул адсорбированного водорода H2(ad):
4) Фазовое перенапряжения
Фазовым перенапряжением называют вид перенапряжения, связанный с торможением сложной электродной реакции на стадии образования новой лил разрушения старой фазы.
Пример: десорбция H2(ad) с поверхности электрода и образование газовой фазы H2(г):