в каком году была сформулирована теория строения органических соединений
В каком году была сформулирована теория строения органических соединений
Другим значимым аспектом теории А. М. Бутлерова стало утверждение, что химическое строение веществ можно установить опытным путём химическими методами и отразить в формуле.
отражены в следующем:
1. Атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентности.
2. Свойства веществ зависят от вида и количества атомов, входящих в состав молекулы, а также от химического строения. Химическое строение определяет взаимное влияние атомов в молекуле.
3. Химическое строение молекулы может быть установлено в результате изучения свойств вещества.
Структуры органических соединений отображаются химическими формулами, в которых показан порядок соединения атомов в молекулах. Такие формулы называют формулами химического строения или структурными формулами.
Структурные формулы отображают только последовательность соединения атомов, но не расположение их в пространстве.
Каждая структурная формула отображает строение одной и той же молекулы пропана, т. к. последовательность соединения атомов в данном случае не изменяется.
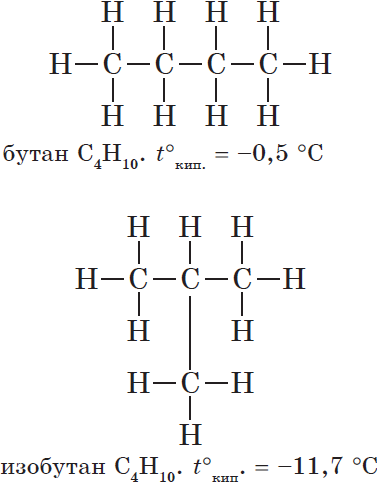
Структурные формулы веществ обычно изображают в сокращённом виде `»CH»_3-«CH»_2-«CH»_3`. В сокращённых формулах чёрточки показывают связь атомов углерода друг с другом, но не показывают связи между атомами углерода и водорода. Начиная с бутана возможен различный порядок соединения атомов при одном и том же составе молекулы, т. е. в бутане атомы углерода могут располагаться в виде линейной и разветвлённой цепей.
`»C»-«C»-«C»-«C»`
В первом случае каждый атом углерода соединён с одним (если он концевой) или с двумя (если он находится внутри цепи) соседними атомами углерода; во втором случае – появляется атом углерода, соединённый с тремя соседними атомами углерода. Различному порядку связывания атомов при одном и том же качественном и количественном составе молекулы должны соответствовать разные вещества.
Бутан линейного строения и изобутан различаются температурами кипения.
| `»CH»_3-«CH»_2-«CH»_2-«CH»_3` | |
| бутан (т. кип. `-0,5^@»C»`) | изобутан (т. кип. `-11,7^@»C»`) |
называют вещества, которые имеют одинаковый состав молекулы, но различное химическое строение.
С увеличением числа атомов углерода в молекуле число возможных изомеров резко возрастает. Различия в химическом строении являются причиной проявления изомерами различных физико-химических свойств.
Теория А. М. Бутлерова завоевала признание. Значение теории химического строения А. М. Бутлерова можно сравнить с Периодическим законом и Периодической системой химических элементов Д. И. Менделеева.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь:
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Содержание:
Что такое органическая химия?
Органическая химия – это раздел химии, который изучает структуру, свойства и методы получения (синтеза) углеводородов и их производных. Сейчас число известных органических соединений составляет почти 30 млн, однако оно продолжает расти (в мае 1999 года было известно около 12 млн органических веществ). Этот рост обусловлен необычными свойствами углерода. Например, данный элемент может образовать цепи любой длины, способные замыкаться и образовывать циклы, а также атом углерода способен создавать одинарные, двойные или тройные связи. Валентность углерода всегда равна 4-м, поэтому он всегда будет создавать вокруг себя 4 связи. Это могут быть четыре одинарных, две двойных, одна тройная и одна одинарная и др. В любом случае, способов образовывать связи много, однако чаще всего углерод связывается с водородом, кислородом, фосфором, азотом и некоторыми другими атомами этих элементов.
Теория строения органических соединений
Ещё в глубокой древности люди могли получать органические вещества, но теория их строения была сформулирована только в 1860-х годах русским химиком Александром Михайловичем Бутлеровым. Теория получила название в честь своего автора и стала фундаментом органической химии. До возникновения этой теории существовала такая точка зрения, что органические вещества нельзя получить из неорганических, то есть для их синтеза необходима некая сила, существующая только у живых организмов. Естественно, что появление теории, противоречащей всем знаниям в области органики, вызвало непонимание у химиков того времени. Научившись самостоятельно синтезировать органические вещества, ученые столкнулись с соединениями с одинаковой молекулярной формулой и молярной массой, но абсолютно другими свойствами. Например, диметиловый эфир при нормальных условиях представляет собой газ, а этиловый спирт, имеющий такой же состав, – жидкость. Подобные соединения стали называть изомерами, а явление – изомерией.
Основные положения теории Бутлерова
Данная теория оказала сильное влияние на скорость развития органической химии. С ее помощью А.М. Бутлеров объяснил явление изомерии, а также самостоятельно получил некоторые изомеры, в очередной раз доказав верность своих мыслей.
Гомология и изомерия.
Гомология (от греч. «подобный») – явление, при котором вещества имеют похожие строение и свойства, но отличаются между собой по молекулярному составу на одну или несколько групп CH2. Например алканы: CH4(метан), C2H6(этан), C3H8(пропан), C4H10(бутан). В органической химии существуют целые гомологические ряды. У каждого класса органических веществ есть свой гомологический ряд, отражающий общую формулу соединений, входящих в него.
Гомологический ряд алканов
Формула
Название вещества
Изомерия (от греч. «равный») – явление, при котором вещества имеют похожий количественный и качественный состав, но разные строение и свойства. Изомерия бывает структурная и пространственная.
Структурная изомерия
Структурные изомеры – вещества одинакового количественного и качественного состава, но разного химического строения. Структурная изомерия бывает 3-х типов.
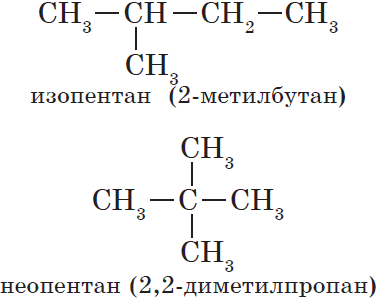
Изомерия углеродного скелета
(В 1-м случае CH3 – часть углеродной цепи, а во 2-м – радикал).
Изомерия положения
(Меняется положение двойной связи. В 1-м случае двойная связь у первого атома углерода, а во 2-м – у второго).
2.2 функциональной группы
(Меняется положение гидроксогруппы от 1-го атома углерода ко 2-му).
(Меняется положение атома хлора (галогена) от 1-го атома углерода ко 2-му).
Межклассовая изомерия
(Меняется класс вещества).
Пространственная изомерия
Пространственные изомеры (стереоизомеры) – вещества одинакового количественного и качественного состава и одинакового химического строения, отличающихся друг от друга пространственным расположением атомов в молекуле. Пространственная изомерия бывает 2-х типов.
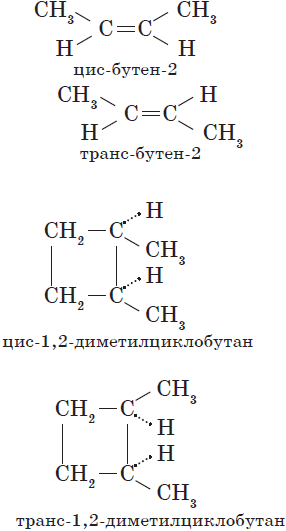
Геометрическая изомерия
Встречается у веществ, имеющих цикл или двойную (С=С) связь. Данный вид пространственной изомерии еще называют цис – и – транс изомерией.
(Атом водорода и группа CH3 меняются местами).
Оптическая изомерия
Суть оптической изомерии заключается в том, что если атом углерода в молекуле связан с 4-мя различными атомами или атомными группами, то из него можно получить два соединения с одинаковой структурой, молекулы которых будут являться зеркальными копиями друг друга (как правая и левая руки человека). В пример можно привести D-глюкозу и L-клюкозу.
Взаимное влияние атомов в молекулах
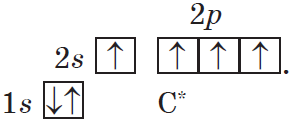
С момента появления электронной теории химической связи (1912-1916 гг.) знания о структуре химических соединений, как о последовательности соединенных атомов, были значительно пополнены. Данная теория объясняет причину влияния атомов или групп атомов внутри молекулы друг на друга. Всего существует два способа такого взаимодействия.
Индуктивный эффект
Мезомерный эффект
Заключение
Органическая химия играет большую роль в существовании живых организмов. С давних времен люди пытались разгадать тайны органических веществ, но стремительно развиваться этот раздел химии начал только в середине XIX века. Разгадав тайны строения этих соединений, люди продолжили двигаться вперед, открывая новое и в большинстве случаях полезное для человечества (например, препарат пенициллин). Прочитав данную статью, вы узнали о теории А.М. Бутлерова, о таких явлениях как гомология и изомерия и о взаимном влиянии атомов в молекулах. Все эти открытия, сделанные людьми несколько столетий назад, являются основами органической химии по сей день.
Химического строения теория
Химического строения теория





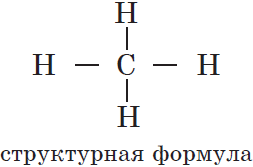
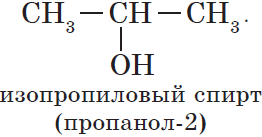
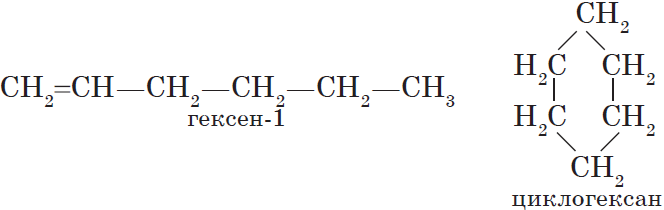
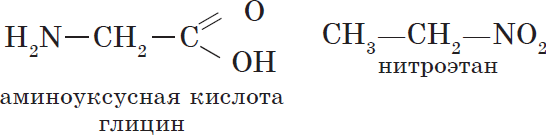

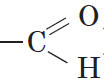 ), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.
), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.