можно ли вылечить экстрасистолию у ребенка
Экстрасистолия у детей
Экстрасистолия у детей — это разновидность аритмий, для которой характерны преждевременные сокращения сердца или его отдельных камер. Нарушения ритма возникают при органических кардиальных патологиях, расстройствах вегетативной регуляции, при нарушениях электролитного профиля крови или действии токсинов. Экстрасистолия проявляется приступами учащенного сердцебиения или перебоев в работе сердца, реже выявляются астеновегетативные симптомы. Для диагностики используют инструментальные методы: ЭКГ с суточным мониторированием, ЭхоКГ, функциональное тестирование. Лечение включает коррекцию режима и диеты, назначение метаболических и антиаритмических препаратов.
МКБ-10
Общие сведения
Экстрасистолия — самый распространенный вариант аритмии, который периодически наблюдается у 60-70% здоровых детей и не всегда указывает на наличие болезни. При классической ЭКГ внеочередные сердечные сокращения определяются у 0,8% новорожденных и 2,2% подростков, а при холтеровском мониторировании расстройства ритма выявляют у 18% и 50% соответственно. Множественные жизнеугрожающие экстрасистолы встречаются у 46% детей, перенесших кардиохирургические операции.
Причины
У детей, как правило, возникают функциональные экстрасистолы, которые обусловлены развитием и становлением сердечно-сосудистой системы, гормональными перестройками, бурным ростом ребенка. Они составляют до 90% всех экстрасистолий, беспокоят редко и обычно не являются поводом для волнения. Среди патологических причин этого вида аритмий выделяют следующие:
Патогенез
В формировании внеочередных сокращений выделяют 2 механизма: интракардиальные и экстракардиальные. Первая группа факторов включает нарушения образования, передачи и затухания импульсов по типу риентри (круговое возбуждение миокарда, которое повторяется несколько раз), эктопии (формирование сигналов из других участков миокарда, помимо синусового узла) и триггерной активности (задержка реполяризации).
Экстракардиальные механизмы в основном связаны с нарушением нейрогуморальной регуляции сердечной деятельности. При этом изменяются электрические процессы, которые происходят в клетках миокарда, и возникает дисбаланс симпатической и парасимпатической нервной системы. Это объясняет высокую частоту формирования экстрасистолий в детском возрасте на этапе становления нейрорегуляторной функции.
Классификация
В детской кардиологии наиболее важно деление экстрасистолий на наджелудочковые (суправентрикулярные) и желудочковые. Первые протекают с меньшим числом осложнений и часто являются бессимптомными находками, а вторые зачастую вызывают клинически значимые аритмии и ухудшения состояния. С практической точки зрения информативна классификация американского кардиолога Джона Биггера (J.T. Bigger) по степени опасности на 3 группы:
Симптомы экстрасистолии у детей
При суправентрикулярных экстрасистолах у ребенка крайне редко присутствуют специфические признаки. Если аритмия имеет клинические симптомы, они ограничиваются ощущением перебоев в сердечной деятельности или чувством кратковременного замирания сердца. На такие признаки могут пожаловаться дети школьного возраста, тогда как у малышей наджелудочковые внеочередные сокращения проходят незаметно и могут выявляться при обследовании у кардиолога по другому поводу.
При желудочковых формах экстрасистолии признаки проблемы отмечаются у 15% пациентов, они более выражены и доставляют ребенку серьезный дискомфорт. Могут быть жалобы на сильное сердцебиение, пропущенные сердечные удары, головокружение и дурноту во время множественных внеочередных сокращений. У детей развивается астеновегетативное состояние, которое проявляется слабостью, непереносимостью физических нагрузок и душных помещений.
Если экстрасистолы возникают вследствие органической кардиопатологии, в клинической картине преобладают ее признаки. При миокардитах беспокоят боли в сердце, одышка, возможно повышение температуры и общая слабость. Для кардиомиопатий характерна прогрессирующая сердечная недостаточность с учащением дыхания, отеками ног, в тяжелых случаях — с асцитом, нарушениями процессов роста и физического развития.
Осложнения
Суправентрикулярные единичные экстрасистолы не сопровождаются негативными последствиями и носят функциональный характер. У детей с частыми желудочковыми экстрасистолами есть риск развития фибрилляции желудочков — жизнеугрожающего состояния, которое может закончиться смертью, если вовремя не оказать помощь. Часто повторяющиеся аритмии чреваты хроническими расстройствами кровообращения, постоянным астеническим синдромом.
Диагностика
Обследованием ребенка занимается детский кардиолог. Сначала врач выясняет жалобы и собирает анамнез, затем производит физикальный осмотр с применением пальпации, перкуссии и аускультации. Данные обследования неспецифичны и помогают выявить только органическую сердечную патологию при ее наличии. Для обнаружения внеочередных сокращений и установления их причины в план обследования включаются:
Лечение экстрасистолии у детей
Лечение суправентрикулярных единичных экстрасистол не проводится, ребенку рекомендовано клиническое наблюдение. Если приступы аритмии повторяются часто, то могут назначаться бета-блокаторы или антагонисты кальция. Большую роль играет соблюдение режима учебы и отдыха, исключение нервных перенапряжений, ограничение компьютерных игр и просмотра фильмов. Из рациона питания исключают кофе и крепкий чай, способные спровоцировать приступы.
Часто повторяющаяся желудочковая экстрасистолия — показание к метаболической терапии антигипоксантами и антиоксидантами. При тяжелых аритмиях с сопутствующими расстройствами гемодинамики подбирают антиаритмические средства: антагонисты кальция, блокаторы натриевых каналов, бета-адреноблокаторы. У некоторых детей эффективно применение противосудорожных препаратов.
Антиаритмическая терапия проводится под контролем кардиограммы и холтеровского мониторирования. При правильной медикаментозной схеме число экстрасистол уменьшается на 50% в первые сутки, а количество парных внеочередных сокращений — более чем на 90%. Если экстрасистолия обусловлена органическим поражением сердца, требуется медикаментозное или хирургическое лечение основного заболевания.
Прогноз и профилактика
Большинство экстрасистолий у детей протекают без симптомов и осложнений, поэтому прогноз благоприятный. Вызывают опасения желудочковые полиморфные внеочередные сокращения, которые часто повторяются и сопровождаются нарушениями гемодинамики. Для профилактики аритмии нужно оградить ребенка от нервных и физических перегрузок, соблюдать рекомендации по рациональному питанию, вовремя выявлять и лечить кардиологические болезни.
Желудочковая экстрасистолия у детей: классификация, принципы наблюдения и лечения
Желудочковая экстрасистолия является частым нарушением ритма сердца у детей. Клиническое течение и прогноз заболевания определяются наличием патологии сердечно-сосудистой системы, устойчивостью и представленностью аритмии, эффективностью терапии. В статье
Premature ventricular contractions is a frequent disorder of heart rhythm in children. The clinical course and the forecast for the disease is defined by the presence of cardiovascular system pathology, stability and presence of arrhythmia, and therapy efficiency. The article gives classification of premature ventricular contractions, approaches to prescription of anti-arrhythmic therapy and radiofrequency ablation based on the available national and international guidelines.
Желудочковая экстрасистолия (ЖЭС) — это одно из наиболее частых нарушений ритма сердца во всех возрастных группах детей, особенно у подростков. Однако частая ЖЭС и ее «сложные» формы: бигеминия, парная, полиморфная ЖЭС, пробежки неустойчивой желудочковой тахикардии (до 3 комплексов QRS) встречаются редко [1–3].
Желудочковая экстрасистола — это преждевременное по отношению к основному желудочковому ритму возбуждение сердца, исходящее из источника, расположенного ниже разветвления пучка Гиса (ножки пучка Гиса, волокна Пуркинье, миокард желудочков). Желудочковая экстрасистолия — это повторяющиеся желудочковые экстрасистолы.
КОД ПО МКБ-10: I49.3 Преждевременная деполяризация желудочков.
Классификация ЖЭС строится на основании различных характеристик желудочковых экстрасистол, в первую очередь электрокардиографических, которые используются в формировании диагноза:
1. По наличию заболеваний сердца:
1.1. Органическая.
1.2. Идиопатическая.
2.1. Редкая.
2.2. Частая.
3. По циркадной представленности:
3.1. Дневная.
3.2. Ночная.
3.3. Смешанная.
4.1. Одиночная.
4.2. Парная (спаренная).
4.3. Три подряд (неустойчивая желудочковая тахикардия).
5. По периодичности:
5.1. Спорадическая.
5.2. Регулярная, аллоритмия (бигеминия — экстрасистола после каждого основного комплекса, тригеминия — экстрасистола после каждых двух основных комплексов, квадригеминия — после каждых трех и т. д.).
6. По форме комплекса QRS:
6.1. Мономорфная (одной формы).
6.2. Политопная (разной формы).
7. По количеству очагов возникновения:
7.1. Монотопная (из одного источника).
7.2. Политопная (из нескольких источников).
8. По времени появления экстрасистол в диастоле:
8.1. Сверхранняя (восходящее колено зубца Т).
8.2. Ранняя (нисходящее колено зубца Т).
8.3. Поздняя (за зубцом Т).
9. По отношению к основному ритму:
9.1. С полной компенсаторной паузой.
9.2. С неполной компенсаторной паузой.
9.3. С угнетением синусового узла.
9.4. Интерполированная (вставочная).
10. По анатомической локализации источника:
10.1. Правожелудочковая (из выходного тракта, верхушки, свободной стенки и т. д.).
10.2. Левожелудочковая.
10.3. Субэндокардиальная.
10.4. Субэпикардиальная.
У детей раннего возраста следует оценивать частоту ЖЭС в процентах от суточного ритма из-за высокой частоты сердечных сокращений базового ритма, у подростков количественная оценка ЖЭС примерно соответствует процентной составляющей от суточного ритма. Частой ЖЭС считают представленность аритмии на уровне более 5–7% от суточного ритма. В большинстве случаев у детей ЖЭС не связана с заболеваниями сердца, т. е. является «идиопатической». Критериями хорошего прогноза клинического течения ЖЭС у детей являются: отсутствие органических заболеваний сердца, отсутствие случаев внезапной сердечной смерти (ВCC) в семье, отсутствие жалоб, редкая ЖЭС, мономорфная ЖЭС, исчезновение ЖЭС на фоне физической нагрузки. При наличии у ребенка с ЖЭС структурных аномалий сердца и заболеваний миокарда прогноз значительно ухудшается. У детей с идиопатической ЖЭС не доказан риск возникновения желудочковой тахикардии (ЖТ) и риск ВСС, даже при наличии «сложных» форм ЖЭС. Однако не исключено изначальное совместное существование ЖЭС и ЖТ, поэтому одним из важных моментов обследования ребенка с ЖЭС является исключение наличия ЖТ, особенно у детей с такими жалобами, как внезапное ухудшение самочувствия, эпизоды головокружения, обмороки.
В клинической практике часто используют классификацию ЖЭС, предложенную B. Lown и M. Wolf в 1971 г. Следует учитывать, что данная градация ЖЭС была разработана для пациентов с острым инфарктом миокарда. Подразумевалось, что чем выше класс ЖЭС, тем выше риск возникновения фатальных желудочковых аритмий у данных пациентов, поэтому самой опасной была признана ранняя ЖЭС, способная вызвать ЖТ и фибрилляцию желудочков в остром периоде инфаркта миокарда. Для пациентов без острой ишемии миокарда, тем более у детей с идиопатической ЖЭС, ранние желудочковые экстрасистолы не имеют столь важного прогностического значения. Поэтому для детей более предпочтительной выглядит модификация данной классификации по M. Ryan (1975).
Подходы к лечению ребенка с ЖЭС строятся на оценке опасности нарушения ритма сердца и имеющихся жалоб пациента. Дети даже с частой ЖЭС редко жалуются на перебои в работе сердца. Врач отмечает нерегулярный пульс и аритмию при аускультации сердца. ЖЭС нарушает правильность сердечного ритма из-за преждевременности сокращений желудочков и постэкстрасистолических пауз.
Серьезной угрозой частой идиопатической ЖЭС считается возможность развития аритмогенной кардиомиопатии, что наблюдается крайне редко. Динамическое наблюдение за детьми с ЖЭС, проведение контрольной эхокардиографии 1–2 раза в год позволяют контролировать изменения размеров сердца и сократительной способности миокарда, вовремя назначать лечение. Причинами развития аритмогенной кардиомиопатии, связанной с ЖЭС, может быть ряд факторов: гемодинамическая неполноценность ЖЭС из-за укорочения времени диастолического наполнения желудочков, снижения ударного объема и нарушения перфузии миокарда, желудочковая диссинхрония из-за неправильной последовательности возбуждения миокарда, ремоделирование сердца в результате нарушения ионного обмена в кардиомиоцитах [4–5]. Угроза развития аритмогенной кардиомиопатии повышается при очень частой ЖЭС, когда ее представленность превышает 20–25% от суточного ритма, когда имеются «сложные» формы данной аритмии, например, длительная бигеминия, частые пробежки неустойчивой ЖТ.
В большинстве случаев идиопатическая ЖЭС не требует назначения антиаритмической терапии (ААТ). Ребенок с ЖЭС нуждается в первую очередь в наблюдении, лечении хронических заболеваний, в особенности патологии желудочно-кишечного тракта, ЛОР-органов, нервной системы, опорно-двигательного аппарата. Необходимо нормализовать режим дня, сна, отдыха ребенка, исключить стимуляторы (крепкий чай, кофе, энергетики и т. д.). При гипокалиемии хороший эффект можно ожидать от препаратов калия. Показана витаминотерапия с макро- и микроэлементами.
По нашему опыту, наиболее часто антиаритмическая терапия требуется детям с частой идиопатической ЖЭС (обычно более 20% в сутки) с выявленными признаками снижения сократительной способности миокарда и/или расширения камер сердца, т. е. с начальными признаками аритмогенной кардиомиопатии. При устойчивом характере ЖЭС, неэффективности ААТ рассматривается вопрос о проведении радиочастотной аблации (РЧА) источника ЖЭС. Такое представление соответствует национальным и международным рекомендациям [1, 6, 7]. В подробном документе о лечении желудочковых аритмий у детей без заболеваний сердца, разработанном совместно специалистами Общества детской и врожденной электрофизиологии (Pediatric and congenitalelectrophysiology society, PACES) и Общества нарушений сердечного ритма (Heart Rhythm Society, HRS), одобренном Американским колледжем кардиологов (American College of Cardiology, ACC) и Американской академией педиатрии (American Academy of Pediatrics, ААP), предложен следующий алгоритм выбора метода лечения [6]:
Показания класса I:
Показания класса IIА:
При наличии у пациента симптомов заболевания, которые коррелируют с частой ЖЭС или ускоренным идиовентрикулярным ритмом, следует рассмотреть вопрос об антиаритмической терапии β-адреноблокаторами или проведении РЧА источника аритмии.
Имеется ряд принципиальных моментов при назначении ААТ у детей. Назначение препарата, подбор дозы осуществляются под контролем ЭКГ. ААТ считается эффективной при уменьшении представленности ЖЭС более чем на 50%, парной ЖЭС более чем на 90%, отсутствии пробежек ЖТ. Препаратом первой линии является пропранолол, он наиболее эффективен при дневной ЖЭС, особенно связанной с физической нагрузкой. Препаратами второй линии являются блокаторы натриевых каналов IС класса (пропафенон, аллапинин), их назначать рекомендуется только в стационаре из-за возможного проаритмогенного эффекта. Аллапинин может быть выбран при сочетании брадикардии и ЖЭС. Амиодарон детям с идиопатической ЖЭС обычно не рекомендуется, при выборе между данным препаратом III класса и возможностью проведения РЧА большинство специалистов в настоящее время выбирают интервенционный вариант лечения как радикальный и более эффективный, чем ААТ. При назначении ААТ следует помнить, что побочные и проаритмогенные эффекты препаратов могут быть значительно опасней, чем ЖЭС, поэтому лечение должно проводиться строго по имеющимся рекомендациям.
Препараты и дозы для ААТ у детей с ЖЭС:
У детей с ЖЭС на фоне патологии сердца показано лечение основного заболевания, коррекция метаболических нарушений в миокарде. При частой ЖЭС, рефрактерной к ААТ, осложненной развитием аритмогенной кардиомиопатии, целесообразно рассмотреть вопрос о проведении РЧА. Имеются следующие международные рекомендации по проведению РЧА у детей с желудочковыми аритмиями [6]:
Показания класса I:
Наличие аритмогенной дисфункции миокарда, развившейся на фоне частой ЖЭС. РЧА может быть проведена при неэффективности ААТ либо может быть первой линией терапии.
Показания класса IIА:
Наличие симптомов заболевания, которые коррелируют с частой ЖЭС или ускоренным идиовентрикулярным ритмом.
Класс III (противопоказания):
Таким образом, в большинстве случаев идиопатическая желудочковая экстрасистолия у детей имеет благоприятное течение и не требует антиаритмической терапии. В тех редких случаях, когда частая желудочковая экстрасистолия носит устойчивый характер, плохо переносится ребенком или приводит к развитию аритмогенной кардиомиопатии, приходится прибегать к назначению антиаритмической терапии, которая требует настороженности врача в отношении побочных и проаритмогенных эффектов препаратов. Еще в более редких случаях детям с желудочковой экстрасистолией требуется проведение радиочастотной аблации источника аритмии, что является более эффективным методом лечения, чем антиаритмическая терапия, но имеются риск осложнений из-за инвазивности процедуры и возрастные ограничения по проведению у детей первых лет жизни.
Литература
* ГБОУ ВПО СпбГПМУ МЗ РФ, Санкт-Петербург
** ФГБУ НМИЦ им. В. А. Алмазова МЗ РФ, Санкт-Петербург
Желудочковая экстрасистолия у детей: классификация, принципы наблюдения и лечения/ Т. К. Кручина, Е. С. Васичкина, К. Б. Алексеева, Г. А. Новик
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 35-37
Теги: желудочковая экстрасистолия, дети, антиаритмическая терапия, радиочастотная аблация
Экстрасистолия у детей
Экстрасистолией у детей принято называть одну из разновидностей аритмий. Именно она распространена в 75% случаев с жалобами на внезапное сердечное сокращение или «перебои в сердце». Орган преждевременно возбуждается и сокращается.
Причины экстрасистолии у детей
Желудочковая или наджелудочковая экстрасистолия у детей может возникать по физиологическим или патологическим причинам. В первом случае к нарушениям сердечного ритма приводят:
Такие внеочередные сокращения постепенно исчезают без каких-либо вмешательств.
Патологические нарушения обусловлены:
Виды экстрасистолии
Во врачебной практике принято выделять следующие виды заболевания:
Все зависит от локализации и частоты внеочередных сердечных сокращений. Также аритмия может быть полиморфной, мономорфной или групповой.
Симптомы заболевания
В большинстве случаев экстрасистолы не приносят никаких неприятных ощущений. Они могут происходить днем и ночью, но ребенок не будет обращать на них никакого внимания.
Однако есть нарушения в сердечной деятельности, которые сопровождаются:
Как диагностируется экстрасистолия
Диагностировать экстрасистолию у детей помогают опытные врачи кардиологи. Это специалисты узкого профиля, которые внимательно относятся к проблемам, связанным с сердечной деятельностью.
В качестве дополнительной диагностики назначают:
Необходимо, чтобы помимо кардиолога, ребенка также осмотрели невролог и эндокринолог.
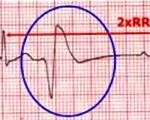
Особо важная роль в диагностике экстрасистолии (нарушении ритма) у ребенка принадлежит ЭКГ. Электрокардиограмма позволяет зафиксировать частоту повторений «перебоев», локализацию и вид заболевания. При распечатке результатов наблюдается укорочение интервалов сердечного цикла и изменение зуба Р. При желудочковой экстрасистолии у детей наблюдается пауза после регистрации «перебоев» и отсутствие зубца Р.
В нашей клинике работают опытные сотрудники, которые знают все о работе сердца, методах диагностики его заболеваний и эффективном лечении.
Лечение заболевания
Если результаты проведенной диагностики выявили лишь единичные сердечные сокращения, которые не приносят ребенку никакой боли или недомогания, то проведение лечения экстрасистолии у детей не проводится.
Если внеочередных сокращений зафиксировано много, то возникает необходимость терапии, предписанной кардиологом и неврологом.
При этом врачи могут назначать:
Дозировка и способ приема лекарств определяется индивидуально для каждого случая. Курс лечения составляет 3 месяца не менее двух раз в год.
При наличии патологической экстрасистолии у детей кардиолог назначает:
Временно пациента отстраняют от занятий физкультурой и спортом в целом, если выясняется прямая зависимость между нагрузками или внеочередными сердечными сокращениями.
Как записаться к детскому кардиологу
Опытные кардиологи, которые занимаются лечением заболеваний своего профиля, а также умеют найти подход к самым маленьким пациентам, работают в АО «Медицина» (клиника академика Ройтберга). Клиника расположена в Москве по адресу: метро Маяковская, 2-й Тверской-Ямской пер., 10.
Для записи на прием вы можете позвонить по контактному телефону +7 (495) 995-00-33, оставить запрос на обратный звонок на сайте или самостоятельно заполнить онлайн-формы.
ЭКСТРАСИСТОЛИЯ: клиническое значение, диагностика и лечение
Экстрасистолами называют преждевременные комплексы (преждевременные сокращения), выявляемые на ЭКГ. По механизму возникновения преждевременные комплексы подразделяются на экстрасистолы и парасистолы. Различия между экстрасистолией и парасистолией являютс
Экстрасистолами называют преждевременные комплексы (преждевременные сокращения), выявляемые на ЭКГ. По механизму возникновения преждевременные комплексы подразделяются на экстрасистолы и парасистолы. Различия между экстрасистолией и парасистолией являются чисто электрокардиографическими или электрофизиологическими. Клиническое значение и лечебные мероприятия при экстрасистолии и парасистолии абсолютно одинаковы. По локализации источника аритмии электросистолы разделяют на наджелудочковые и желудочковые.
Экстрасистолы, несомненно, являются самым распространенным нарушением ритма сердца. Они часто регистрируются и у здоровых лиц. При проведении суточного мониторирования ЭКГ статистической «нормой» экстрасистол считается примерно до 200 наджелудочковых экстрасистол и до 200 желудочковых экстрасистол в сутки. Экстрасистолы могут быть одиночными или парными. Три и более экстрасистолы подряд принято называть тахикардией («пробежки» тахикардии, «короткие эпизоды неустойчивой тахикардии»). Неустойчивой тахикардией называют эпизоды тахикардии продолжительностью менее 30 с. Иногда для обозначения 3–5 экстрасистол подряд используют определение «групповые», или «залповые», экстрасистолы. Очень частые экстрасистолы, особенно парные и рецидивирующие «пробежки» неустойчивой тахикардии, могут достигать степени непрерывно-рецидивирующей тахикардии, при которой от 50 до 90% сокращений в течение суток составляют эктопические комплексы, а синусовые сокращения регистрируются в виде единичных комплексов или коротких кратковременных эпизодов синусового ритма.
В практической работе и научных исследованиях основное внимание уделяют желудочковой экстрасистолии. Одной из наиболее известных классификаций желудочковых аритмий является классификация B. Lown и M. Wolf (1971).
Предполагалось, что высокие градации экстрасистол (классы 3–5) являются наиболее опасными. Однако в дальнейших исследованиях было установлено, что клиническое и прогностическое значение экстрасистолии (и парасистолии) практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) экстрасистолия, включая эпизоды неустойчивой желудочковой тахикардии и даже непрерывно-рецидивирующей тахикардии, не влияет на прогноз и не представляет опасности для жизни. Аритмии у лиц без признаков органического поражения сердца называют идиопатическими. У больных с органическим поражением миокарда (постинфарктный кардиосклероз, дилатация и/или гипертрофия левого желудочка) наличие экстрасистолии считается дополнительным прогностически неблагоприятным признаком. Но даже в этих случаях экстрасистолы не имеют самостоятельного прогностического значения, а являются отражением поражения миокарда и дисфункции левого желудочка.
В 1983 г J. T. Bigger предложил прогностическую классификацию желудочковых аритмий.
Однако, как было отмечено, независимого прогностического значения желудочковая экстрасистолия не имеет. Сами по себе экстрасистолы в большинстве случаев безопасны. Экстрасистолию даже называют «косметической» аритмией, подчеркивая этим ее безопасность. Даже «пробежки» неустойчивой желудочковой тахикардии тоже относят к «косметическим» аритмиям и называют «энтузиастическими выскальзывающими ритмами» (R. W. Campbell, K. Nimkhedar, 1990). В любом случае лечение экстрасистолии с помощью антиаритмических препаратов (ААП) не улучшает прогноз. В нескольких крупных контролируемых клинических исследованиях было выявлено заметное повышение общей смертности и частоты внезапной смерти (в 2–3 раза и более) у больных с органическим поражением сердца на фоне приема ААП класса I, несмотря на эффективное устранение экстрасистол и эпизодов желудочковой тахикардии. Наиболее известным исследованием, в котором впервые было выявлено несоответствие клинической эффективности препаратов и их влияния на прогноз, является исследование CAST. В исследовании CAST («исследование подавления аритмий сердца») у больных, перенесших инфаркт миокарда, на фоне эффективного устранения желудочковой экстрасистолии препаратами класса I С (флекаинид, энкаинид и морицизин) выявлено достоверное увеличение общей смертности в 2,5 раза и частоты внезапной смерти в 3,6 раза по сравнению с больными, принимавшими плацебо. Результаты исследования заставили пересмотреть тактику лечения не только пациентов с нарушениями ритма, но и кардиологических больных вообще. Исследование CAST является одним из основных в становлении «медицины, основанной на доказательствах». Только на фоне приема β- адреноблокаторов и амиодарона отмечено снижение смертности больных с постинфарктным кардиосклерозом, сердечной недостаточностью или реанимированных пациентов. Однако положительное влияние амиодарона и особенно β-адреноблокаторов не зависело от антиаритмического действия этих препаратов.
Выявление экстрасистолии (как и любого другого варианта нарушений ритма) является поводом для обследования, направленного прежде всего на выявление возможной причины аритмии, заболевания сердца или экстракардиальной патологии и определения функционального состояния миокарда.
ААП не излечивают от аритмии, а только устраняют ее на период приема препаратов. При этом побочные реакции и осложнения, связанные с приемом практически всех препаратов, могут быть гораздо более неприятными и опасными, чем экстрасистолия. Таким образом, само по себе наличие экстрасистолии (независимо от частоты и «градации») не является показанием для назначения ААП. Бессимптомные или малосимптомные экстрасистолы не требуют проведения специального лечения. Таким больным показано диспансерное наблюдение с проведением эхокардиографии примерно 2 раза в год для выявления возможных структурных изменений и ухудшения функционального состояния левого желудочка. Л. М. Макаров и О. В. Горлицкая (2003) при длительном наблюдении за 540 больными с идиопатической частой экстрасистолией (более 350 экстрасистол в час и более 5000 в сутки) выявили у 20% больных увеличение полостей сердца («аритмогенная кардиомиопатия»). Причем более часто увеличение полостей сердца отмечалось при наличии предсердной экстрасистолии.
Показания для лечения экстрасистолии:
Лечение экстрасистолии
Необходимо объяснить больному, что малосимптомная экстрасистолия безопасна, а прием антиаритмических препаратов может сопровождаться неприятными побочными эффектами или даже вызвать опасные осложнения. Прежде всего необходимо устранить все потенциально аритмогенные факторы: алкоголь, курение, крепкий чай, кофе, прием симпатомиметических препаратов, психоэмоциональное напряжение. Следует немедленно приступить к соблюдению всех правил здорового образа жизни.
При наличии показаний для назначения ААП у больных с органическим поражением сердца используют β-адреноблокаторы, амиодарон и соталол. У больных без признаков органического поражения сердца, кроме этих препаратов, применяют ААП класса I: Этацизин, Аллапинин, Пропафенон, Кинидин Дурулес. Этацизин назначают по 50 мг 3 раза в день, Аллапинин — по 25 мг 3 раза в день, Пропафенон — по 150 мг 3 раза в день, Кинидин Дурулес — по 200 мг 2–3 раза в день.
Лечение экстрасистолии проводят методом проб и ошибок, последовательно (по 3–4 дня) оценивая эффект приема антиаритмических препаратов в средних суточных дозах (с учетом противопоказаний), выбирая наиболее подходящий для данного больного. Для оценки антиаритмического эффекта амиодарона может потребоваться несколько недель или даже месяцев (применение более высоких доз амиодарона, например по 1200 мг/сут, может сократить этот период до нескольких дней).
Эффективность амиодарона в подавлении желудочковых экстрасистол составляет 90–95%, соталола — 75%, препаратов класса I C — от 75 до 80% (B. N. Singh, 1993).
Критерий эффективности ААП — исчезновение ощущения перебоев, улучшение самочувствия. Многие кардиологи предпочитают начинать подбор препаратов с назначения β-адреноблокаторов. У больных с органическим поражением сердца при отсутствии эффекта от β-адреноблокаторов применяют Амиодарон, в том числе в комбинации с первыми. У больных с экстрасистолией на фоне брадикардии подбор лечения начинают с назначения препаратов, ускоряющих ЧСС: можно попробовать прием пиндолола (Вискен), эуфиллина (Теопек) или препаратов класса I (Этацизин, Аллапинин, Кинидин Дурулес). Назначение холинолитических препаратов типа белладонны или симпатомиметиков менее эффективно и сопровождается многочисленными побочными явлениями.
В случае неэффективности монотерапии оценивают эффект комбинаций различных ААП в уменьшенных дозах. Особенно популярны комбинации ААП с β-адреноблокаторами или амиодароном.
Есть данные, что одновременное назначение β-адреноблокаторов (и амиодарона) нейтрализует повышенный риск от приема любых антиаритмических средств. В исследовании CAST у больных, перенесших инфаркт миокарда, которые наряду с препаратами класса I C принимали β-адреноблокаторы не было отмечено увеличения смертности. Более того, было выявлено снижение частоты аритмической смерти на 33%!
Особенно эффективна комбинация β-адреноблокаторов и амиодарона. На фоне приема такой комбинации наблюдалось еще большее снижение смертности, чем от каждого препарата в отдельности. Если ЧСС превышает 70–80 уд./мин в покое и интервал P–Q в пределах 0,2 с, то проблемы с одновременным назначением амиодарона и β-адреноблокаторов нет. В случае брадикардии или АВ-блокады I–II степени для назначения амиодарона, β-адреноблокаторов и их комбинации необходима имплантация кардиостимулятора, функционирующего в режиме DDD (DDDR). Есть сообщения о повышении эффективности антиаритмической терапии при сочетании ААП с ингибиторами АПФ, блокаторами рецепторов ангиотензина, статинами и препаратами омега-3-ненасыщенных жирных кислот.
Некоторые противоречия существуют в отношении применения амиодарона. С одной стороны, некоторые кардиологи назначают амиодарон в последнюю очередь — только при отсутствии эффекта от других препаратов (считая, что амиодарон довольно часто вызывает побочные явления и требует длительного «периода насыщения»). С другой стороны, возможно, более рационально начинать подбор терапии именно с амиодарона как наиболее эффективного и удобного для приема препарата. Амиодарон в малых поддерживающих дозах (100–200 мг в день) редко вызывает серьезные побочные явления или осложнения и является скорее даже более безопасным и лучше переносимым, чем большинство других антиаритмических препаратов. В любом случае при наличии органического поражения сердца выбор небольшой: β-адреноблокаторы, амиодарон или соталол. При отсутствии эффекта от приема амиодарона (после «периода насыщения» — как минимум по 600–1000 мг/сут в течение 10 дней) можно продолжить его прием в поддерживающей дозе — 0,2 г/сут и, при необходимости, оценить эффект последовательного добавления препаратов класса I С (Этацизин, Пропафенон, Аллапинин) в половинных дозах.
У больных с сердечной недостаточностью заметное уменьшение количества экстрасистол может отмечаться на фоне приема ингибиторов АПФ и Верошпирона.
Следует отметить, что проведение суточного мониторирования ЭКГ для оценки эффективности антиаритмической терапии утратило свое значение, так как степень подавления экстрасистол не влияет на прогноз. В исследовании CAST выраженное увеличение смертности отмечено на фоне достижения всех критериев полного антиаритмического эффекта: уменьшения общего количества экстрасистол более чем на 50%, парных экстрасистол — не менее чем на 90% и полное устранение эпизодов желудочковой тахикардии. Основным критерием эффективности лечения является улучшение самочувствия. Это обычно совпадает с уменьшением количества экстрасистол, а определение степени подавления экстрасистолии не имеет значения.
В целом последовательность подбора ААП у больных с органическим заболеванием сердца, при лечении рецидивирующих аритмий, включая экстрасистолию, можно представить в следующем виде.
У больных без признаков органического поражения сердца можно использовать любые препараты, в любой последовательности или использовать схему, предложенную для больных с органическим заболеванием сердца.
Краткая характеристика ААП
β-адреноблокаторы. После исследования CAST и опубликования результатов метаанализа исследований по применению ААП класса I, в котором было показано, что практически все ААП класса I способны увеличивать смертность у больных с органическим поражением сердца, β-адреноблокаторы стали самыми популярными антиаритмическими препаратами.
Антиаритмический эффект β-адреноблокаторов обусловлен именно блокадой β-адренергических рецепторов, т. е. уменьшением симпатико-адреналовых влияний на сердце. Поэтому β-адреноблокаторы наиболее эффективны при аритмиях, связанных с симпатико-адреналовыми влияниями — так называемые «катехоламинзависимые» или «адренергические аритмии». Возникновение таких аритмий, как правило, связано с физической нагрузкой или психоэмоциональным напряжением.
Катехоламинзависимые аритмии в большинстве случаев одновременно являются «тахизависимыми», т. е. возникают при достижении определенной критической частоты сердечных сокращений, например во время физической нагрузки частая желудочковая экстрасистолия или желудочковая тахикардия возникают только при достижении частоты синусового ритма 130 сокращений в минуту. На фоне приема достаточной дозы β-адреноблокаторов больной не сможет достичь частоты 130 уд./мин при любом уровне физической нагрузки, таким образом предотвращается возникновение желудочковых аритмий.
β-адреноблокаторы являются препаратами выбора для лечения аритмий при врожденных синдромах удлинения интервала Q–T.
При аритмиях, не связанных с активацией симпатической нервной системы β-адреноблокаторы гораздо менее эффективны, но добавление β-адреноблокаторов нередко значительно увеличивает эффективность других антиаритмических препаратов и снижает риск аритмогенного эффекта ААП класса I. Препараты класса I в сочетании с β-адреноблокаторами не увеличивают смертность у больных с им поражением сердца (исследование CAST).
При так называемых «вагусных» аритмиях β-адреноблокаторы оказывают аритмогенное действие. «Вагусные» аритмии возникают в состоянии покоя, после еды, во время сна, на фоне урежения ЧСС («брадизависимые» аритмии). Вместе с тем в некоторых случаях при брадизависимых аритмиях эффективно применение пиндолола (Вискен) — β-адреноблокатора с внутренней симпатомиметической активностью (ВСА). Кроме пиндолола к β-адреноблокаторам с ВСА относятся окспренолол (Тразикор) и ацебутолол (Сектраль), однако в максимальной степени внутренняя симпатомиметическая активность выражена именно у пиндолола.
Дозы β-адреноблокаторов регулируют в соответствии с антиаритмическим эффектом. Дополнительным критерием достаточной β-блокады является снижение ЧСС до 50 уд./мин в состоянии покоя. В прежние годы, когда основным β-адреноблокатором был пропранолол (Анаприлин, Обзидан), известны случаи эффективного применения пропранолола при желудочковых аритмиях в дозах до 960 мг/сут и более, например до 4 г в день! (R. L. Woosley et al., 1979).
Амиодарон. Амиодарон таблетки 0,2 г. (оригинальным препаратом является Кордарон) обладает свойствами всех четырех классов ААП и, кроме того, оказывает умеренное a-блокирующее действие. Амиодарон, несомненно, является самым эффективным из существующих антиаритмических препаратов. Его даже называют «аритмолитическим препаратом».
Основным недостатком амиодарона является высокая частота экстракардиальных побочных эффектов, которые при длительном приеме наблюдаются у 10–75% больных. Однако необходимость в отмене амиодарона возникает у 5–25% (J. A. Johus et al., 1984; J. F. Best et al., 1986; W. M. Smith et al., 1986). К основным побочным эффектам амиодарона относятся: фотосенсибилизация, изменение цвета кожи, нарушение функции щитовидной железы (как гипотиреоз, так и гипертиреоз), повышение активности печеночных трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения. Большинство этих побочных эффектов обратимы и исчезают после отмены или при уменьшении дозы амиодарона. Гипотиреоз можно контролировать с помощью приема левотироксина. Наиболее опасным побочным эффектом амиодарона является поражение легких («амиодароновое поражение легких») — возникновение интерстициального пневмонита или, реже, легочного фиброза. У большинства больных поражение легких развивается только при длительном приеме сравнительно больших поддерживающих доз амиодарона — более 400 мг/сут. Такие дозы крайне редко применяют в России. Поддерживающая доза амиодарона в России обычно составляет 200 мг/сут или даже меньше (по 200 мг в день 5 дней в неделю). B. Clarke и соавторы (1985) сообщают лишь о трех случаях из 48 наблюдений возникновения этого осложнения на фоне приема амиодарона в дозе 200 мг в сутки.
В настоящее время изучается эффективность дронедарона, деривата амиодарона без йода. Предварительные данные свидетельствуют об отсутствии экстракардиальных побочных эффектов у дронедарона.
Соталол. Соталол (Соталекс, Сотагексал) таблетки 160 мг применяется в средней суточной дозе 240–320 мг. Начинают с назначения 80 мг 2 раза в день. При рефрактерных аритмиях иногда используют прием соталола до 640 мг/сут. β-адреноблокирующее действие соталола проявляется начиная с дозы 25 мг.
На фоне приема соталола имеется повышенный риск развития желудочковой тахикардии типа «пируэт». Поэтому прием соталола желательно начинать в стационаре. При назначении соталола необходимо тщательно контролировать величину интервала Q–T, особенно в первые 3 дня. Корригированный интервал Q–T не должен превышать 0,5 с. В этих случаях риск развития тахикардии типа «пируэт» менее 2%. С увеличением дозы соталола и степени удлинения интервала Q–T значительно увеличивается риск развития тахикардии типа «пируэт». Если корригированный интервал Q–T превышает 0,55 с — риск тахикардии типа «пируэт» достигает 11%. Поэтому при удлинении интервала Q–T до 0,5 с необходимо уменьшить дозу соталола или отменить препарат.
Побочные эффекты соталола соответствуют типичным побочным эффектам β-адреноблокаторов.
Этацизин. Этацизин таблетки 50 мг. Наиболее изученный отечественный препарат (создан в СССР). Для лечения аритмий применяется с 1982 г. Быстрое достижение клинического эффекта позволяет с успехом использовать Этацизин у лиц без органического поражения сердца для лечения желудочковых и наджелудочковых нарушений ритма: экстрасистолии, всех вариантов пароксизмальных и хронических тахиаритмий, в том числе мерцательной аритмии, при синдроме Вольфа–Паркинсона–Уайта. Наиболее эффективен Этацизин у пациентов с ночными аритмиями, а также при желудочковой экстрасистолии.Средняя суточная доза Этацизина составляет 150 мг (по 50 мг 3 раза в день). Максимальная суточная доза — 250 мг. При назначении этацизина для предупреждения рецидивирования мерцательной аритмии, наджелудочковых и желудочковых тахикардий его эффективность, как правило, превосходит эффективность других АПП класса I. Препарат хорошо переносится, необходимость в отмене возникает примерно у 4% больных. Основные побочные эффекты: головокружение, головная боль, «онемение» языка, нарушение фиксации взора. Обычно побочные реакции наблюдаются сравнительно редко, и их выраженность уменьшается после первой недели приема Этацизина.
Аллапинин. Отечественный препарат Аллапинин, таблетки 25 мг (создан также в СССР) применяется в клинической практике с 1986 г. Назначают по 25–50 мг 3 раза в день. Максимальная суточная доза составляет 300 мг. Аллапинин довольно эффективен при наджелудочковых и желудочковых аритмиях. Основные побочные явления — головокружение, головная боль, нарушение фиксации взора. Необходимость в отмене возникает примерно у 6% больных. Одной из особенностей аллапинина и теоретически его недостатком является наличие β-адреностимулирующего действия.
Пропафенон (Ритмонорм, Пропанорм), таблетки 150 мг, ампулы 10 мл (35 мг). Назначают по 150–300 мг 3 раза в день. При необходимости дозу увеличивают до 1200 мг/сут. Пропафенон, кроме замедления проведения, слегка удлиняет рефрактерные периоды во всех отделах сердца. Кроме того, пропафенон обладает небольшим β-адреноблокирующим действием и свойствами антагонистов кальция.
К основным побочным эффектам пропафенона относятся головокружение, нарушение фиксации взора, атаксия, тошнота, металлический вкус во рту.
Хинидин. В настоящее время в России используют в основном Кинидин Дурулес, табл. по 0,2 г. Разовая доза составляет 0,2–0,4 г, средняя суточная доза — от 0,6 до 1,0 г. Максимальная суточная доза хинидина в прежние годы (когда хинидин был основным антиаритмическим препаратом) достигала 4,0 г! В настоящее время такие дозы не используются и примерной максимальной суточной дозой хинидина можно считать 1,6 г.
В небольших дозах (600–800 мг/сут) хинидин хорошо переносится. Побочные явления возникают обычно при более высоких дозах. К наиболее частым побочным эффектам при приеме хинидина относятся нарушения функции желудочно-кишечного тракта: тошнота, рвота, понос. Реже отмечаются головная боль, головокружения, ортостатическая гипотония. Самое опасное осложнение от приема хинидина — возникновение желудочковой тахикардии типа «пируэт». По данным литературы, это осложнение наблюдается у 1–3% больных, принимающих хинидин.
П. Х. Джанашия, доктор медицинских наук, профессор
С. В. Шлык, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
РГМУ, Москва
.gif)
