что такое слабый электролит
Слабые электролиты – список
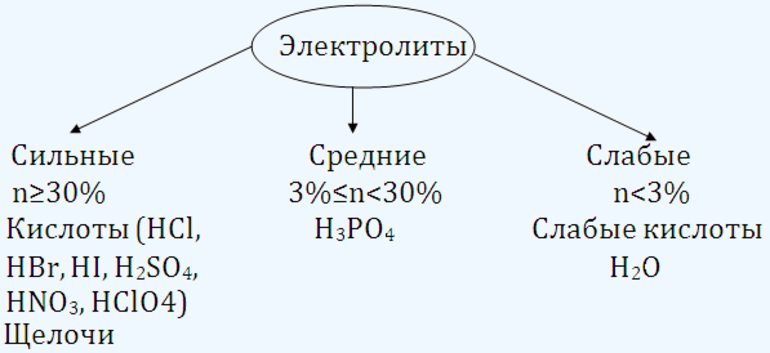
Электролиты классифицируются на две группы в зависимости от степени диссоциации – сильные и слабые электролиты. Сильные электролиты имеют степень диссоциации больше единицы или больше 30 %, слабые – меньше единицы или меньше 3 %.
Процесс диссоциация
Электролитическая диссоциация – процесс распада молекул на ионы – положительно заряженные катионы и отрицательно заряженные анионы. Заряженные частицы переносят электрический ток. Электролитическая диссоциация возможна только в растворах и расплавах.
Движущей силой диссоциации является распад ковалентных полярных связей под действием молекул воды. Полярные молекулы оттягиваются водными молекулами. В твёрдых веществах разрушаются ионные связи в процессе нагревания. Высокие температуры вызывают колебания ионов в узлах кристаллической решётки.
Рис. 1. Процесс диссоциации.
Вещества, которые легко распадаются на ионы в растворах или в расплавах и, следовательно, проводят электрический ток, называются электролитами. Неэлектролиты не проводят электричество, т.к. не распадаются на катионы и анионы.
В зависимости от степени диссоциации различают сильные и слабые электролиты. Сильные растворяются в воде, т.е. полностью, без возможности восстановления распадаются на ионы. Слабые электролиты распадаются на катионы и анионы частично. Степень их диссоциации меньше, чем у сильных электролитов.
Степень диссоциация показывает долю распавшихся молекул в общей концентрации веществ. Она выражается формулой α = n/N.
Рис. 2. Степень диссоциации.
Слабые электролиты
Список слабых электролитов:
Рис. 3. Таблица растворимости.
Реакция диссоциации записывается с помощью ионного уравнения:
Многоосновные кислоты диссоциируют ступенчато:
Нерастворимые основания также распадаются поэтапно:
Воду относят к слабым электролитам. Вода практически не проводит электрический ток, т.к. слабо распадается на катионы водорода и анионы гироксид-иона. Образовавшиеся ионы обратно собираются в молекулы воды:
Если вода легко проводит электричество, значит, в ней есть примеси. Дистиллированная вода неэлектропроводная.
Диссоциация слабых электролитов обратима. Образовавшиеся ионы вновь собираются в молекулы.
Что мы узнали?
К слабым электролитам относятся вещества, частично распадающиеся на ионы – положительные катионы и отрицательные анионы. Поэтому такие вещества плохо проводят электрический ток. К ним относятся слабые и разбавленные кислоты, нерастворимые основания, малорастворимые соли. Наиболее слабый электролит – вода. Диссоциация слабых электролитов – обратимая реакция.
Сильные и слабые электролиты — степень диссоциации
Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Неэлектролиты — вещества, расплавы или растворы которых не могут проводить электрический ток.
Диссоциация и степень диссоциации
Диссоциация — это распад соединений на ионы.
Степень диссоциации (α) — это отношения числа продиссоциировавших, то есть распавшихся на ионы молекул к их общему числу растворенных молекул.
Формула:
Стрелкой → обозначают распад соединений на ионы.
Стрелкой ← обозначают обратный процесс.
Сильные электролиты
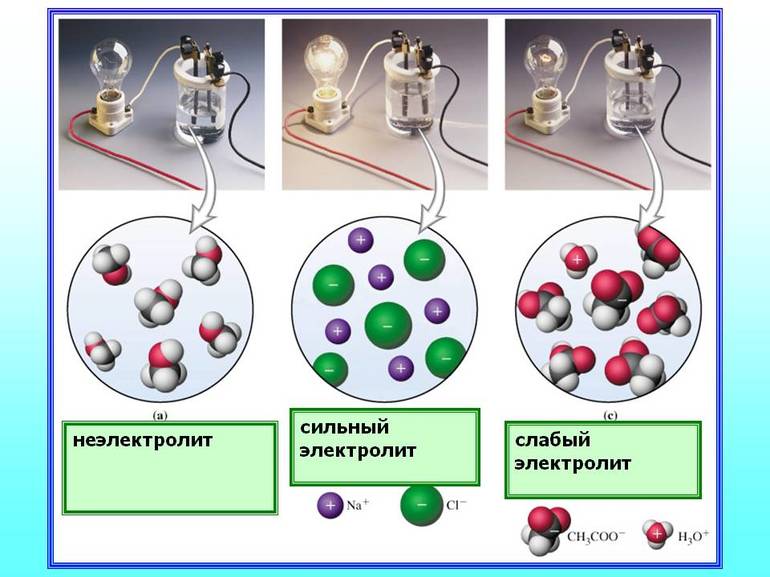
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак равенства (=) для сильных электролитов.
К сильным электролитам относятся:
Слабые электролиты
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.
К слабым электролитам относятся:
Сильные и слабые электролиты
Как различить сильные и слабые электролиты? Сильные электролиты в растворах почти полностью диссоциированы. К данной группе в большой степени относятся соли, сильные кислоты и щелочи. Слабые электролиты включают слабые основания и кислоты, а также некоторые соли, цианид ртути (II), хлорид ртути (II), иодид кадмия и роданид железа (II).
Степень диссоциации, сильные и слабые электролиты — видео
Суть процесса
Под понятием электролитической диссоциации подразумевается распад молекул до состояния ионов. Последние представлены отрицательно заряженными частицами, именующимися анионами, и положительными аналогами — катионами. Такие ионы отличатся тем, что способны переносить электроток.
Диссоциация может происходить только в сфере расплавов и растворов. Движущая сила процесса представлена распадом, который происходит между ковалентными связями полярного типа при оказании действия молекулами воды, которые обеспечивают их оттягивание. Если рассматривать твердые вещества, в них связи на ионном уровне разрушаются вследствие проведения нагрева. Под действием высоких температур происходит колебание на уровне узлов кристаллических решеток.
Электролитами принято называть вещества, легко разрушающиеся до состояния ионов при обеспечении необходимых условий, свободно проводящие электрический ток.
Что касается неэлектролитов, у них отсутствует способность передачи электричества, поскольку они не распадаются до состояния анионов и катионов.
Принцип разделения веществ
Диссоциация может осуществляться с различной степенью, ее результатом являются слабые электролиты и сильные.
В первом случае происходит частичное распадение на анионы с катионами. Второй вариант отличается тем, что в водной среде происходит полное растворение с образованием ионов, возможность восстановления отсутствует.
Если рассматривать значение диссоциации, оно определяет часть молекул, подвергшихся распаду, относительно всей консистенции веществ. Для определения такой степени установлена общепринятая формула, которая выглядит следующим образом: α = n/N.
Понятие слабых электролитов
Существует определенный перечень подобных веществ.
Они представлены в списке c названиями:
Если рассматривать реакцию диссоциации, она выражается соответствующими ионными наиболее распространенными уравнениями:
Вода входит в список слабых электролитов, ее способность касательно проведения электрического тока практически сведена к нулю. Объясняется такая особенность незначительным распадом на анионы (гидроксид-ион) и катионы (водород).
Если же обозначенная жидкость все же проводит электрический ток, это дает возможность определить, что она содержит отдельные примеси. Что касается дистиллированной воды, она является неэлектропроводной. Отмечается что диссоциация, характерная для слабых электролитов, является обратимой реакцией, далее ионы и способны снова преобразовываться в молекулы.
Итак, слабыми электролитами называются вещества, способные распадаться до состояния ионов (анионы с катионами), но не до конца. Соответственно, характерной особенностью выступает незначительное проведение электротока.
В категорию таковых входят соли малорастворимого типа, нерастворимые основания, слабые кислоты или в разбавленном состоянии, вода. Существует возможность обратной реакции при диссоциации.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Что такое слабый электролит
1.1. Электролитическая диссоциация. Степень диссоциации. Сила электролитов
Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией. Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы ( n ), к общему числу его молекул в растворе ( N ), или
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3 (30%)—средними, менее 0,03 (3%)—слабыми электролитами. Так, для 0,1 M раствора CH 3 COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью (α = 1).
К сильным электролитам относятся:
3) соли, растворимые в воде (см. таблицу растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся:
3) гидроксид аммония ( NH 4 OH );
4) большинство органических кислот
(например, уксусная CH3COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости).
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НС l ) записывается следующим образом:
Основания диссоциируют с образованием катионов металла и гидроксид-ионов. Например, диссоциация КОН
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например,
Первое равновесие – диссоциация по первой ступени – характеризуется константой

Для диссоциации по второй ступени:

Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
KHCO 3 → K + + HCO 3 – (первая ступень)
HCO 3 – 
Однако степень электролитической диссоциации по второй ступени очень мала, поэтому раствор кислой соли содержит лишь незначительное число ионов водорода.
FeOHCl 2 
FeOH 2+ 
( ZnOH )2 SO 4 
ZnOH +