что такое серозное содержание
Серозная жидкость
Смотреть что такое «Серозная жидкость» в других словарях:
СЕРОЗНАЯ ЖИДКОСТЬ — (сывороточная жидкость) прозрачная желтоватая жидкость, образуется из крови вследствие просачивания её из капилляров. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907 … Словарь иностранных слов русского языка
серозная жидкость — (liquor serosus) жидкость, вырабатываемая серозными оболочками … Большой медицинский словарь
Серозная оболочка — соединительно тканная мембрана, покрытая эпителиальным слоем; имеет толщину около 1 мм, выстилает полости тела человека и животных. В зависимости от местоположения называется брюшиной (См. Брюшина), плеврой (См. Плевра), Перикардом,… … Большая советская энциклопедия
СЕРОЗНАЯ ОБОЛОЧКА — (ново лат., от лат. serum сыворотка; в медиц. кровяная жидкость). Слизистая оболочка, выстилающая наружную поверхность всех внутренностей, сердца легких и проч. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910.… … Словарь иностранных слов русского языка
СЕРОЗНАЯ ОБОЛОЧКА — выстилает внутренние полости тела человека и животных. В зависимости от местонахождения называется брюшиной, плеврой, перикардом, эпикардом. Серозная оболочка вырабатывает серозную жидкость, облегчающую движение внутренних органов, выполняет… … Большой Энциклопедический словарь
серозная оболочка — выстилает внутренние полости тела человека и животных. В зависимости от местонахождения называют брюшиной, плеврой, перикардом, эпикардом. Серозная оболочка вырабатывает серозную жидкость, облегчающую движение внутренних органов, выполняет… … Энциклопедический словарь
Серозная оболочка — Структура стенки желудка: 1 серозная оболочка, 2 субсероза, 3 мышечный слой, 4 наклонные мышечные волокна, 5 круговые мышцы, 6 продольные мышцы, 7 подслизистая, 8 мышечный слой слизистой оболочки, 9 слизистая оболочка, 10 lamina propria, 11… … Википедия
Серозная оболочка — выстилает все участки первоначально общей у зародыша полости тела (целома) позвоночных животных. Участки эти называются серозными полостями, ибо содержат серозную жидкость, похожую на serum, кровяную сыворотку, а на самом деле близкую по составу… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
СЕРОЗНАЯ ОБОЛОЧКА — выстилает внутр. полости тела человека и животных. В зависимости от местонахождения наз. брюшиной, плеврой, перикардом, эпикардом. С. о. вырабатывает серозную жидкость, облегчающую движение внутр. органов, выполняет защитную функцию … Естествознание. Энциклопедический словарь
перикардиальная жидкость — (liquor pericardialis) серозная жидкость, находящаяся в перикардиальной полости … Большой медицинский словарь
Значение слова «серозный»
[От лат. serum — сыворотка]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
СЕРО’ЗНЫЙ, ая, ое [от латин. serum — сыворотка] (анат., физиол.). Сывороточный. Серозное отделение. Серозная жидкость. || Прил., по знач. связанное с частями тела, увлажняемыми выделяющейся из кровеносных сосудов сывороткой. Серозные полости (грудная, брюшная). Серозные оболочки (покрывающие внутреннюю поверхность серозных полостей). Серозные железы (назв. нек-рых желез в полости рта и др. частях организма).
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
серо́зный
2. сывороточный ◆ Серозное отделение. ◆ Серозная жидкость.
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: возобновляться — это что-то нейтральное, положительное или отрицательное?
Серозометра
Серозометра — накопление серозной жидкости в полости матки из-за наличия механических препятствий на пути ее оттока во влагалище или повышенной секреции. На начальных этапах клинически не проявляется и выявляется случайно во время гинекологического обследования. При накоплении больших объемов жидкости пациентку беспокоит тупая боль в надлобковой области, учащенное мочеиспускание, запоры и другие нарушения функции тазовых органов. Для диагностики используют бимануальное обследование, УЗИ, эндоскопические, томографические, цитологические и микробиологические методы. Лечение направлено на устранение заболевания, вызвавшего серозометру.
Общие сведения
Накопление серозной жидкости в матке является неспецифическим проявлением ряда заболеваний, сопровождающихся повышенной секрецией или нарушением оттока экссудата во влагалище. Серозометра чаще возникает во время постменопаузы на фоне инволютивных процессов в женских половых органах и в ходе гинекологического УЗИ диагностируется у 40% пациенток этой группы. При этом наиболее часто подобное нарушение выявляют у женщин с длительностью постменопаузы от 15 до 25 лет. Появление внутриматочной жидкости у пациенток репродуктивного возраста, как правило, имеет другие причины, чем серозометра в постменопаузе, и требует быстрой тщательной дифференциальной диагностики.
Причины серозометры
Скопление серозной жидкости в полости матки может быть обусловлено механическим нарушением проходимости путей оттока во влагалище или повышенной секрецией на фоне неадекватной резорбции и выведения. Основными причинами органической несостоятельности служат:
К возникновению серозометры также приводит избыточная секреция экссудата эндометрием или его поступление из фаллопиевых труб. Гиперпродукция серозной жидкости наблюдается при таких патологических состояниях, как:
Важную роль в формировании серозометры играют факторы, которые снижают местный или общий иммунитет, вызывают гормональные сбои и преждевременное старение репродуктивной системы. Ключевыми из них являются:
Дополнительными факторами риска возникновения серозометры служат малоподвижный образ жизни, нерациональное питание с употреблением жирных и других продуктов, усугубляющих обменные нарушения.
Патогенез
Симптомы серозометры
На начальных этапах присутствие серозной жидкости в полости матки не проявляется клинически и в подавляющем большинстве случаев становится случайной находкой при плановом гинекологическом УЗИ. Если серозометра сочетается с увеличением матки, пациентку беспокоят тупые или ноющие боли в надлобковой области, иногда возникает учащенное мочеиспускание, ощущение давления на мочевой пузырь или прямую кишку, появляются запоры или, наоборот, более частые позывы к дефекации. Боли могут усиливаться во время полового акта или при значительных физических нагрузках.
При сохранении проходимости цервикального канала женщина обычно отмечает увеличение количества влагалищных выделений. Зачастую они имеют водянистую консистенцию, выглядят прозрачными или светло-серыми. Когда к серозометре присоединяются гнойно-воспалительные процессы, характер выделений изменяется: они становятся более густыми, желто-зелеными с неприятным запахом. При этом усиливаются боли, может повышаться температура, беспокоить общее недомогание, слабость, разбитость, усталость, головокружение.
Осложнения
Наиболее грозным осложнением серозометры является присоединение воспалительного процесса с нагноением, выраженными местными и общими проявлениями интоксикации, инфекционным поражением других органов женской половой сферы. Давление увеличенной матки приводит к нарушению функций органов малого таза, а также нарушению оттока крови из нижних конечностей с формированием отеков. Кроме того, поскольку серозометра — не заболевание, а состояние, спровоцированное другой патологией, при несвоевременной диагностике основных причин накопления жидкости в матке могут быть пропущены опухоли и воспалительные заболевания.
Диагностика
Основная задача диагностики при обнаружении серозометры — выявление причин, вызвавших накопление жидкости. С этой целью пациентке рекомендовано комплексное гинекологическое обследование, в которое входят:
В репродуктивном возрасте особенно важна дифференциальная диагностика серозометры от других состояний, при которых в полости матки выявляется жидкость, — лохиометры, гематометры, пиометры. В сомнительных случаях к постановке диагноза привлекают онкогинекологов и хирургов.
Лечение серозометры
Схема лечения зависит от объема серозной жидкости, выявленной в полости матки, динамики ее накопления и причин, приведших к возникновению патологического состояния. При небольшом объеме жидкости (до 5 мл) и отсутствии признаков инфекционных процессов рекомендовано динамическое наблюдение с проведением УЗ-контроля и назначение препаратов, которые стимулируют маточное кровообращение, улучшают тонус сосудов и регенерацию эпителия. В таких случаях эффективно дополнительное назначение физиотерапевтических процедур.
Если объем серозной жидкости превышает 5 мл, ее количество увеличивается в динамике, отсутствуют механические препятствия на пути оттока во влагалище, выявлены воспалительные изменения, рекомендована комплексная терапия серозометры. Как правило, пациентке назначают:
При наличии органической патологии, препятствующей оттоку серозной жидкости, показаны специальные методы лечения основной патологии — бужирование цервикального канала, удаление полипа, миомэктомия, терапевтическое и хирургическое лечение объемных новообразований и т. п.
Прогноз и профилактика
Cерозометра: термин врача ультразвуковой диагностики или диагноз гинеколога?
Волгоградский государственный медицинский университет
В настоящее время одной из наиболее часто выполняемых внутриматочных операций является гистероскопия, с помощью, которой возможны не только визуализация различных видов внутриматочной патологии, но и осуществление хирургических вмешательств и контроля за эффективностью лечения [1]. Вместе с тем, это инвазивная манипуляция, имеющая определенный риск инфекционных осложнений, которые по данным разных авторов составляют от 0,7 до 12% (Баев О.Р., Стрижаков А.Н., Давыдов А.И. 2010) [2,3]. Вследствие возможности риска развития осложнений в послеоперационном периоде, необходимо иметь чёткие показания к выполнению данной операции [4]. Тем не менее, на современном этапе развития медицины неинвазивные методы диагностики внутриматочной патологии, такое как УЗИ органов малого таза, являются одним из начальных этапов постановки диагноза, а также определяющим фактором для определений показаний к выполнению гистероскопии [5,6]. Особенно важен метод УЗИ гениталий в период постменопаузы. Период постменопаузы является наиболее опасным в плане развития онкологических процессов гениталий, диагностика которых имеет большое практическое значение [7,8]. Негативные последствия имеют как несвоевременно проведенная диагностика, так и гипердиагностика, которая ведет к необоснованным внутриматочным вмешательствам.
Последние годы все чаще гинекологи встречаются с диагнозом «серозометра», на основании чего пациентка направляется в стационар для выполнения гистероскопии. Анализ литературы демонстрирует противоречивые мнения, как в отношении природы появления жидкости в полости матки, так и о прогностической значимости этого явления. Ряд авторов указывают на повышение риска злокачественных процессов в малом тазу при обнаружении жидкости в полости матки [9]. Некоторые исследователи, связывают скопление внутриматочной жидкости с доброкачественной внутриматочной патологией [10]. Другие исследователи расценивают появление жидкости в полости матки в период постменопаузы как вариант нормы, связывая ее с окклюзией цервикального канала [10].
Цель исследования: оценить прогностическую значимость определения при ультразвуковом исследовании жидкости в полости матки в постменопаузальном периоде.
Материалы и методы исследования. Для достижения поставленной цели были обследованы 27 пациенток, направленных для выполнения гистероскопии в плановом порядке с диагнозом «Серозометра» в гинекологические отделения ВОКБ №1 и КБСМП №7 г. Волгограда за период 2013-2015 гг. Оценивались факторы риска развития заболеваний гениталий с учетом длительности менопаузы, технические особенности гистероскопии в постменопаузальном возрасте, риск осложнений после манипуляции, фармакологическая нагрузка. Всем пациенткам после выполнения гистероскопий проводилось гистологическое исследование полученного материала.
Результаты исследования. Результаты исследования свидетельствуют, что возраст больных колебался от 53 до 73 лет и в среднем составил 62,8±1,8. Все пациентки человек были в периоде менопаузы. Причём длительность менопаузы составила от 2 до 19 лет в среднем 11,9±2,7. Таким образом, среди пациенток, которым выставлялся диагноз «серозометра» и выполнялась гистероскопия не было ни одной женщины репродуктивного или перименопаузального возраста. Минимальный срок менопаузы составил 2 года.
Подавляющее большинство обследованных (58,8%) были пенсионерами. В тоже время, обращает на себя внимание, что несмотря на средний возраст обследованных более шестидесяти лет более 40% из них продолжают работать.
Анализ менструальной функции обследованных пациенток в репродуктивном возрасте показал, что ее нарушения были выявлены у 52,9%. Возможно, одним из факторов нарушений менструального цикла была высокая частота прерываний беременности по желанию у пациенток исследуемой группы, 82,4% пациенток имели в анамнезе медицинские аборты. Причём у каждой третьей (30%) пациентки было более 2-х абортов. Среднее количество абортов на одну пациентку составило 2,1±0,3 (от 1 до 10). Количество родов в анамнезе у пациенток колебалось от 1 до 4 и в среднем составило 1,8±0,2.
Самопроизвольное прерывание беременности, в том числе замершие, имели в анамнезе 23,52% обследуемых женщин. Данные по соотношению родов, прервавшихся беременностей и медицинских абортов представлены на рис. 1.
Рис. 1. Соотношение доли родов, абортов и самопроизвольных выкидышей у пациенток исследуемой группы.
Всем пациенткам диагноз серозометра был поставлен на основании данных УЗИ малого таза, которое проводилось с профилактической целью. Данный диагноз был выявлен впервые, при этом какие-либо жалобы у пациенток отсутствовали. У большинства (81,8%) пациенток гистероскопия выполнялась впервые, повторное внутриматочное вмешательство в виде гистероскопии было у 18,2%.
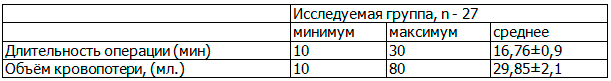
Данные по продолжительности операции и объеме кровопотери в исследуемой группе приведены в табл. 1.
Таблица 1. Продолжительность гистероскопии и объём кровопотери
Учитывая возраст и длительность менопаузы более 10 лет у большинства пациенток выполнение гистероскопии было сопряжено с определенными техническими трудностями в связи с инволютивными процессами в матке. Так, перфорация матки является крайне редким осложнением при выполнении гистероскопии в репродуктивном возрасте, однако у одной пациентки (3,70%) данной исследуемой группы операция была осложнена перфорацией матки.
По данным историй болезней у 88,2% пациенток послеоперационный период протекал без осложнений. Длительность пребывания в стационаре была от 2 до 7 дней, средний койко-день составил 4,18±0,1 койко-дня.
Результаты гистологических исследований представлены в табл. 2.
Таблица 2. Результаты гистологического исследования у пациенток с диагнозом «серозометра»
Данные гистологического исследования подтвердили диагноз полип, из двух пациенток с гиперплазией у 1 пациентки диагностирована атрофия эндометрия, а у второй пациентки с гиперплазией эндометрия выявлена аденокарцинома. Ни у одной из пациенток с изолированной серозометрой злокачественного процесса эндометрия не было выявлено.
Диагноза «Серозометры» по международной классификации болезней МКБ-10 не существует. Результаты проведенного исследования свидетельствуют,что большинство женщин с серозометрой не имеют никаких жалоб. Все они поступали в стационар для выполнения гистероскопии с раздельным диагностическим выскабливанием только на основании данных УЗИ малого таза (жидкость в полости матки). Данные гистологического исследования указывают на низкую диагностическую ценность ультразвуковых признаков серозометры для своевременного выявления патологии эндометрия в постменопаузальном периоде. Ни в одном случае изолированной серозометры заболеваний выявлено не было. В тоже время, выполнение внутриматочного вмешательства на фоне атрофичного эндометрия следует признать нецелесообразным, так как несет ряд негативных последствий для пациентки. Кроме того, это сопряжено с неоправданной госпитализацией и необоснованной фармакологической нагрузкой.
Что такое серозное содержание
Местные отеки могут возникать в результате экссудации или транссудации.
Жидкость невоспалительной природы именуется транссудат, а воспалительной природы – экссудат.
В патогенезе местных отеков (в зоне воспаления, тромбоза, эмболии, сдавления венозных или лимфатических сосудов) ведущая роль отводится изменению соотношения гидродинамического и коллоидно-осмотического давления в артериальном и венозном сегментах капилляров, повышению проницаемости сосудистой стенки и возрастанию гидрофильности тканей.
Этиология и патогенез экссудации
Экссудация – выход жидкой части крови вместе с форменными элементами в зону альтерации при развитии воспалительного процесса.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический. Экссудат – высокоактивная биологическая жидкость (особенно гнойный, гнилостный и геморрагический), содержащая большое количество лизосомальных ферментов, лизоцима, лактоферрина, фагоцитирующих лейкоцитов, продуктов их жировой дегенерации. Последнее определяет двоякую роль экссудации в организме: с одной стороны, деградирующий эффект на клеточные элементы и межклеточное вещество соединительной ткани, а с другой, – защитная функция в связи с наличием иммуноглобулинов и ряда факторов неспецифической резистентности. Касаясь механизмов развития экссудации следует остановиться на закономерностях развития воспаления.
Как известно, воспаление – типовой патологический процесс, возникающий под влиянием различных патогенных факторов инфекционной и неинфекционной природы и характеризующийся развитием типового комплекса сосудистых и тканевых изменений. Сосудистые изменения проявляются в зоне острого воспаления в виде последовательной смены спазма сосудов, артериальной и венозной гиперемией с развитием престаза и стаза.
Тканевые изменения включают стадии альтерации, экссудации и пролиферации. Следует отметить, что стадия экссудации формируется на фазе венозной гиперемии, когда в зоне воспаления накапливаются чрезмерно-высокие концентрации вазоактивных медиаторов альтерации. Как известно, медиаторы альтерации имеют гуморальное происхождение (активированные фракции компллемента, системы свертывания крови, фибринолиза, калликреин-кининовой системы), а также образуются в клетках различной морфофункциональной организации. Медиаторы клеточного происхождения играют важную роль в повышении проницаемости сосудистой стенки, активации ее тромбогенных эффектов. Среди вазоактивных медиаторов клеточного происхождения следует отметить такие, как нейропептиды, гистамин, серотонин, лейкотриены, простагландины, свободные радикалы, а также ряд провоспалительных цитокинов, лизосомальных ферментов. Важная роль в повышении проницаемости сосудистой стенки отводится развитию метаболического ацидоза. В связи с этим очевидно, что ведущим патогенетическим фактором экссудации является мембраногенный фактор, который характеризуется существенным повышением проницаемости стенок сосудов микроциркуляторного русла для воды, мелко- и крупномолекулярных веществ. Если в норме через стенку капилляров проходят молекулы диаметром менее 5 нм, то при воспалении начинают проходить более крупные частицы. Причины повышения проницаемости сосудистых стенок: ацидоз, активация гидролитических ферментов, перерастяжение стенок сосуда, изменение формы клеток эндотелия. Повышение проницаемости сосудов ( венул и капилляров ) зоне воспаления развивается в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента.
Касаясь молекулярно-клеточных механизмов развития экссудации под влиянием ряда медиаторов альтерации, в частности гистамина, следует отметить, что источником этого биологически активного соединения являются тучные клетки и базофилы крови.
Гистамин. Образуется из аминокислоты гистидина под влиянием фермента гистидиндекарбоксилазы, депонируется в гранулах лаброцитов и базофилов в комплексе с гепарином, ФАТ и другими соединениями. Освобождение гистамина из клеток может возникать в результате физиологического экзоцитоза или при повреждении и распаде клеток. В качестве либераторов гистамина могут выступать бактериальные, вирусные патогенные факторы, разнообразные антигены, С3 и С5 фракции комплемента, катионные белки полиморфноядерных лейкоцитов, химические, физические, термические воздействия, индуцирующие процесс альтерации.
Высвобождение гистамина из клеток – одна из первых реакций ткани на повреждение наряду с интенсификацией выделения сенсорных нейропептидов (субстанция Р, пептид гена, родственный кальцитонину). Эффект этого медиатора на сосудистую стенку в зоне острого воспаления реализуется главным образом через Н1-рецепторы в виде вазодилатации и повышения проницаемости. Кроме того, в очаге острого воспаления гистамин вызывает боль, повышает адгезивные свойства эндотелия сосудов, способствует эмиграции лейкоцитов. Вследствие быстрого разрушения гистамина под влиянием фермента гистаминазы биологические эффекты его на микроциркуляцию кратковременны и в последующем пролонгируются другими медиаторами воспаления.
Из гранул лаброцитов и базофилов освобождаются в зону альтерации хемотаксический фактор эозинофилов (ФХЭ), хемотаксический фактор нейтрофилов (ФХН), фактор активации тромбоцитов (ФАТ), нейтральные протеазы и др.
Другой вазоактивный медиатор воспаления – серотонин представляет собой производное аминокислоты триптофана, значительная часть серотонина депонируется в тромбоцитах. Однако серотонин обнаружен и в других клетках, в частности в нейронах мозга, лаброцитах, базофилах, энтерохромаффинных клетках пищеварительного тракта. Под влиянием различных активаторов – коллагена, тромбина, АДФ, ФАТ – происходит секреция серотонина из тромбоцитов и хромаффинных клеток, одновременно из тучных клеток освобождается гистамин. В умеренных концентрациях серотонин вызывает расширение артериол, сокращение миоцитов в стенках венул и венозный застой. В высоких концентрациях серотонин обусловливает спазм артериол, а в случае их повреждения способствует остановке кровотечения.
Важное значение в развитии воспаления имеют медиаторы воспаления, образуемые полиморфноядерными лейкоцитами. Так, катионные белки, фактор активации тромбоцитов вызывают дегрануляцию тучных клеток и тем самым повышают проницаемость микроциркуляторных сосудов. Способствуют повышению проницаемости также активные метаболиты кислорода (супероксид радикал, синглетный кислород, перекись водорода).
При воспалении в результате повреждения эндотелия сосудов происходит активация фактора Хагемана, который запускает кининогенез и идет превращение прекалликреина в калликреин. Активация калликреина приводит к образованию брадикинина и каллидина. Кинины расширяют кровеносные сосуды и повышают их прницаемость, причем в большей степени, чем гистамин.
Важная роль в повышении проницаемости сосудистой стенки отводится простагландинам и эйкозаноидам.
Механизмы реализации мембраногенного фактора:
1) облегчение фильтрации воды из крови в интерстициальное пространство. Этот механизм может быть сбалансирован повышением реабсорбции воды в посткапиллярах в связи с истончением их стенок;
2) увеличение выхода молекул белка из плазмы крови в межклеточную жидкость ведёт к включению онкотического фактора. Такой механизм лежит в основе развития отёка при воспалении, местных аллергических реакциях, укусах насекомых и змей.
Возрастание проницаемости при воспалении, как правило, является двухфазным и включает немедленную (раннюю) и замедленную (позднюю) фазы.
Первая фаза – ранняя, немедленная, развивается вслед за действием альтерирующего агента и завершается в среднем в течение 15-30 мин. Эта фаза обусловлена в первую очередь действием гистамина, а также лейкотриена Е4, серотонина, брадикинина на венулы диаметром не более чем 100 мкм. Проницаемость капилляров при этом практически не меняется. Повышение проницаемости на территории венул связано с сокращением эндотелиоцитов сосуда, округлением клеток, образованием межэндотелиальных щелей, через которые происходит выход жидкой части крови и клеток.
Вторая фаза – поздняя, замедленная, развивается постепенно, достигает максимума через 4-6 ч, когда происходит фиксация лейкоцитов к эндотелию сосудов и длится иногда до 100 часов в зависимости от вида и интенсивности воспаления. Для этой фазы характерно стойкое увеличение проницаемости сосудов (артериол, капилляров, венул), обусловленное главным образом продуктами, освобождаемыми лейкоцитами – лизосомальными ферментами, активными метаболитами кислорода, простагландинами, комплексом лейкотриенов, водородными ионами. Кроме того при воспалении возможно повышение проницаемости в результате структурных изменений сосудистой стенки, вызванное лизосомальными протеазами, активацией процессов перекисного окисления липидов.
В механизмах развития экссудации, помимо увеличения проницаемости сосудов, определенная роль принадлежит пиноцитозу – процессу активного захватывания и проведения через эндотелиальную стенку мельчайших капелек плазмы крови. В связи с этим экссудацию можно рассматривать как своеобразный микросекреторный процесс, обеспечиваемый активными транспортными механизмами. Активация пиноцитоза в эндотелии микрососудов в очаге воспаления предшествует увеличению проницаемости сосудистой стенки за счет сокращения эндотелиоцитов.
Нарушение проницаемости сосудистой стенки лежит в основе развития отеков в зоне воспаления в случаях развития декомпенсированного метаболического ацидоза, а также неврогенных отеков (при поражениях задних корешков и столбов спинного мозга).
Проницаемость сосудистой стенки может повышаться под влиянием токсических соединений бактериальной природы (токсины дифтерийный, сибиреязвенный и др.), при действии экзогенных химических веществ (хлор, фосген и др.), при действии некоторых ядов различных насекомых и пресмыкающихся (комары, пчелы, шершни, осы, змеи и др.). Под влиянием воздействия этих агентов, помимо повышения проницаемости сосудистой стенки, происходит нарушение тканевого обмена и образование продуктов, усиливающих набухание коллоидов и повышающих осмотическую концентрацию тканевой жидкости. Возникающие при этом отеки называются токсическими.
Таким образом, одним из ведущих патогенетических факторов развития местного отека является мембраногенный фактор, связанный с повышением проницаемости сосудистой стенки.
Как отмечено ранее, механизмами реализации мембранногенного фактора развития отека являются облегчение фильтрации жидкости в микрососудах, избыточный транспорт белков, ионов из микрососудов в интерстициальную жидкость. Осмотическому и онкотическому факторам принадлежит большое значение в развитии воспалительного отека.
Гиперосмия тканей в очаге воспаления обусловлена повышением в них концентрации осмоактивных частиц – ионов, солей, органических соединений с низкой молекулярной массой. К факторам, вызывающим гиперосмию, относятся усиленная диссоциация солей вследствие ацидоза тканей (лактатный ацидоз типа А), выход из клеток калия и сопутствующих ему макромолекулярных анионов, повышенный распад сложных органических соединений на менее сложные, мелкодисперсные, а также сдавление и тромбоз лимфатических сосудов, препятствующие выведению осмолей из очага воспаления.
Одновременно с увеличением осмотического давления наблюдается увеличение и онкотического давления в тканях очага воспаления, в то время как в крови онкотическое давление снижается. Последнее обусловлено выходом из сосудов в ткани, в первую очередь, мелкодисперсных белков – альбуминов, а по мере повышения проницаемости сосуда – глобулинов и фибриногена. Кроме этого, в самой ткани под влиянием лизосомальных протеаз происходит распад сложных белковых макромолекул на более мелкие, что также способствует повышению онкотического давления в тканях очага воспаления. Это вызывает снижение эффективной онкотической всасывающей силы плазмы крови.
Возрастание гидростатического давления в фазу венозной гиперемии имеет место в связи с развитием тромбоза, эмболии, престаза, приводящих к нарушению оттока венозной крови. В то же время экссудат при воспалении вызывает сдавление венозных и лимфатических сосудов и усугубляет нарушение оттока крови. При этом площадь и интенсивность пропотевания плазмы крови на территории сосудов микроциркуляторного русла увеличивается.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при воспалении, тромбозах, эмболии, беременности и др.) возникают условия для развития отеков.
В развитии местного отека также играет роль снижение внутрисосудистого коллоидно-осмотического давления за счет локальной гипопротеинемии связанной с повышением проницаемости сосудистой стенки в зоне альтерации.
Гиперонкия, гиперосмия тканей в зоне альтерации, повышение их гидрофильности в связи с плазмопотерей в зону альтерации в комплексе с белками, а также развитием цитолиза, выходом внутриклеточных электролитов и белков также способствует развитию отека. Происходит уменьшение резорбции жидкости из интерстиция в посткапиллярах и венулах.
Впервые экспериментальные доказательства значения онкотического фактора в развитии отеков были получены Э.Старлингом (1896).
В ряде случаев в развитии местных отеков лежит нарушение лимфодинамики. Лимфогенный (лимфатический) фактор развития местного отека характеризуется затруднением оттока лимфы от тканей вследствие либо механического препятствия, либо избыточного образования лимфы. Причинами включения лимфогенного фактора являются:
1) врождённая гипоплазия лимфатических сосудов и узлов;
2) сдавление лимфатических сосудов (например, опухолью, рубцом);
3) эмболия лимфатических сосудов (например, клетками опухоли, паразитами);
4) опухоль лимфоузла, а также метастазы в лимфоузел опухолей других органов;
5) значительное увеличение образования лимфы в тканях, приводящее к перегрузке лимфатических сосудов и замедлению оттока от тканей.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический.
Механизмы развития, характеристика транссудации
Транссудация – выход жидкости из сосудистого русла в неповрежденную ткань; имеет место в условиях нормы, обеспечивает обмен между кровью и тканями электролитами, трофическими субстанциями, газообразными соединениями, продуктами метаболизма.
В связи с тем, что транссудация жидкости в ткани в условиях нормы и при ряде форм патологии происходит через неповрежденную сосудистую стенку или на фоне незначительного возрастания ее проницаемости, транссудат по химическому составу и биологической активности значительно отличается от экссудата. Так, удельная плотность транссудата ниже, чем экссудата. Это обусловлено высоким содержанием белка и форменных элементов в экссудате. Транссудат содержит белка менее 30 г/л, и общее количество клеток в нем, как правило, не превышает 100, в то время как в экссудате содержание белка превышает 30 г/л, а клеточных элементов более 3000. Экссудат содержит значительное количество иммуноглобулинов, факторов свертывания крови, лейкоцитов, эритроцитов, медиаторов воспаления, в связи с чем является биологически активной жидкостью, обеспечивающей одномоментное развитие как защитно-приспособительных реакций в зоне воспаления, так и дезорганизации, деградации структур клеток и межклеточного вещества.
Резюмируя вышеизложенное, следует заключить доминирующую роль мембраногенного фактора в инициации местных отеков воспалительного генеза с последующим присоединением онкотического фактора и возрастанием гидродинамического давления в зоне тромбоза и эмболии сосудов при венозной гиперемии.
Активация процессов транссудации в нормальную по структуре и функции не поврежденную ткань связана с инициирующим воздействием возрастания гидростатического давления в сосудах микроциркуляторного русла и увеличением площади трассудации, нарушением обратного траспорта тканевой жидкости в систему микроциркуляции.
Чрезмерная транссудация лежит в основе ряда местных и системных нарушений распределения внутри- и внесосудистой внутриклеточной и внеклеточной жидкости.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при тромбозах, эмболии, беременности) возникают усиление транссудации, развитие застойных отеков.