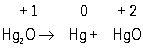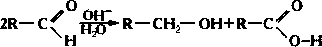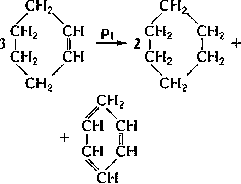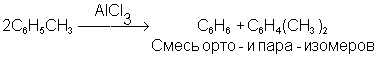что такое реакция диспропорционирования
Диспропорционирование
Из Википедии — свободной энциклопедии
Диспропорциони́рование (дисмутация) — химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
Примером может служить реакция взаимодействия оксида азота(IV) с водой:
<\mbox
или реакция разложения хлората калия :
<\mbox
Некоторые реакции диспропорционирования идут только при определенном рН среды. Например, иод, так же как и сера, диспропорционирует только в щелочной среде:
<5><\stackrel <-1><\mbox>><>^<<>—<>>+<><\stackrel <+5><\mbox>><\mbox
Реакция диспропорционирования обратна реакции конпропорционирования. Чтобы понять, при каких условиях возможна реакция диспропорционирования, можно использовать диаграмму Фроста, диаграмму Пурбе или таблицу окислительно-восстановительных потенциалов.
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.3.4. Реакции диспропорционирования
Cl2 + 2OH – D ClO – + Cl – + H2O
Рассматриваемая реакция есть сочетание двух полуреакций:
Cl2 + 2e – D 2Cl – E 0 2 = 1,36 B
2Cl2 + 4OH – D 2ClO – + 2 Cl – + 2H2O
Cl2 + 2OH – D ClO – + Cl – + H2O
Из сопоставления стандартных электродных потенциалов видно, что потенциал полуреакции, соответствующей переходу Cl2 ® ClO – меньше, чем потенциал полуреакции, где Cl2 переходит в восстановленное состояние (Cl2 ® 2Cl – ), то есть E 0 1 0 2. Такое соотношение потенциалов и является важнейшим признаком возможного диспропорционирования. Если частица содержит элемент в промежуточной степени окисления, причем потенциал полуреакции окисления этого элемента меньше, чем потенциал полуреакции его восстановления, то в водном растворе она склонна к самопроизвольному диспропорционированию.
Причина этого явления кроется в том, что Au + имеет промежуточную степень окисления между 0 (Au) и +3 (Au 3+ ), причем соответствующие полуреакции имеют следующие значения стандартных электродных потенциалов:
Au + + e – D Au; E 0 1 = 1,69 B
Au 3+ + 2e – D Au + ; E 0 2 = 1,40 B
Диспропорционирование является одной из причин невозможности существования некоторых ионов в водном растворе. Следует однако отметить, что указанные выше признаки диспропорционирования (промежуточная степень окисления элемента и более высокий восстановительный потенциал частицы, чем ее же окислительный потенциал) являются необходимыми, но не достаточными для того, чтобы реакция диспропорционирования в растворе действительно произошла. Имеется немало примеров, когда наличие обоих этих признаков не влечет за собой диспропорционирования. Такое явление, чаще всего, обусловлено кинетическими затруднениями.
Диспропорционирования реакция
Смотреть что такое «Диспропорционирования реакция» в других словарях:
Реакция Канниццаро — Реакция Канниццаро, названая в честь Станислао Канниццаро, это реакция диспропорционирования альдегидов не содержащих водорода в α позиции по отношению к карбонильной группе.[1][2] Канниццаро первым провёл это превращение в 1853 году, получив… … Википедия
Химическая реакция — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
Канниццаро реакция — Реакция Канниццаро, названая в честь Станислао Канниццаро, это реакция диспропорционирования альдегидов не содержащих водорода в α позиции по отношению к карбонильной группе.[1][2] Канниццаро первым провёл это превращение в 1853 году, получив… … Википедия
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Химический процесс — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Химические реакции — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
Валентность (химич.) — Валентность (от лат. valentia ≈ сила), способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. ≈ одно из фундаментальных понятий… … Большая советская энциклопедия
Валентность — I Валентность (от лат. valentia сила) способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. одно из фундаментальных… … Большая советская энциклопедия
Гипохлорит натрия — Общие … Википедия
Диспропорционирование — (дисмутация) химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления … Википедия
Диспропорционирование
Диспропорциони́рование (дисмутация) — химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
Примером может служить реакция взаимодействия оксида азота(IV) с водой:
или реакция разложения хлората калия (реакция Тищенко):
Реакция диспропорционирования обратна реакции конпропорционирования. Чтобы понять, при каких условиях возможна реакция диспропорционирования, можно использовать диаграмму Фроста, диаграмму Пурбе или таблицу окислительно-восстановительных потенциалов.
Смотреть что такое «Диспропорционирование» в других словарях:
ДИСПРОПОРЦИОНИРОВАНИЕ — в неорганической химии реакция самоокисления самовосстановления, напр. (над атомами приведены их степени окисления): 4KCl+5O3 3KCl+7O4 + KCl 1. Диспропорционирование в органической химии обычно перераспределение атомов или их группировок между… … Большой Энциклопедический словарь
ДИСПРОПОРЦИОНИРОВАНИЕ — ДИСПРОПОРЦИОНИРОВАНИЕ, одновременное окисление и восстановление химического вещества. В качестве примера можно привести диспропорционирование хлорида меди (I), при котором одновременно происходит окисление до хлорида меди (II) и восстановление до … Научно-технический энциклопедический словарь
диспропорционирование — disproporcionavimasis statusas T sritis chemija apibrėžtis Atomų arba grupių persiskirstymas tarp dviejų vienodų molekulių, radikalų, grupių. atitikmenys: angl. dismutation; disproportionation rus. дисмутация; диспропорционирование ryšiai:… … Chemijos terminų aiškinamasis žodynas
диспропорционирование — disproporcionavimasis statusas T sritis chemija apibrėžtis Elemento oksidacijos laipsnio padidėjimas ir sumažėjimas vienodų molekulių reakcijos metu. atitikmenys: angl. dismutation; disproportionation rus. дисмутация; диспропорционирование ryšiai … Chemijos terminų aiškinamasis žodynas
ДИСПРОПОРЦИОНИРОВАНИЕ — (от лат. dis приставка, означающая отрицание, и proportio соразмерность) (дисмутация). В органической химии. Перераспределение атомов или их группировок между двумя одинаковыми молекулами или своб. радикалами, напр.: Иногда Д. называют также… … Химическая энциклопедия
ДИСПРОПОРЦИОНИРОВАНИЕ — в неорганич. химии реакция самоокисления самовосстановления, напр. (над атомами приведены их степени окисления): +5 +7 1 4КС1О3 >ЗКСlO4 + КС1. Д. в органич. химии обычно перераспределение атомов или их группировок между двумя одинаковыми… … Естествознание. Энциклопедический словарь
диспропорционирование — диспропорцион ирование, я … Русский орфографический словарь
диспропорционирование — дис/пропорци/он/ир/ова/ни/е [й/э] … Морфемно-орфографический словарь
ДИСПРОПОРЦИОНИРОВАНИЕ ВОДОРОДА — окислительно восстановительный процесс внутреннего перераспределения водорода, при котором одни молекулы вещества гидрируются за счет дегидрирования др. без изменения массы и элементарного состава системы в целом. Пример процесса Д. в. в… … Геологическая энциклопедия
В химия, непропорциональностьиногда называют дисмутация, это окислительно-восстановительная реакция в котором одно промежуточное соединение степень окисления превращается в два соединения, одно из высших и одно из низших степеней окисления. [1] [2] В более общем смысле, этот термин может применяться к любой реакции десимметризации следующего типа: 2 A → A ‘+ A «, независимо от того, является ли это окислительно-восстановительным процессом или каким-либо другим типом процесса. [3]
Содержание
Примеры
Хлорид ртути (I) диспропорционирует при УФ-облучении:
Как упоминалось выше, реакции десимметризации иногда называют диспропорционированием, о чем свидетельствует термическое разложение бикарбоната:
Степени окисления в этой кислотно-щелочной реакции остаются постоянными. Этот процесс еще называют автоионизацией.
Другой вариант диспропорционирования: радикальное диспропорционирование, в котором два радикала образуют алкан и алкен.
Обратная реакция
Обратное диспропорционирование, например, когда соединение в промежуточной степени окисления образуется из предшественников более низкой и высокой степеней окисления, называется соразмерность, также известный как синпропорционирование.
История
Первой реакцией диспропорционирования, которую необходимо было подробно изучить, была:
Это было исследовано с использованием тартраты к Йохан Гадолин в 1788 году. В шведской версии своей статьи он назвал ее «söndring». [4] [5]
Дальнейшие примеры
Биохимия
В 1937 г. Ганс Адольф Кребскто открыл цикл лимонной кислоты носящий его имя, подтвердил анаэробную дисмутацию пировиноградная кислота в молочная кислота, уксусная кислота и CO2 определенными бактериями согласно глобальной реакции: [10]
2 пировиноградная кислота + H2O → молочная кислота + уксусная кислота + CO2
Дисмутация пировиноградной кислоты в других малых органических молекулах (этанол + CO2, или лактат и ацетат, в зависимости от условий окружающей среды) также является важным шагом в ферментация реакции. Реакции ферментации также можно рассматривать как диспропорционирование или дисмутацию. биохимические реакции. Действительно, донор и акцептор электронов в окислительно-восстановительные реакции поставка химическая энергия в этих сложных биохимических системах одни и те же органические молекулы одновременно действуют как восстановитель или окислитель.
Пока в дыхание электроны переносятся из субстрат (донор электронов) для акцептор электронов, при ферментации часть самой молекулы субстрата принимает электроны. Таким образом, ферментация является разновидностью диспропорционирования и не требует общего изменения степень окисления субстрата. Большинство ферментативных субстратов представляют собой органические молекулы. Однако редкий тип ферментации может также включать диспропорционирование неорганических сера соединения в некоторых сульфатредуцирующие бактерии. [12]