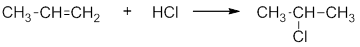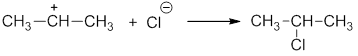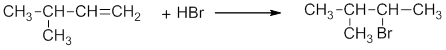что такое радикальный механизм в химии
Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Что такое радикальный механизм в химии
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).
Что такое радикальный механизм в химии
Химия
1.5.0. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Ионный механизм реакции. Правило Марковникова
Механизмом реакции называют детальное описание химической реакции, которое включает элементарные стадии.
При протекании химических реакций в молекулах органических соединений происходит разрыв ковалентных связей. Разрыв ковалентной связи может происходить по гетеролитическому (ионному) или гомолитическому (радикальному) механизмам. В зависимости от этого механизм реакции бывает ионный или радикальный.
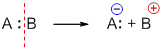
Ионный разрыв или гетеролиз приводит к образованию катиона и аниона. При этом общая электронная пара остается у одного из образующихся фрагментов:
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:
Примером ионной реакции может служить присоединение галогеноводородов к алкенам. Рассмотрим реакцию пропилена с хлороводородом:
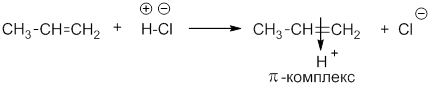
Механизм реакции электрофильного присоединения HCl к алкену
На первой стадии происходит распад молекулы хлороводорода на ионы и протон (катион водорода) атакует место повышенной электронной плотности – π-связь пропена. При этом образуется промежуточный π-комплекс:
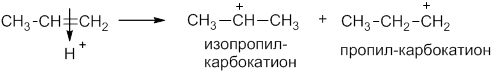
Катион водорода вытягивает электронную пару π-связи и образует ковалентную связь с одним из атомов углерода. Из пропилена может образоваться два катиона: изопропил-карбокатион и пропил-карбокатион:
Изопропил-катион более стабилен, чем пропил-катион, благодаря положительному индукционному эффекту двух метильных групп. Далее более устойчивый катион (более долгоживущий) присоединяет анион галогена:
Таким образом, основным продуктом реакции является 2-хлорпропан.
В 1986 году В.В.Марковников сформулировал правило: при ионном присоединении кислоты к двойной углерод-углеродной связи алкена, водород присоединяется к атому углерода, который имеет большее число атомов водорода (который более гидрогенизирован):
Более точно правило Марковникова можно сформулировать так: присоединение протона к алкену происходит с образованием наиболее стабильного карбокатиона.
Что такое радикальный механизм в химии
Абросимова Елена Владимировна учитель химии и биологии
НАВИГАЦИЯ
Химические реакции в органической химии
Реагент и субстрат
Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации:
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат.
Реагент — вещество, действующее на объект — субстрат — и вызывающее в нем изменение химической связи. Реагенты делятся на радикальные, электрофильные и нуклеофильные.
Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи.
КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО КОНЕЧНОМУ РЕЗУЛЬТАТУ (ИЗМЕНЕНИЮ В СТРУКТУРЕ СУБСТРАТА)
В органической химии различают четыре вида реакций по конечному результату и изменению в структуре субстрата: присоединения, замещения, отщепления, или элиминирования (от англ. to eliminate — удалять, отщеплять), и перегруппировки (изомеризации). Такая классификация аналогична классификации реакций в неорганической химии по числу исходных реагентов и образующихся веществ, с изменением или без изменения состава. Классификация по конечному результату основана на формальных признаках, так как стехиометрическое уравнение, как правило, не отражает механизм реакции. Сравним типы реакций в неорганической и органической химии.
Тип реакции в неорганической химии
Тип реакции в органической химии
Присоединение по кратным связям
Z n + 2 H C l = ZnCl2+H2
4. Обмен (частный случай — нейтрализация)
H 2 S O 4 + 2 N a O H =N a 2 S O 4 + 2 H 2 O
частный случай — этерификация
P красн. ⇔ P бел. Pкрасн.⇔P бел.
S ромб. ⇔ S пласт. Sромб.⇔Sпласт.
В зависимости от того, какие атомы отщепляются — соседние C– C или изолированные двумя-тремя или более атомами углерода – C–C–C– C–, – C–C–C–C– C–, могут образовываться соединения с кратными связями или циклические соединения. Отщепление галогеноводородов из алкилгалогенидов либо воды из спиртов происходит по правилу Зайцева.
Правило Зайцева: атом водорода Н отщепляется от наименее гидрогенизированного атома углерода.
Например, отщепление молекулы бромоводорода происходит от соседних атомов в присутствии щелочи, при этом образуется бромид натрия и вода.
Перегруппировка — химическая реакция, в результате которой происходит изменение взаимного расположения атомов в молекуле, перемещение кратных связей или изменение их кратности.
Перегруппировка может осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением.
Изомеризация — частный случай реакции перегруппировки, приводящая к превращению химического соединения в изомер путем структурного изменения углеродного скелета.
Перегруппировка тоже может осуществляться по гомолитическому или гетеролитическому механизму. Молекулярные перегруппировки могут классифицироваться по разным признакам, например по насыщенности систем, по природе мигрирующей группы, по стереоспецифичности и др. Многие реакции перегруппировки имеют специфические названия — перегруппировка Кляйзена, перегруппировка Бекмана и др.
Реакции изомеризации широко используются в промышленных процессах, например при переработке нефти для повышения октанового числа бензина. Примером изомеризации является превращение н-октана в изооктан:
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО ТИПУ РЕАГЕНТА
РАЗРЫВ СВЯЗИ
Разрыв связи в органических соединениях может гомолитическим и гетеролитическим.
Гомолитический разрыв связи — это такой разрыв, в результате которого каждый атом получает неспаренный электрон и образуются две частицы, имеющие сходное электронное строение — свободные радикалы.
Гомолитический разрыв характерен для неполярных или слабополярных связей, например C–C, Cl–Cl, C–H, и требует большого количества энергии.
Образующиеся в ходе такого разрыва связи радикалы обуславливают радикальный механизм протекания реакции. Радикальные реакции обычно протекают при повышенных температурах или при излучении (например, свет).
В силу своей высокой реакционной способности свободные радикалы могут оказывать негативное воздействие на организм человека, разрушая клеточные мембраны, воздействуя на ДНК и вызывая преждевременное старение. Эти процессы связаны, в первую очередь, с пероксидным окислением липидов, то есть разрушением структуры полиненасыщенных кислот, образующих жир внутри клеточной мембраны.
Гетеролитический разрыв связи — это такой разрыв, при котором электронная пара остается у более электроотрицательного атома и образуются две заряженные частицы — ионы: катион (положительный) и анион (отрицательный).
В химических реакциях эти частицы выполняют функции « нуклеофилов» («фил» — от гр. любить) и « электрофилов», образуя химическую связь с партнером по реакции по донорно-акцепторному механизму. Частицы-нуклеофилы предоставляют электронную пару для образования новой связи. Другими словами,
Нуклеофил — электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями.
Таким образом, при разрыве связи могут образоваться радикалы или нуклеофилы и электрофилы. Исходя из этого выделяют три механизма протекания органических реакций.
МЕХАНИЗМЫ ПРОТЕКАНИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Свободно-радикальный механизм: реакцию начинают свободные радикалы, образующиеся при гомолитическом разрыве связи в молекуле.
Наиболее типичный вариант — образование радикалов хлора или брома при УФ-облучении.
1. Свободно-радикальное замещение
2. Свободно-радикальное присоединение
Электрофильный механизм: реакцию начинают частицы-электрофилы, получающие положительный заряд в результате гетеролитического разрыва связи. Все электрофилы — кислоты Льюиса.
Местом атаки частицы-электрофила являются те участки молекулы, которые имеют повышенную электронную плотность, т. е. кратная связь и бензольное кольцо.
Общий вид реакций электрофильного замещения можно выразить уравнением:
1. Электрофильное замещение
2. Электрофильное присоединение
Присоединение к несимметричным непредельным углеводородам происходит в соответствии с правилом Марковникова.
Правило Марковникова: присоединение к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х — это атом галогена или гидроксильная группа ОН–) атом водорода присоединяется к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х — к наименее гидрогенизированному.
Нуклеофильный механизм: реакцию начинают частицы-нуклеофилы, имеющие отрицательный заряд, образовавшиеся в результате гетеролитического разрыва связи. Все нуклеофилы — основания Льюиса.
Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т. е. с частичным или полным положительным зарядом). Первой стадией реакции нуклеофильного замещения является ионизация субстрата с образованием карбкатиона. При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв с последующим отщеплением катиона. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ S N SN ) у насыщенного атома углерода, например щелочной гидролиз бромпроизводных.