Что такое хелаты в химии
Хелаты
Хелаты, хелатные соединения (от лат. chelate — клешня), также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами. Хелаты содержат центральный ион (частицу) — комплексообразователь и координированные вокруг него лиганды. Внутренняя сфера хелата состоит из циклических группировок, включающих комплексообразователь.
Иногда разделяют понятия хелатного и внутрикомплексного соединения. Второе определение применяют в случае, когда атом-комплексообразователь замещает протон лиганда в соединении.
Содержание
Пример
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Лиганд NH2CH2COO − (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Реакция Чугаева
Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения — бис(диметилглиоксимато)никеля(II).
Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион, образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс.
Строение получаемого хелата плоское; благодаря внутримолекулярным водородным связям (между лигандами) образуются еще две шестичленные циклические группировки, включающие атомы никеля и стабилизирующие частицу комплекса.
Реакция Чугаева очень чувствительна и селективна по отношению к катионам никеля(II) и позволяют уверенно определить его присутствие в любых химических объектах. Получаемый хелатный комплекс используется как пигмент.
Литература
См. также
Полезное
Смотреть что такое «Хелаты» в других словарях:
хелаты — сущ., кол во синонимов: 1 • микроудобрения (3) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
хелаты — Термин хелаты Термин на английском chelate Синонимы хелатные соединения, клешневидные соединения Аббревиатуры Связанные термины супрамолекулярная химия, хлорофилл Определение Кооординационные соединения, образуемые при взаимодействии ионов… … Энциклопедический словарь нанотехнологий
хелаты — хел аты, ов … Русский орфографический словарь
ХЕЛАТЫ — вещества, образующие с металлом комплексную соль, в которой металл закреплен по всем валентностям и пространственно находится внутри молекулы, так что его возможности вступления в реакцию снижаются. X. являются многие биополимеры, сложные… … Словарь ботанических терминов
Хелаты — (син.: комплексоны) соединения органических веществ с металлами, в которых атом металла связан с двумя или с большим числом атомов органического соединения (комплексообразователя) … Толковый словарь по почвоведению
ХЕЛАТНЫЕ СОЕДИНЕНИЯ — (хелаты, внутрикомплексные соединения, клешневидные соединения) (от греч. chele клешня), комплексные соединения, в к рых лиганд присоединён к центр. атому металла посредством двух или большего числа связей. Характерная особенность X. с. наличие… … Естествознание. Энциклопедический словарь
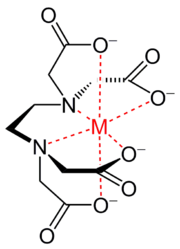
Внутрикомплексные соединения — Хелат иона металла и этилендиаминтетрауксусной кислоты Хелат, Хелаты, Хелатные соединения (от лат. chelate клешня) или внутрикомплексные соединения клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными … Википедия
Хелатные соединения — Хелат иона металла и этилендиаминтетрауксусной кислоты Хелат, Хелаты, Хелатные соединения (от лат. chelate клешня) или внутрикомплексные соединения клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными … Википедия
Микроудобрения — удобрения, содержащие Микроэлементы (В, Cu, Mn, Zn, Со и др.), т. е. вещества, потребляемые растениями в небольших количествах. Подразделяются на борные, медные, марганцевые, цинковые и др., а также полимикроудобрения, в составе которых 2 … Большая советская энциклопедия
Хелатообразующие вещества и хелаты
Хелатирующие вещества (хелатообразующие, Chelating Agents) — это особая группа веществ, которая реагирует с определенными ионами металлов, в результате чего образуются растворы сложных веществ — хелатов.
Хелаты (хелатные комплексы) по своим свойствам значительно отличаются от обоих первоначальных компонентов. В результате реакции с хелатирующими веществами ионы металлов экранируются и не вступают в химические реакции. Это свойство широко используется в химии для контроля содержания ионов металлов.
Что такое хелаты и хелатообразование
Хелатирование
Хелатообразование (хелатирование) — это достаточно популярный процесс в химии, медицине и даже в живой природе. Без образования хелатов не обходятся биохимические процессы: фотосинтез, доставка кислорода кровью, доставка ионов через мембрану клеток и даже процессы сокращения мышц.
В ежедневной жизни хелатирование используется в следующих целях:
Откуда берутся ионы металлов в косметике и как они влияют на работу продукта?
Следы ионов металлов можно обнаружить почти везде, при этом даже незначительное их количество может вызвать изменение цвета и свойств продукта. Даже при идеальных производственных условиях ионы металлов могут попасть в косметику с оборудования, контейнеров для хранения, систем водоснабжения или натуральных косметических компонентов. И если их количество не корректировать, могут происходить медленные реакции внутри упаковки с продуктом, что приведет к его порче. Так, например:
Косметические продукты с хелатирующими веществами
Также ионы металлов приводят к тому, что моющие и ополаскивающие средства, значительно хуже пенятся, особенно в жесткой воде.
При окрашивании волос ионы металлов могут мешать полезным реакциям перекиси водорода, уменьшать стойкость цвета окрашенных волос и даже способствовать разрушению пигментов. А при работе осветляющих веществ ионы металлов, могут давать нежелательные оттенки на блонде и мешать процессу осветления.
Особенности работы хелатов в косметике
Образование хелатов позволяет «обезвредить» ионы металлов без необходимости их полного удаления. Для применения хелатирующего шампуня не нужно очищать воду из крана от ионов металлов — все сделают сами хелатообразующие вещества при контакте с остатками воды из под крана у вас на волосах. В результате изолирования концентрация ионов металла значительно снизится, при этом хелаты, которые образуются, уже не мешают никаким дальнейшим реакциям. Благодаря этому большая часть косметики для волос хорошо работает в разных условиях жесткости воды. Хелатирующие компоненты входят практически во всю смываемую косметику для волос: краски, окислители, средства для осветления волос, химические завивки, шампуни, кондиционеры и маски. А вот в несмываемых продуктах (жидкие кристаллы или средства для укладки) в них нет необходимости, так как ионы металлов им не мешают.
Хелаты в косметике
Некоторые хелатирующие вещества усиливают действие консервантов. Они блокируют доступ питательных веществ к микробам, благодаря чему продукты дольше хранятся.
В зависимости от фирмы производителя в косметике могут быть использованы совершенно разные хелатообразующие вещества в разных концентрациях. В основном все косметические бренды плюс минус одинаково работают в условиях жесткой воды, однако, все же встречаются косметические бренды, которые могут быть чуть более эффективны или чуть менее эффективны в условиях соленой или жесткой воды. Особенно это заметно по стойкости цвета краски для волос в тех регионах, где вода содержит много ионов металлов.
Наиболее популярные в косметике вещества из этой группы: Etidronic Acid, Tetrasodium EDTA, Disodium EDTA, EDTA, Pentasodium Pentetate и целый ряд других веществ. Подобными свойствами помимо целого ряда других полезных свойств могут обладать некоторые вещества типа лимонной кислоты (Citric Acid), что широко используется при производстве окислителей и активаторов.
Хелатирующие шампуни
Хелатирующие шампуни предназначены для удаления избытков солей металлов с волос. Это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах. В результате их применения минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.
Это относительно новая группа шампуней. Их можно встретить только у отдельных брендов, например, Joico K-Pak Chelating Shampoo или L’ANZA Ultimate Treatment Chelating Shampoo.
Чем отличаются хелатирующие шампуни от шампуней глубокой очистки?
Очень часто шампуни глубокой очистки и хелатирующие шампуни путают и пытаются взаимозаменять, но нужно понимать, что все же это разные продукты и они не могут на 100% заменить друг друга.
Обычные шампуни глубокой очистки в основном работают с остатками косметики на волосах и жировыми накоплениями, однако если в волосах накопились соли после морской воды, то шампуни глубокой очистки малоэффективны. Приходится многократно мыть волосы или ждать пару недель, пока накопления вымоются естественным путем.
Хелатирующие шампуни — по факту это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах, и как следствие эти минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.
Хелатирующий шампунь Joico K-Pak Chelating Shampoo
Представьте, пришел клиент на окрашивание или завивку после отдыха на море, где, благодаря морской воде, его волосы набрали огромное количество минеральных солей. Эти соли будут мешать проведению всех процедур. Шампунь глубокой очистки только разрыхлит волосы и может за 1—2 применения не вымыть все минеральные накопления, а вот хелатирующий шампунь справится быстро и эффективно. И далее при нанесении краски или составов для химической завивки ничего не будет мешать работе продуктов.
Следует знать, что хелатирующим шампунем вымываются только минеральные соли, которые привнесены извне — сам шампунь особо не влияет на структуру и состав волоса, и в отличии от шампуней глубокой очистки он имеет более мягкую моющую композицию, гораздо меньше разрыхляет волосы и хуже вымывает накопления косметики на волосах.
Хелат
— человеческий гемоглобин, где минералом является железо; в растительном мире – это хлорофилл – биолегандная связь с магнием. И таких примеров в природе десятки тысяч.
Если в обменные процессы подавать просто неорганический минерал, он не будет взаимодействовать. Более того, он станет вредить обменному процессу. Что и происходит, например, при применении неорганического минерала кальция для человека или для растений. Обменные процессы живых существ и растительного мира адекватно не воспринимают чистый минерал. Этим объясняется бесполезность реализуемого кальция в аптеках и на прилавках цветочных магазинов.
Поэтому при применении необходимо переводить неорганические минералы в хелатную форму. Когда минерал прочно связан с аминокислотами он естественно и правильно проходит через все биохимические процессы, не нанося вреда, и полностью усваивается.
Как образуется Хелат?
Рассмотрим атом кальция:
Ионы – это заряженные частицы, которые образуются в результате отдачи или присоединения электрона.
Если мы этот минеральный, неорганический кальций подадим в организм растительного или живого существа, то он организмом восприниматься не будет.
Это доказали китайцы. Когда у них, в начале двадцатого века, был страшный голод, они стали есть землю, рассуждая, что если все выходит из земли, то значит, землю можно есть и организм сам приспособится, и будет синтезировать из земли питательные вещества. В результате люди гибли тысячами в страшных муках.
Так же происходит и в растительном царстве. Растения не питаются неорганическими элементами. Микроэлементы в почве упаковываются в органические контейнеры с помощью почвенных микроорганизмов, полезных форм происхождения. Только тогда они становятся едой для живого и растительного царства.
Однако, для того что бы упаковать микроэлемент в органический контейнер, ему нужно навязать – ещё один электрон, что бы сделать его отрицательно ионизированным. В природе это происходит от солнечного излучения, давления, электролиза и т.д. При этом, «свободные» ионы металлов и минералов очень легко вступают в соединение с другими веществами и становятся непригодными для нормального обмена веществ.
Лиганды
Для примера мы возьмем микроэлемент – железо и органическое вещество,
и посмотрим, как железо переходит в хелат (органический контейнер)
Его можно приготовить самому.
1) Купите пачку железного купороса. Далее….
Берем чайную ложку железного купороса и разводим в 0,5 л чистой (желательно кипяченой) воде.
Добавляем в раствор 15 грамм аскорбиновой кислоты (без примесей), хорошо перемешиваем и доливаем воды (чистой, кипячённой) до 3-х литров и хелат железа, готов.
Главное, его надо в течении 3-х часов использовать. Просто обрызгайте им листья (внекорневая подкормка) и на тех местах куда попали капли, лист снова позеленеет.
Недостаток этого способа все тот же – раствор нельзя хранить, лучше всего использовать в течение 1-2, максимум 3 часа.
Но такие хелатные комплексы подойдут только для внекорневой подкормки растений или так сказать их лечения.
А для производства полноценных удобрений, которые поражают своим «выхлопом», и не дают растению болеть, нами изобретён полный комплекс производства (белков, аминокислот, нуклеиновых кислот, углеводов и т.п.) в биореакторе.
Затем этим раствором просто обрызгать любой навоз и через полтора месяца из навоза получится комплексное полноценное хилатное удобрение. Кстати, за смешные деньги.
Потребность, например, растений в железе в несколько раз выше, чем в других микроэлементах, поэтому необходимо проводить дополнительную подкормку (подпитку) препаратами железа. От недостатка железа в растениях, начинается такое заболевание как хлороз.
Хелаты: как в них разобраться?
На рынке присутствуют разнообразные формы комплексных соединений металлов, используемых в кормлении животных. Все эти разнообразные формы называют «органическими микроэлементами», поскольку входящие в их состав микроэлементы образуют комплексы, или другие типы химических соединений, с органическими молекулами.
Химические процессы комплексообразования, или образования хелатов, понимаются по-разному различными специалистами отрасли кормопроизводства, что приводит к возникновению путаницы в терминах и интерпретации свойств продуктов. Часто встречаются такие термины, как «комплекс металла и аминокислот», «хелат металла и аминокислот», «комплекс металла с полисахаридом», «протеинат металла», однако официальные определения этих терминов расплывчаты и не проясняют ситуацию. В качестве примера в Таблице 1 приведены различные определения органических микроэлементов, используемых в сельском хозяйстве, в формулировках Ассоциации американских контролёров качества кормов (AAFCO, 1998).
Таблица 1. Органические комплексы минералов – определения терминов в формулировках AAFCO.
Комплекс металла и аминокислоты – продукт, образующийся при формировании комплекса между растворимой солью металла и аминокислотой.
Чтобы разобраться в запутанных определениях, характеризующих химические и физические свойства микроэлементов, прежде всего, необходимо выявить отличия между терминами «комплекс» и «хелат».
Комплексы или хелаты
Термин «комплекс» может использоваться при описании соединений, образующихся при взаимодействии иона металла с молекулой или ионом (лигандом), которые обладают свободной парой электронов. Такие ионы металлов связываются с лигандом посредством атомов-доноров, например, кислорода, азота или серы. Лиганды, обладающие только одним атомом-донором, называются монодентатными, а лиганды, обладающие двумя и более атомами-донорами, называеются би-, три- или тетрадентатными, также их иногда называют полидентатными.
Аминокислоты являются бидентатными лигандами, образующими связи с ионами металла посредством кислорода карбоксильной группы и азота аминогруппы.
Этилендиаминтетрауксусная кислота (ЭДТА) является примером гексадентатного лиганда, который содержит шесть атомов-доноров. ЭДТА образует очень прочные комплексы с большинством ионов металлов, и не очень подходит для образования хелатов минералов, поскольку биологическая доступность таких комплексов невысока.
Хотя могут образовываться хелаты, содержащие четыре, пять, шесть или семь колец, установлено, что наиболее стабильными являются хелаты, содержащие пять колец.
Также необходимо помнить о том, что хотя хелаты и являются комплексами, не все комплексы являются хелатами. Несмотря на простоту теории, объясняющей образование хелатов, необходимо строгое соблюдение множества условий для получения стабильного хелата минерала.
Лиганд должен содержать два атома, способных образовывать связи с ионом металла.
Лиганд должен образовывать гетероциклическое кольцо, причём металл должен располагаться «в конце» этого кольца.
Образование хелата металла должно быть пространственно (стерически) возможно. Для достижения стабильности необходимо соблюдать соотношение количества лиганда к минералу.
Истинные хелаты имеют «кольцевую структуру», образованную ковалентно-координационной связью между аминной и карбоксильной группами аминокислоты и ионом металла.
Как правило, хелаты образуются в результате реакции между неорганическими солями минералов, с приготовленной при помощи ферментов смесью аминокислот и небольших пептидов в контролируемых условиях. Такие аминокислотные и пептидные лиганды связываются с ионом металла не в одной точке, а в нескольких, в результате чего атом металла становится частью биологически стабильной кольцевой структуры. Аминокислоты и продукты ферментативного разрушения белков, например, небольшие пептиды, являются идеальными лигандами, поскольку они обладают как минимум двумя функциональными группами (аминной и гидроксильной), необходимыми для образования кольцевой структуры с минералом. Только «переходные элементы», например, медь, железо, марганец и цинк обладают необходимыми физико-химическими характеристиками, позволяющими им образовывать ковалентно-координационные связи с аминокислотами и пептидами с образованием биологически стабильных комплексов.
Аминокислоты и пептиды в качестве лигандов
Существуют различные мнения относительно преимуществ использования аминокислот в сравнении с пептидами при образовании хелатов минералов, ещё больше споров имеется по вопросу биологической доступности таких продуктов. Мы уже рассмотрели общие условия, необходимые для образования биологически стабильных хелатов минералов, однако следует также учитывать и другие факторы, оказывающие влияние на образование хелатов, основными из этих факторов являются:
Очевидно, что такой сложный химический феномен не следует чрезмерно упрощать. Однако чтобы прояснить ситуацию касательно преимуществ аминокислот либо пептидов в процессе образования хелатов минералов, мы рассмотрим факторы, влияющие на состояние равновесия и стабильность таких комплексов.
При растворении в воде соли металла, например, сульфата меди (II), с добавлением аминокислоты в качестве бидентатного лиганда, образуется ряд комплексов, каждый из которых обладает собственной константой стабильности, которая зависит от рН раствора. Это показано на Рисунке 1 (реакция сульфата меди (II) с глицином). Из данных, показанных на этом рисунке можно сделать некоторые важные выводы:
Рисунок 1. График изменения содержания меди, включённой в состав различных соединений, при изменении рН в растворе, содержащем медь (II) (0,001М) и глицин (0,002М). Горизонтальная ось: рН. Вертикальная ось: % Cu++
У различных ионов металлов различные константы стабильности. Поэтому, количество металла, входящего в состав конкретного соединения, зависит не только от величины рН раствора, но и от константы стабильности комплекса.
Стабильность содержащего металл комплекса зависит как от свойств металла, так и от свойств лиганда. Увеличение заряда иона, уменьшение размера и увеличение аффинности электронов способствует большей стабильности. На стабильность комплексов влияют также некоторые характеристики лигандов: (1) щёлочность лиганда, (2) количество металло-хелатных колец на единицу лиганда, (3) размер хелатного кольца, (4) пространственные эффекты, (5) резонансные эффекты и (6) атом лиганда. Поскольку комплексные соединения образуются в результате кислотно-основных реакций, как правило, более щелочные лиганды образуют более стабильные комплексы. Также большое значение имеет размер хелатного кольца.
Ещё глубже проанализировав Рисунок 1, можно заметить наличие существенных отличий между относительной стабильностью хелатов металлов, образованных аминокислотами и стабильностью протеинатов металлов. Поскольку протеинат металла является продуктом реакции хелатообразования между растворимой солью и аминокислотами и/или частично гидролизованным белком, можно предположить, что для конкретного иона металла количество графиков, характеризующих образование различных соединений, в состав которых входит металл, при образовании протеината, будет намного больше, чем при образовании хелата этого же металла с аминокислотой. Если считать график, отражающий распределение количества меди между различными соединениями, индикатором относительной стабильности при данной величине рН, и учитывать бесконечное количество комбинаций, возможных в результате взаимодействия как отдельных аминокислот, так и ди-, три- и даже тетрапептидов, то, теоретически, общая стабильность протеината в широком диапазоне рН должна быть намного больше, чем стабильность хелата данного металла с аминокислотой.
Очевидно, что в реальных условиях рассмотренные дополнительные факторы будут оказывать влияние на стабильность хелата. Однако можно ожидать, что протеинаты металлов будут обладать физико-химическими свойствами, необходимыми для сохранения постоянства характеристик при изменении рН.
Несмотря на наличие некоторой противоречивой информации, образование хелатов металлов – это не такой уж сложный процесс, в основе которого лежат фундаментальные законы химии. Мы можем выделить две формы истинных хелатов минералов, каждая из которых обладает определёнными химическими и биофизическими свойствами. Внимательно изучив факторы, влияющие на образование хелатов минералов, можно выявить различия между продуктами по показателю биологической стабильности и, следовательно, биологической доступности.
Хелатные соединения
Хелат, Хелаты, Хелатные соединения (от лат. chelate — клешня) или внутрикомплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами. Хелаты содержат центральный ион (частицу) — комплексообразователь и координированные вокруг него лиганды. Хелаты используют в химии для разделения, концентрирования и аналитического определения различных элементов.
См. также
Хелаты, или циклические комплексные соединения. Хелатами называют комплексные соединения, внутрення сфера которых состоит из циклических группировок, включающих комплексообразователь. Например, a-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O
Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион
образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс.
Строение получаемого хелата плоское; благодаря внутримолекулярным водородным связям (между лигандами) образуются еще две шестичленные циклические группировки, включающие атомы никеля и стабилизирующие частицу комплекса.
Реакция Чугаева очень чувствительна и селективна по отношению к катионам никеля(II) и позволяют уверенно определить его присутствие в любых химических объектах, а получаемый хелатный комплекс используется как пигмент.
Полезное
Смотреть что такое «Хелатные соединения» в других словарях:
ХЕЛАТНЫЕ СОЕДИНЕНИЯ — (хелаты внутрикомплексные соединения, клешневидные соединения) (от греч. chele клешня), комплексные соединения, в которых лиганд присоединен к центральному атому металла посредством двух или большего числа связей. Характерная особенность хелатных … Большой Энциклопедический словарь
хелатные соединения — (хелаты, внутрикомплексные соединения, клешневидные соединения) (от греч. chēlē клешня), комплексные соединения, в которых лиганд присоединён к центральному атому металла посредством двух или большего числа связей. Характерная особенность… … Энциклопедический словарь
ХЕЛАТНЫЕ СОЕДИНЕНИЯ — (хелаты, внутрикомплексные соединения, клешневидные соединения) (от греч. chele клешня), комплексные соединения, в к рых лиганд присоединён к центр. атому металла посредством двух или большего числа связей. Характерная особенность X. с. наличие… … Естествознание. Энциклопедический словарь
Хелатные соединения — (от греч. chele клешня) клешневидные соединения, один из классов химических комплексных соединений; то же, что Внутрикомплексные соединения … Большая советская энциклопедия
Соединения внутрикомплексные — комплексные циклические (хелатные, клешневидные) соединения, содержащие внутрисферные поликоординационные заместители, присоединенные к центральному атому металла как за счет главной валентности (замещение водорода), так и за счет побочной (через … Толковый словарь по почвоведению
Клешневидные соединения — хелатные соединения, один из классов химических комплексных соединений; то же, что Внутрикомплексные соединения … Большая советская энциклопедия
внутрикомплексные соединения — то же, что хелатные соединения. * * * ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ, то же, что хелатные соединения (см. ХЕЛАТНЫЕ СОЕДИНЕНИЯ) … Энциклопедический словарь
Внутрикомплексные соединения — Хелат иона металла и этилендиаминтетрауксусной кислоты Хелат, Хелаты, Хелатные соединения (от лат. chelate клешня) или внутрикомплексные соединения клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными … Википедия
Внутрикомплексные соединения — клешневидные соединения, хелатные соединения, один из классов комплексных соединений (См. Комплексные соединения). Классический пример В. с. гликоколят меди Адденд (радикал гликокола строения NH2CH2COO ) присоединяется к … Большая советская энциклопедия
ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ — то же, что хелатные соединения … Большой Энциклопедический словарь