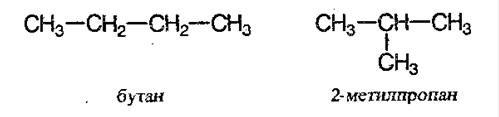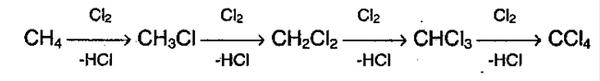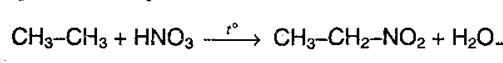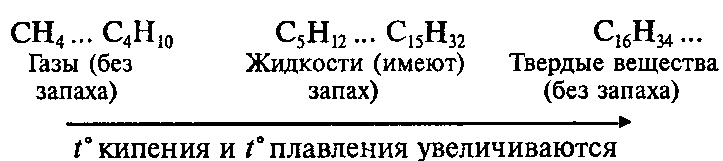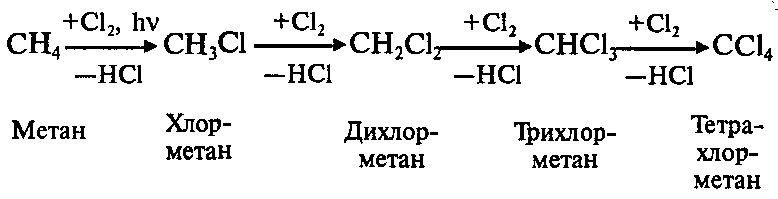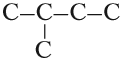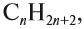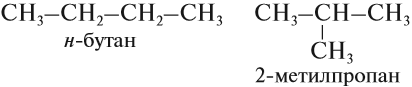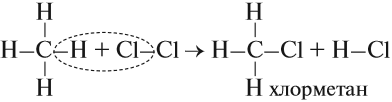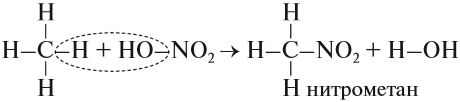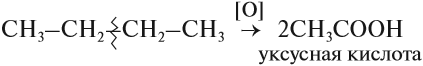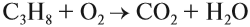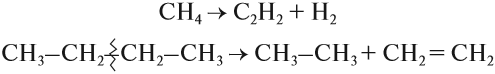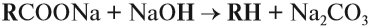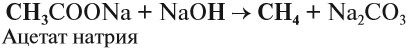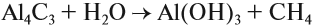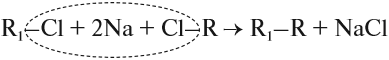что такое алканы в химии
Алканы – определение, строение, физические и химические свойства
Содержание:
Определение
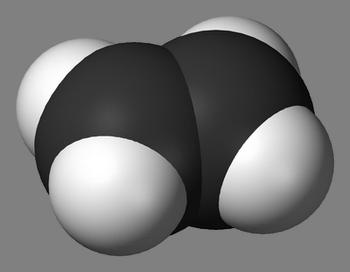
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула
Формулу алкана можно записать как:
При этом n больше или равно 1.
Изомерия
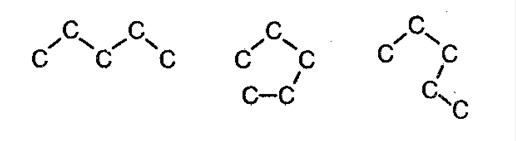
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.
Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.
Получение
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Практическое применение
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Видео
И в завершение видео урок о сущности алканов.
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы
Общая классификация углеводородов может быть представлена следующей схемой:
Алканы
(предельные или насыщенные УВ, парафины)
CnH2n+2, ≥ 1
Эта реакция используется для промышленного производства синтетического бензина.
Каждый атом углерода в молекуле алкана связан простыми связями с четырьмя атомами («С» или «Н») и не может присоединять другие атомы. Поэтому алканы и называют предельными, или насыщенными, углеводородами.
Изомерия и номенклатура алканов
Возможна только изомерия цепи. Первые три члена гомологического ряда алканов изомеров не имеют.
Четвертый член гомологического ряда существует в виде двух изомеров:
Для пятого члена гомологического ряда алканов возможно существование трех изомеров:
Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью.
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Физические свойства алканов
Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
Химические свойства алканов
Историческое название алканов – «парафины» — означает «не имеющие сродства». Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С – С и С- Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода.
Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитическое расщепление ковалентных связей, т.е. они осуществляются по свободно-радикальному механизму.
Реакции замещения (разрыв связей С – Н) RH + XY→RX + HY
1.Галогенирование (замещение атома водорода атомом галогена – F, Cl, Br с образованием галогеналкана RHal).
Алканы очень активно реагируют с фтором. Хлорирование протекает под действием света и является фотохимической цепной реакцией. Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н.Семенов, за что в 1956 г. был удостоен Нобелевской премии. Низшие алканы можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов:
а) Нитрование азотной кислотой в газовой фазе при температуре 400 о – 500 о С:
При этих условиях алканы с большим числом углеродных атомов образуют смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С – С:
б) Нитрование разбавленной HNO3 при t o = 140 о С и при повышенном или нормальном давлении (реакция М.И. Коновалова).
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
Номенклатура нитро- и галогеналканов
В основе названия нитро- или галогеналкана лежит название самой длинной неразветвленной цепи. Заместители перечисляют в алфавитном порядке. Атомы «С» нумеруют так, чтобы заместитель, который пишется первым, имел меньший номер.
Сульфирование алканов происходит при действии очень концентрированной H2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атома углерода:
Номенклатура сульфопроизводных алканов
К названию соответствующего алкана нужно прибавить приставку «сульфо-» или окончание «сульфокислота» с указанием положения сульфогруппы:
Реакции окисления
При обычных условиях алканы устойчивы к действию окислителей (KMnO4, K2Cr2O7).
а) полное окисление (избыток О2) с образованием углекислого газа и воды:
б) неполное окисление (недостаток О2):
В результате могут образоваться альдегиды, кетоны, спирты, карбоновые кислоты.
Термические превращения алканов
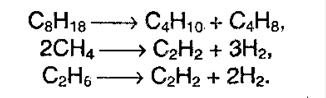
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 о С:
CH3 – CH2 – CH2 – CH3 → CH3 – CH3 + CH2=CH2
CH3 – CH2 – CH2 – CH3 → CH4 + CH2=CH – CH3
При дегидрировании метана образуется этин (ацетилен):
При нагревании метана до 1200 о С он разлагается на простые вещества:
При дегидрировании других алканов образуются алкены:
Получение алканов
Получение метана
а) из природного газа;
б) синтез из оксида углерода (II) и водорода:
а) гидролиз карбида алюминия
б) сплавление солей уксусной кислоты со щелочами
Получение гомологов метана
а) из природного сырья (нефть, газ, горный воск);
б) синтез из оксида углерода (II) и водорода
а) каталитическое гидрирование (+Н2) непредельных УВ
б) взаимодействие галогеналканов с натрием (реакция А.Вюрца).
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
2R – Br + 2Na → R – R + 2NaBr
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
3R – Br + 3R` — Br + 6Na → R – R + R – R` + R` — R` + 6NaBr
Применение метана
Скачать:
Скачать бесплатно реферат на тему: «Газы нефтяные попутные» Газы-нефтяные-попутные.docx (206 Загрузок)
Скачать бесплатно реферат на тему: «Природные источники углеводородов» Природные-источники-углеводородов.docx (224 Загрузки)
Скачать бесплатно реферат на тему: «Природный газ» Природный-газ.docx (199 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Урок 18. Алканы
Понятие об алканах
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:
Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.
Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:
Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.
Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Свойства алканов
Физические свойства
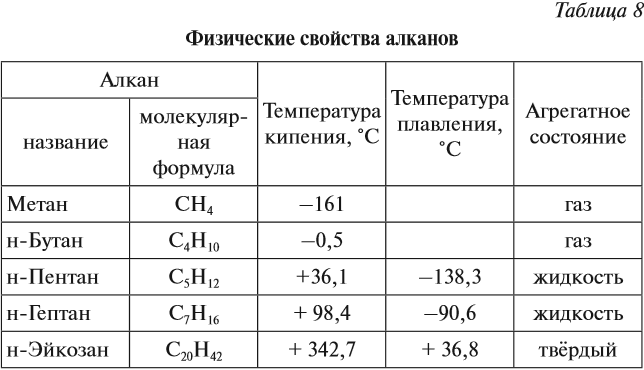
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).
Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью. Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты. Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
Получение и применение алканов
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
где R и R1 — предельные радикалы.
Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода. Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции. Это реакции замещения, крекинга, горения и каталитического окисления.