в каком возрасте диагностируют сма
Спинальная мышечная атрофия: что это такое и как ее вылечить
О спинальной мышечной атрофии у детей говорят все чаще, обычно — в контексте появления долгожданных лекарств против нее. Можно ли спасти всех больных и что для этого требуется?
Что такое СМА?
Спинальная мышечная атрофия (СМА) — это целая группа наследственных, генетических заболеваний, при которых страдают двигательные нейроны передних рогов спинного мозга. Из-за мутации в гене SMN1 у больных СМА снижена выработка SMN-белка, без которого нейроны разрушаются и перестают передавать сигналы от мозга к мускулатуре. В результате у человека постепенно атрофируются мышцы конечностей, головы и шеи.
Какой тип СМА самый опасный?
Существует 5 основных типов спинальных мышечных атрофий. Каждый из них имеет свои особенности, в том числе – симптомы и время манифестации.
Во многом тяжесть и скорость развития болезни определяется количеством у ребенка копий гена SMN2, он почти идентичен гену SMN1 и может в некоторой степени компенсировать его поломку.
Высокая смертность в случае отсутствия раннего лечения характерна только для СМА нулевого и первого типов. Большая часть пациентов с другими типами атрофий доживает до взрослого возраста. Четвертый тип, затрагивающий взрослых, на продолжительность жизни значительного влияния не оказывает.
Почему именно я? Как часто врачи ставят страшный диагноз
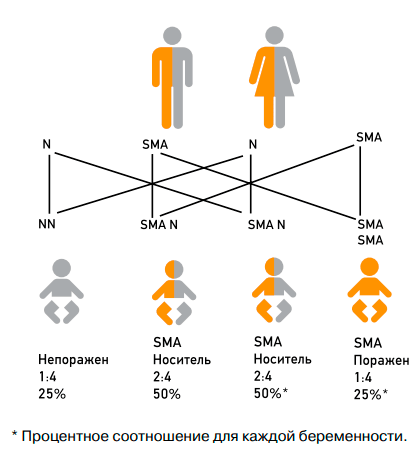
Обычно тип наследования СМА у детей — аутосомно-рецессивный. Некоторые, более редкие виды СМА, имеют другой тип наследования, а могут вообще не передаваться следующим поколениям. Это значит, что ребенок может заболеть только в том случае, если у обоих родителей есть поломанный ген, ответственный за синтез соответствующего белка. И даже тогда вероятность болезни составляет лишь 25%. Еще в четверти случаев ребенок вообще не унаследует мутаций, и в половине — сам станет бессимптомным носителем.
Согласно последним данным, в среднем дефектные гены, вызывающие мышечную атрофию, можно найти у каждого пятидесятого новорожденного, что не так мало, как хотелось бы. Сегодня среди 10 тысяч младенцев СМА диагностируют хотя бы у одного. Не зря эта болезнь является одной из ведущих причин детской смертности, связанных с генетическими нарушениями.
Когда стоит заподозрить неладное? Симптомы болезни
СМА первого типа может стать заметна почти сразу после рождения. Младенцы с этой тяжелой патологией:
Дети с СМА первого типа сначала могут выглядеть совершенно здоровыми. Однако со временем родители замечают, что ребенок мало двигается, быстро набирает вес, ему все труднее держать игрушки. Так как начинать лечить мышечную атрофию нужно как можно раньше, появление любых описанных симптомов — повод немедленно обратиться к врачу-неврологу.
Дети с СМА второго типа начинают отставать в развитии после 6–7 месяцев. Симптомы могут развиться еще позже, но обычно — до достижения ребенком 18 месяцев жизни. Дети с этой формой спинальной атрофии:
СМА третьего типа возникает к 1,5–2 годам, иногда — в позднем детстве или в подростковом возрасте. Ее основные признаки:
Взрослые, столкнувшиеся с СМА четвертого типа, как правило, жалуются на:
Эта форма СМА также способна прогрессировать, но почти никогда не затрагивает мускулатуру, отвечающую за дыхание, а потому не составляет угрозы жизни.
Может ли болезнь пройти сама по себе?
СМА — это расстройство, вызванное специфической мутацией в геноме. Оно всегда имеет прогрессирующий характер и не может пройти со временем, так как наша ДНК не способна починить сама себя, избавившись от нежелательных элементов кода.
Лечение СМА. Спинраза — это единственная надежда?
До недавнего времени вылечить СМА было невозможно, и все действия сводились к поддержанию жизни и улучшению ее качества. Для этого, например, используются специальные упражнения и приборы, призванные помочь двигаться и дышать, в том числе — зонды для кормления.
Настоящим прорывом стала разработка первого эффективного лекарства против спинальной мышечной атрофии. Препарат Спинраза (нусинерсен) был одобрен в США в 2016 году, а в России — в 2019-м. Он направлен на лечение всех типов СМА и подходит для пациентов всех возрастов. В основе — небольшие последовательности нуклеотидов, позволяющих синтезировать белок SMN на базе другого, схожего гена в нашей ДНК — SMN2. Препарат вводят в спинномозговую жидкость. Одной инъекции недостаточно. Чтобы защитить нейроны, лекарство нужно использовать регулярно: несколько раз в первый год жизни, и каждые 4 месяца — после.
В прошлом году в России стал доступен Рисдиплам. Он, как и Спинраза, воздействует на прочтение гена SMN2, но его можно пить в виде таблеток, что гораздо удобнее.
Третий препарат против СМА — Золгенсма (онасемноген абепарвовек), в нашей стране пока не зарегистрирован. Его применяют у детей до 2 лет. Внутри лекарства — аденовирусный вектор (оболочка вируса), который доставляет в нейроны работающий ген SMN1, после чего клетки начинают синтезировать нужный им белок (ДНК ребенка при этом никак не изменяется). Так как это средство генной терапии, для полного выздоровления хватает всего лишь одной дозы лекарства, в чем его значительное преимущество.
Сколько стоит лечение и когда его не поздно начать?
Ситуация для больных детей усугубляется в связи с тем, что лечить СМА нужно на ранних стадиях, так как из-за болезни нейроны отмирают постоянно, день за днем. Если ребенок болен СМА первого типа, у него есть в запасе около двух лет, у маленьких пациентов с другими формами болезни времени для лечения чуть больше, но прогноз тем лучше, чем раньше начата терапия. И все же на сегодняшний день прогресс в лечении СМА очевиден. Этот диагноз – больше не приговор, а в будущем спасительные лекарства, несомненно, будут становиться все эффективнее и дешевле.
Спинальная мышечная атрофия (СМА): ответы на самые часто задаваемые вопросы
Эту болезнь называют самой частой из редких. Она встречается у одного новорождённого из 6 000-10 000. Спинальная мышечная атрофия (СМА) – это наследственное заболевание, связанное с мутациями в гене. У больного постепенно атрофируются мышцы, и он сначала теряет способность ходить, а затем – глотать и дышать. В 2019 году в США изобрели новый препарат от СМА – «Золгенсма». Оно, как утверждают разработчики, не только приостанавливает развитие болезни, но и улучшает общее состояние, практически возвращая больного к обычной полноценной жизни. «Лабиринт 42» подготовил ответы на самые распространённые вопросы об этой коварной болезни.
В чём причина возникновения СМА?
Причина в повреждённом гене SMN1. В результате мутации у человека не вырабатывается белок, который нужен для выживания мотонейронов. Это важная часть спинного мозга человека, от них по длинным нервам идут сигналы к скелетным мышцам организма. В 95 % случаев причиной СМА становится делеция, то есть выпадение участка генетического кода.
Если мотонейрон недополучает достаточного количества белка для своего питания, то он быстро «устаёт». Мотонейроны начинают погибать, они не могут посылать сигналы к скелетным мышцам, благодаря которым человек ходит, сидит, лежит и дышит. Мышцы остаются без работы и постепенно отмирают.
То есть к атрофии мышц приводит дефицит важного белка, который не вырабатывает ген SMN1. Но у человека есть ещё ген SMN2, который дублирует SMN1. Он производит нефункциональный белок и небольшое количество нормального белка, который позволяет мотонейронам человека выживать на очень голодном пайке. В результате человек со СМА может сохранять какую-то часть двигательных, глотательных и дыхательных функций.
Можно ли заранее узнать, будет ли у ребёнка СМА?
Да, ещё в период планирования беременности можно сдать тест на носительство СМА. Дело в том, что если оба партнёра являются носителями этого заболевания, то вероятность рождения у них ребёнка со СМА составляет 25%. В 50% случаев у такой пары родится носитель СМА и в 25% малыш будет совершенно здоровым.
25% – довольно высокий риск, поэтому в этом случае рекомендуют использовать ЭКО – с помощью предимплантационной диагностики на 5-е сутки после оплодотворения яйцеклетки берут материал на анализ ДНК. Для процедуры ЭКО отбирают только эмбрионы без мутаций. Также можно сделать исследование плода на СМА на 11 неделе беременности. Кроме того, недавно Москве запустили пилотную программу тестирования новорождённых на спинальную мышечную атрофию (СМА). Это заболевание пока не включено в обязательный скрининг. В дальнейшем такие исследования могут распространиться на все российские регионы.
От чего зависит степень тяжести болезни?
У человека может быть разное число копий гена SMN2. Чем больше у пациента со СМА таких копий, которые вырабатывают маленькое количество нужного мотонейронам белка, тем легче будет протекать заболевание, тем благоприятнее прогноз.
Существует 4 типа спинальной мышечной атрофии. I тип – самый тяжёлый, проявляется на первых месяцах жизни. IV тип – самый лёгкий, может диагностироваться у взрослых людей.
Как проявляется СМА, каковы его первые симптомы?
Симптоматика зависит от типа заболевания. При первом типе СМА у малышей наблюдают глубокую слабость и гипотонию, трудности контроля головы, слабый крик и кашель, трудности с глотанием и выведением мокроты, осложнённое течение ОРВИ, развитие дыхательной недостаточности, высокие риски аспирационной пневмонии, очень высокую скорость прогрессирования заболевания.
При II типе у ребёнка будет задержка моторного развития и набора веса, слабый кашель, тремор рук, контрактуры, сколиоз и деформация грудной клетки.
Отличительный признак СМА – заболевание может проявить себя не сразу, и до определённого возраста ребёнок будет развиваться абсолютно нормально. Затем происходит постепенная потеря всех приобретённых навыков. Поэтому СМА называют очень коварной болезнью.
Как диагностируют СМА?
СМА обычно диагностируют по клиническим симптомам и подтверждают с помощью генетического анализа.
Как лечат СМА?
Есть 3 препарата, которые применяются для лечения СМА.
В августе 2019 фармацевтическая компания Biogen зарегистрировала в России препарат «Спинраза», который вводят в спинной мозг один раз в несколько месяцев. Лечение пожизненное.
В ноябре 2020 года регистрационное удостоверение получил «Эврисди» (рисдиплам) от компании Roche. По принципу действия он похож на Спинразу, но выпускается в виде раствора для приёма в рот, поэтому его удобно применять в домашних условиях.
Самый известный и самый дорогой в мире препарат от СМА – «Золгенсма», изобретённый в 2019 году в США. Его принципиальное отличие в том, что он не просто приостанавливает прогрессирование болезни, а заменяет отсутствующий или дефектный ген, который отвечает за выработку белка SMN, на его функциональную копию. «Золгенсма» не просто приостанавливает развитие болезни, но и улучшает общее состояние, практически возвращая больного к обычной полноценной жизни.
Если поставить инъекцию вовремя, желательно до проявления клинических симптомов, ребёнок не будет отличаться от сверстников. В отличие от той же «Спинразы», которую нужно ставить несколько раз в год пожизненно, «Золгенсма» – это одноразовое лечение. Пока этот препарат не зарегистрирован в России. Его стоимость – около 155 миллионов рублей.
Почему инъекция «Золгенсма» такая дорогая?
Цена «Золгенсмы» прямо пропорциональна стоимости и сложности его разработки. Так, согласно исследованию 2016 года, опубликованному в Journal of Health Economics, для создания одного нового лекарства требуется в среднем 2,6 миллиарда долларов и больше 10 лет упорной работы. Эксперты отмечают: как и большинство революционных лекарств, цена «Золгенсмы» отражает высокую стоимость её разработки и ценность, которую она приносит, а не просто стремление к прибыли.
Кроме того, как мы уже говорили, препарат ставится всего 1 раз в жизни. А значит, в долгосрочной перспективе «Золгенсма» для пациента выгоднее пожизненной «Спинразы». Также причина дороговизны в том, что препарат ориентирован на очень малую группу больных – всего несколько тысяч на весь мир. Поэтому все затраты на разработку и тестирование лекарства ложатся, по сути, на их плечи.
Сколько людей в России имеют диагноз СМА?
По данным фонда «Семьи СМА», в России насчитывается около 3 000–5 000 людей с этим диагнозом. Ежегодно в нашей стране рождается примерно 200 детей со СМА.
Почему у людей бывает СМА?
Спинальная мышечная атрофия – это заболевание, при котором повреждается ген SMN1. В результате мутации у человека не вырабатывается белок, который нужен для выживания мотонейронов. Мотонейроны — важная часть спинного мозга человека, от них по длинным нервам идут сигналы к скелетным мышцам организма. Если мотонейрон получает недостаточно белка для своего питания, то он быстро устает. Ему приходится работать и за себя, и «за того парня». Многие мотонейроны просто гибнут от «усталости», — нагрузка на оставшиеся возрастает, и в результате они работают с чудовищной перегрузкой. От усталости они не могут посылать сигналы к скелетным мышцам, благодаря которым человек ходит, сидит, лежит, глотает или дышит. Мышцы остаются без работы, потому что их никто ничего не просит сделать, и постепенно отмирают.
Дефицит важного белка, который не вырабатывает ген SMN1, приводит к атрофии (потере жизнеспособности и уменьшению размера) мышц, и в результате человек постепенно теряет способность ходить, удерживать и управлять собственным телом, самостоятельно сидеть, есть, глотать и дышать. Упрощенный механизм СМА можно увидеть на схеме.
К счастью, у человека есть еще ген SMN2, который дублирует SMN1. Он производит нефункциональный белок и небольшое количество нормального белка, который позволяет мотонейронам человека выживать на очень голодном пайке. В результате человек со СМА сохраняет какую то часть своих двигательных, глотательных и дыхательных функций.
Надежда для СМАйликов
Кто такие СМАйлики?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: СМАйликами ласково называют людей, страдающих спинальной мышечной атрофией (СМА), — заболеванием тяжелым и отнюдь не ласковым. Об особенностях данной патологии и способах ее терапии пойдет речь в данной статье.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
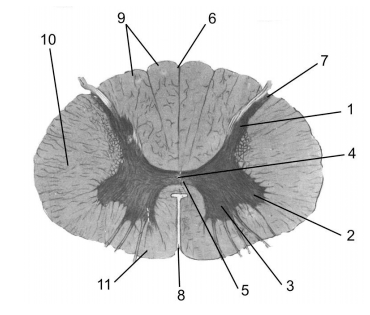
Рисунок 1. Внутреннее строение спинного мозга. 1 — задние рога спинного мозга; 2 — боковые рога; 3 — передние рога; 4 — центральный канал; 5 — центральное промежуточное вещество; 6 — задняя центральная борозда; 7 — задняя боковая борозда; 8 — передняя центральная щель; 9 — задние канатики; 10 — боковой канатик; 11 — передний канатик.
Сегодня науке известно огромное количество генетических заболеваний, терапия которых представляет серьезную проблему. Одним из них является СМА. Спинальная мышечная атрофия относится к орфанным, то есть редким, генетическим заболеваниям. Для нее характерна постепенная дегенерация α-моторных нейронов передних рогов спинного мозга. Анатомическое расположение передних рогов спинного мозга представлено на рисунке 1 [1].
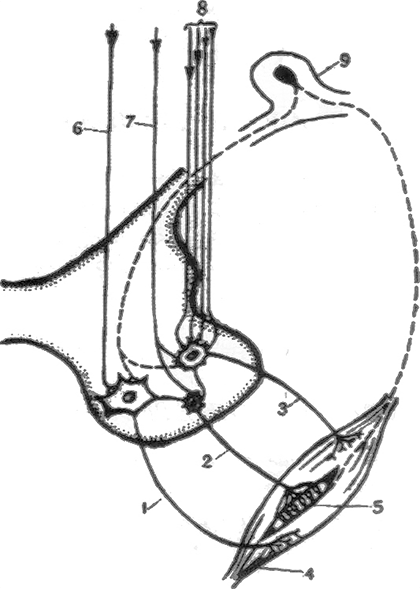
Альфа-мотонейроны иннервируют экстрафузальные мышечные волокна, которые ответственны за сокращение скелетной мускулатуры. Схематически взаимосвязь нейронов и мышечных волокон представлена на рисунке 2.
Рисунок 2. Взаимодействие мотонейронов и мышц. 1 — большой альфа-нейрон; 2 — гамма-нейрон; 3 — малый альфа-нейрон; 4 — мышца; 5 — проприоцептор; 6 — корковоспинномозговой путь; 7 — ретикулярноспинномозговой путь; 8 — нисходящие пути экстрапирамидной системы; 9 — спинномозговой узел.
Как видно из рисунка, для поддержания тонуса мышц и их сокращения необходима слаженная работа многих компонентов нейронной сети и мышечных волокон [2]. При СМА один из этих компонентов перестает выполнять свою функцию, что приводит в конечном итоге к мышечной атрофии.
Как правило, СМА связана с потерями участка хромосомы или точечными мутациями гена SMN1 (survival motor neuron, или ген выживаемости мотонейронов) [3]. Хотя существуют и еще более редкие формы спинальной мышечной атрофии, не связанные с мутациями SMN1, в данной статье речь пойдет только о «классической» СМА, или 5qСМА, — данное название связано с тем, что мутация затрагивает именно хромосому 5.
Рисунок 3. Наследование СМА
Частота встречаемости данной патологии — один случай на 6–10 тыс. человек. При этом каждый 40–50-й житель Земли является носителем «сломанного» гена SMN1. Если два человека, каждый из которых является носителем мутировавшего гена, становятся родителями, то вероятность того, что их ребенок будет болен СМА — 25% (рис. 3) [4].
За что же ответственен SMN-ген, если его мутации приводят к таким последствиям?
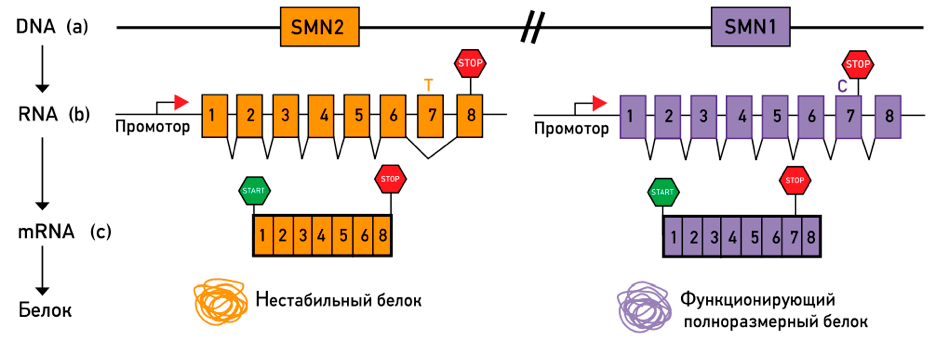
У человека существует два гена SMN: SMN1 и SMN2, которые находятся в 5 хромосоме. Мутация, как правило, затрагивает ген SMN1. В результате нарушается синтез белка SMN. Как следствие, все функции по синтезу SMN берет на себя ген SMN2. Однако между генами SMN1 и SMN2 есть, казалось бы, крохотное отличие в один нуклеотид в начале 7-го экзона, но именно этот нуклеотид влияет на процесс сплайсинга — удаления некодирующих последовательностей из преРНК. Ген SMN2 не может из-за своей структуры обеспечить синтез достаточного количества стабильного и функционального SMN-белка (рис. 4) [4].
Рисунок 4. Схематическое изображение отрезка 5 хромосомы, которая содержит гены SMN1 и SMN2. На схеме видно, что в состав 7 экзона первого из рассматриваемых генов входит нуклеотид цитозин, а второго — нуклеотид тимин. Из-за этих отличий ген SMN2 не может синтезировать в нужных количествах функционирующий полноразмерный белок.
SMN необходим для работы всех клеток организма [4]. Почему же тогда именно моторные нейроны так чувствительны к его нехватке? Исследователи из Университета Эмори дают следующее объяснение данному явлению. Дело в том, что в каждой клетке мРНК считывается с ДНК и, в дальнейшем, служит основой для синтеза белков. Однако для того чтобы синтез белковой молекулы начался, мРНК должна быть доставлена в определенную точку клетки. Каждая матричная РНК имеет участок, который кодирует место доставки. Белок SMN как раз отвечает за корректное считывание данной информации, а при его нехватке данный механизм нарушается.
Поскольку спинальные моторные нейроны обладают очень длинными аксонами, то нарушение транспорта мРНК становится для них критичным. Из-за того что мРНК не достигает концов аксонов, наступает гибель нейронов, и, как следствие, последующая мышечная атрофия [5–7].
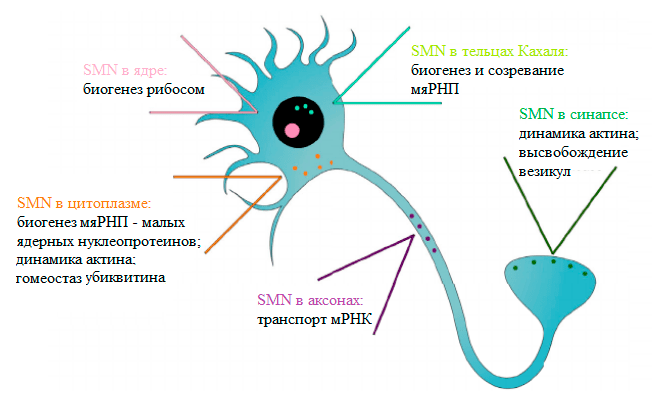
Однако роль SMN-белка в нейронах не сводится только лишь к транспортной функции. На рисунке 5 отображены основные функции SMN в нейронах [8].
Рисунок 5. Функции белка SMN в нейроне
Диагностика СМА
Спинальную мышечную атрофию не всегда просто отличить от других нейродегенеративных процессов. Так, к примеру, сходную со СМА этиологию имеют: атонически-астотическая форма ДЦП, миопатия, боковой амиотрофический склероз (именно это заболевание было у известного физика Стивена Хокинга) и др. [9]. И хотя СМА была описана еще в 1890 г., четкие критерии ее диагностики утверждены совсем недавно. Для диагностики СМА используют медико-генетический анализ. Его проведение может производиться как уже после рождения человека путем исследования крови, так и во время беременности путем исследования амниотической жидкости или ворсинок хориона. Также в некоторых случаях проверяют потенциальных родителей на предмет носительства мутировавшего гена.
Классификация СМА
Существует четыре основных типа СМА:
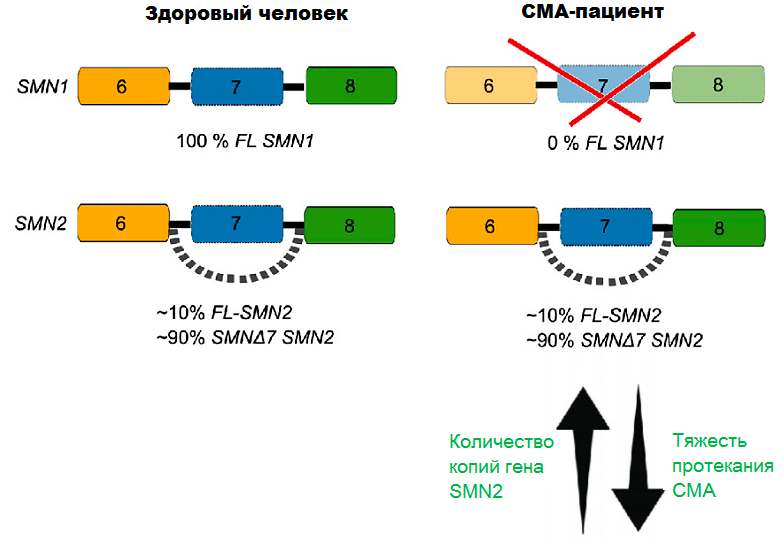
От чего же зависит, какой тип СМА будет у пациента? Как уже было сказано выше, у всех пациентов с «классической», или так называемой 5qСМА, ген SMN1 перестает синтезировать белок, а всю нагрузку берет на себя ген SMN2. От количества копий гена SMN2 и будет зависеть тип болезни, а также скорость ее прогрессирования. Чем больше копий SMN2 у человека, тем позже появляются первые признаки заболевания и тем легче его симптомы (рис. 6) [8].
Рисунок 6. Схематическое отображение разницы в синтезе SMN-белка у здоровых людей и СМА-пациентов. Только 10% белка, который продуцируется геном SNM2, являются полноразмерными и способными выполнять свои функции. Если ген SMN1 не функционирует должным образом, то нехватка SMN становится критичной, поэтому тяжесть протекания СМА напрямую зависит от количества копий гена SMN2.
Важно отметить, что при всех типах СМА пациенты интеллектуально развиты в соответствии с возрастом, у них зачастую практически полностью сохраняется моторная функция рук. Некоторые СМАйлики хорошо рисуют и являются талантливыми художниками. Среди них Вреж Киракосян. На рисунке 7 сфотографирован художник с одной из своих работ.
Рисунок 7. Художник Вреж Киракосян со своими картинами
Есть среди СМАйликов и одаренные певцы, как, например, Юлия Самойлова, которая в 2017 должна была представлять Россию на «Евровидении», но не смогла этого сделать по политическим причинам.
Поддерживающая терапия при СМА и пациентские организации
Долгое время лечение СМА сводилось к поддерживающей терапии или паллиативной помощи. Для большинства пациентов постсоветского пространства подход к терапии остается прежним и сейчас, поскольку у них нет доступа к новейшим разработкам в области лечения СМА. Больному рекомендуют умеренные физические нагрузки, такие как лечебная физкультура, занятия в бассейне, которые направлены, в первую очередь, на профилактику контрактур, сколиоза и других вторичных осложнений. При прогрессировании заболевания и развитии сколиоза СМАйликам предлагают операцию по закреплению позвоночника — спондилодез. Такую манипуляцию предпочтительно делать, когда рост позвоночника уже закончен, однако не всегда есть возможность ждать так долго, так как респираторный статус больного может ухудшиться в любой момент [10].
Также больным показано использование технических средств реабилитации, таких как ортопедические корсеты, вертикализаторы, ортезы. При прогрессировании болезни и затруднении при глотании, пациентов кормят через зонд или ставят гастростому. В крайних случаях питание можно вводить внутривенно. Но этот вариант возможен только в стационаре и не рассчитан на длительное время.
Очень серьезная проблема СМАйликов — это слабость респираторных мышц, что приводит к поверхностному дыханию, недостаточному снабжению клеток тела кислородом, сложностями с откашливанием, частым бронхитам и пневмониям. Именно слабость респираторных мышц является основной причиной летальных исходов при СМА.
Для того чтобы контролировать работу дыхательных мышц, СМАйликам рекомендуется выполнять различные дыхательные упражнения, в том числе с использованием мешка «Амбу», дыхательных тренажеров. Если респираторные мышцы уже не могут полноценно справляться со своими задачами, пациентам ставят трахеостому. Также при уходе за СМАйликами зачастую используют откашливатели — аппараты, способные неинвазивно, то есть без проникновения внутрь, удалять мокроту у тех людей, которые не могут ее самостоятельно откашливать.
Все эти методы не влияют на основную причину болезни, но помогают немного сглаживать ее внешние проявления. При этом цена поддерживающей терапии остается очень высокой и неподъемной для многих российских семей. Так, к примеру, один только откашливатель стоит от 85 до 850 тысяч рублей. Если добавить сюда еще стоимость витаминов, аминокислот, занятий в бассейне, ортопедических средств реабилитации, консультации с врачами, то сумма окажется просто астрономической.
Поэтому многие пациенты и их семьи вынуждены обращаться за помощью в различные благотворительные фонды и пациентские организации.
Люди, страдающие различными серьезными патологиями, а также их семьи, очень часто нуждаются в психологической, информационной и материальной поддержке. Для оказания подобной помощи существуют так называемые пациентские организации. «Биомолекула» уже писала о подобных организациях в таких статьях, как «Пациентский активизм и борьба с хроническими заболеваниями» [11] и «Пациентские организации в борьбе с аутоимунными болезнями» [12]. Не удивительно, что для СМАйликов и их родных также существуют подобные организации. Среди них: Cure SMA и SMA Foundation в США, FundAME в Испании, Initiative — Forschung und Therapie fuer SMA Deutsche Gesellschaft fuer Muskelkranke и SMA Deutschland в Германии, SMA Trust в Великобритании, Meier Advocacy & Support Center for SMA в Китае. Также подобные организации существуют в Италии, Израиле, Турции, Польше, Румынии, Украине и многих других государствах. Есть и общеевропейская — SMA Europe.
Среди российских организаций следует отметить фонд «Семьи СМА».
Такие организации информируют СМА-семьи о последних разработках в области терапии заболевания, о возможности участия в клинических испытаниях, ищут спонсоров и за их счет помогают частично оплатить расходы на реабилитацию, покупку необходимых лекарственных средств и аппаратуры, а также проводят обучение родителей пациентов, организуют различные мероприятия, которые призваны сделать жизнь СМАйликов более комфортной и долгой, а медицинскую помощь более доступной. Так, к примеру, только за последний год в России и странах ближнего зарубежья были проведены такие мероприятия как SMA Conference 2018 в Варшаве, Конференция по вопросам помощи больным спинально-мышечной атрофией 2018 и «Клиника СМА» в Москве, ProSMA в Харькове и многие другие.
Радикальный способ лечения СМА — пересадка головы
Для борьбы с заболеванием некоторые СМАйлики готовы решиться на крайние меры. Так, к примеру, пару лет назад бурно обсуждался (да и сейчас еще обсуждается, но с меньшей интенсивностью) проект итальянского хирурга Серджио Канаверо (рис. 8). Он заявил, что владеет технологиями, позволяющими пересадить человеческую голову от одного тела к другому, при этом, если все пойдет по плану, пациент останется жив (тот, который согласится любезно предоставить свою голову) и сможет пользоваться новым телом.
Рисунок 8. Серджио Канаверо рассказывает о своем проекте по пересадке головы
кадр из выступления хирурга на TED
Многие врачи назвали его заявление шарлатанством. Однако операция была назначена на декабрь 2017 года. Но была ли она проведена — не ясно. Одно время появилась информация о том, что в ноябре 2017 была сделана «тренировочная» пересадка головы от трупа к трупу, а само масштабное действо на живом человеке перенесено, но на какую дату — неизвестно [13]. Вообще, многие подробности, связанные с таким эпохальным событием, держатся в тайне и поэтому обрастают слухами [14].
Но зато точно известны люди, которые согласились стать добровольцами для данной операции. Первым кандидатом был российский программист Валерий Спиридонов, страдающий СМА. Однако вскоре у него появился конкурент из Китая. Серджио Канаверо отдал предпочтение китайскому претенденту, так как Поднебесная, активно развивающая у себя такое направление медицины как трансплантология, готова была предоставить площадку для проведения операции и поучаствовать материально. Россия же скромно молчала и никак не реагировала на то, что один из ее граждан собирается дать разрешение на отрезание своей головы и обзавестись новым телом. К слову сказать, конкурент Валерия Спиридонова почти в два раза его старше. Поэтому, учитывая способности организма к регенерации в разном возрасте, разумнее было бы взять в качестве добровольца именно Валерия. Но скандальный хирург решил по-другому.
С научной точки зрения оценить эту инициативу очень сложно. С одной стороны, Серджио Канаверо заявил об использовании двух принципиально важных инноваций при проведении операции: это нанонож из нитрида кремния, который должен обеспечить меньшую травматизацию спинного мозга, и полимер полиэтиленгликоль, который должен послужить чем-то вроде биоклея и позволить нервным волокнам донора и реципиента срастись без образования рубца. Однако даже если эти задачи будут решены успешно, существует еще множество проблем в области иммунологического конфликта, реабилитации пациента, его психологического здоровья. А если учесть еще и вопросы биоэтические и юридические [15], то инициатива Канаверо кажется и вовсе чем-то фантастическим. Однако следует помнить о том, что все привычные для нас сегодня вещи и явления когда-то были чем-то запредельным и недосягаемым. Так что, возможно, Серджио Канаверо нас еще удивит.
Подробнее о проекте по пересадки головы от человека к человеку читайте в статье «Голова профессора Канаверо» [16].
Нусинерсен — эффективное средство или ложная надежда?
Долгое время генетические заболевания считались по умолчанию неизлечимыми. Но сегодня человек замахнулся и на лечение данных патологий. Нельзя сказать, что всегда это получается удачно, но новые попытки предпринимаются с завидной регулярностью.
Так, после того как была выяснена генетическая природа СМА, начались поиски препаратов, способных хотя бы частично исправить генетический дефект. И вот, 23 декабря 2016 г. СМАйлики и их семьи были взбудоражены сенсационным известием: FDA (американское Управление по надзору за качеством лекарств и пищевых продуктов) зарегистрировало первое лекарство против СМА — нусинерсен (коммерческое название Spinraza, производитель — компания Biogen) (рис. 9). Через несколько месяцев препарат одобрило и EMA — Европейское медицинское агентство [17].
Рисунок 9. Первый зарегистрированный препарат для лечения СМА — нусинерсен (Spinraza)
Как же работает нусинерсен? Он исправляет дефекты сплайсинга матричной РНК гена SMN2, что, в свою очередь, увеличивает продукцию SMN-белка. К сожалению, представители компании Biogen пока не раскрывают более подробно механизм действия данного препарата. Терапия проводится в стационаре с участием многопрофильной медицинской команды, которая должна состоять из пульмонолога, физиотерапевта и реаниматолога. Лекарство вводят непосредственно в спинномозговую жидкость. Каждому СМА-пациенту необходимо несколько инъекций нусинерсена в год. Среди основных побочных воздействий препарата — инфекции верхних и нижних дыхательных путей, запоры.
Перед регистрацией клинические испытания проводили на группе из 121 пациента с инфантильным началом заболевания. Часть пациентов получала препарат, а часть — плацебо. В ходе исследования было выяснено, что 51% процент пациентов отвечал на лечение нусинерсеном, по сравнению с контрольной группой. У этих детей улучшились моторные навыки, а также снизились риск смерти и постоянной вентиляции легких. Однако данное исследование также означает, что, к сожалению, 49% пациентов, получавших нусинерсен в ходе исследования, не имели ответной реакции улучшения моторных навыков.
В дальнейшем компания-производитель провела исследования лекарственного средства на людях с более поздним началом СМА. Наблюдения вели за пациентами в течении 15 месяцев. В результате было отмечено, что по шкале Хаммерсмита, которая позволяет оценивать уровень двигательных навыков СМАйликов, пациенты, получавшие препарат, в среднем улучшили свои показатели на 4 пункта, в то время как у СМАйликов из контрольной группы показатели ухудшились на 1,9 балла [18].
Сегодня, как заявляют представители компании Biogen, применение нусинерсена рекомендовано для пациентов любого возраста и при любом типе СМА.
В октябре 2018 компания «Биоген» представила новые данные по препарату нусинерсен на ежегодном Конгрессе Всемирного общества нервно-мышечных заболеваний. На этот раз исследования проводили на пресимптоматических младенцах со СМА. Представители «Биогена» заявляют, что были получены впечатляющие результаты: после применения нусинерсена 100% испытуемых могли сидеть без поддержки и 88% — ходить [19]. Результат обнадеживающий, однако, для того чтобы применять лечение к пресимптоматическим младенцам, необходим скрининг новорожденных, направленный на раннее выявление СМА. В России и других постсоветских государствах такие исследования пока не проводили и, зная инертность отечественного здравоохранения, можно предположить, что еще не скоро будут проводить.
Новость о появлении первого зарегистрированного препарата для лечения СМА казалась фантастической. Заболевание, которое очень часто приводит к летальному исходу, теперь можно лечить! У СМАйликов есть шанс на жизнь!
Однако восторг пациентов и их семей значительно поубавился, когда производитель препарата озвучил цену. В год человеку, страдающему СМА, необходимо несколько инъекций и их суммарная стоимость составляет несколько сотен тысяч долларов. Эта сумма является неподъемной для большинства СМА-семей. Однако в США и Евросоюзе можно воспользоваться лечением по страховке. Поэтому применение первого лекарства против СМА уже начало набирать обороты.
Однако за пределами США и Евросоюза обсуждаемое лекарственное средство не везде было встречено с большим восторгом. Так, в Великобритании нусинерсен столкнулся с рядом сложностей. Организация NICE — National Institute for Health and Care Excellence — не одобрила использование нусинерсена для лечения спинальной мышечной атрофии. При этом представители NICE говорят о возможной «существенной пользе» от применения данного лекарственного средства для СМА-пациентов, но при этом также отмечают, что в связи со «значительной неопределенностью, особенно в отношении долгосрочных перспектив» и высокой стоимостью препарата не могут рекомендовать его для терапии спинальной мышечной атрофии. При этом организация заявляет, что готова к «дальнейшему обсуждению» сложившейся ситуации с представителями компании «Биоген» [20], [21].
В России и других странах постсоветского пространства данный препарат также все еще не зарегистрирован. Это означает, что даже если родственники пациента каким-то чудом добудут это лекарство, то ни один из российских врачей не имеет права его применять, поэтому лечение пока возможно только за границей.
Пациентов же и их семьи волнует следующий вопрос: действительно ли нусинерсен является панацеей для СМАйликов? К сожалению, однозначного ответа на данный вопрос нет. Некоторые врачи твердо уверены в том, что нусинерсен — это прорыв в лечении СМА. Так, к примеру, Эдуардо Тициано, один из ведущих специалистов в вопросах диагностики и лечения СМА, не так давно, во время своего приезда в Россию, заявил, что «СМА больше не неизлечима» и что «в ближайшее время появится несколько способов лечения СМА» [22]. Другие же доктора напоминают о результатах клинических исследований, и о том, что у 49% пациентов в инфантильной группе, у которых лечение началось уже после появления симптомов, препарат не дал никакого положительного результата [18]. Кроме того, неизвестно, насколько долгосрочным является эффект от применения нусенерсена [17].
Семьи же СМАйликов, в большинстве своем, придерживаются мнения, что этот препарат, как минимум, позволит их близким остаться живыми и дождаться принципиально другого средства лечения СМА. Какого? Читайте ниже. Но сначала о препаратах, созданных для борьбы со СМА, которые сходны по своему действию c нусинерсеном.
Разработка новых препаратов, направленных на улучшение работы гена SMN2
На данный момент ведутся разработки других препаратов, которые теоретически смогут составить конкуренцию нусинерсену. В целом, все такие лекарственные средства можно разделить на три основные группы:
На сегодняшний день известен ряд веществ, таких как вальпроевая кислота, бутират натрия, гидроксимочевина, 4-фенилбутират, некоторые аминокислоты, которые увеличивают продукцию SMN-белка геном SMN2 [4]. Механизм увеличения синтеза белка для многих из этих веществ еще не до конца изучен. На данный момент ведутся исследования эффективности и безопасности указанных веществ при лечении СМА.
До стадии клинических испытаний на пациентах дошел препарат RG7916 (коммерческое название Risdiplam, производитель — швейцарская компания Roche). Это лекарственное средство, как и нусинерсен, относится ко второму типу, если исходить из приведенной выше классификации. То есть препарат модифицирует сплайсинг мРНК SMN2. Его концептуальное отличие от нусинерсена заключается в том, что он вводится перорально или через гастростому, в то время как Spinraza должна попасть непосредственно в спинно-мозговую жидкость [23]. Примечательно, что российские СМАйлики также имеют возможность принять участие в клинических исследованиях, не выезжая за границу, поскольку в Москве открыт центр по программе Sunfish, задача которого испытывать препарат Risdiplam на пациентах со СМА II и III типов. 4 июля 2018 года начали первые скрининги в данном центре [24].
Генетическое редактирование: дождутся ли СМАйлики?
Действие всех вышеописанных препаратов основано на работе с геном SMN2. Однако основная проблема людей, страдающих СМА, в отсутствии полноценной работы гена SMN1, поскольку SMN2 не может его полностью заменить. Так можно ли подойти к проблеме с этой стороны? Оказывается, можно! И здесь на помощь приходят технологии генетического редактирования.
Уже несколько лет научное сообщество активно обсуждает использование технологии CRISPR/Cas9 для решения целого ряда глобальных проблем, стоящих перед человечеством, а также этические вопросы, с этим связанные. Технология позволяет редактировать геномы всех живых организмов, в том числе и человека. Подробнее об этом можно почитать в статьях «Мутагенная цепная реакция: редактирование генома на грани фантастики» [25] и «А не замахнуться ли нам. на изменение генома» [26].
Сегодня идут активные исследования по разработке методов CRISPR/Cas9 для лечения ВИЧ, онкозаболеваний, миопатии Дюшена, и вот, очередь дошла и до СМА [27].
Рисунок 10. Логотип компании AveXis — первого разработчика генной терапии для СМА-пациентов
AVXS-101 — лекарственное средство, созданием которого занимается компания AveXis (рис. 10) [28].
В отличие от описанных выше препаратов, AVXS-101 не влияет на работу гена SMN2, его целью является SMN1. В результате использования генной терапии мутировавший или отсутствующий ген замещается функционально полноценным, способным синтезировать полноразмерный стабильный SMN-белок. Это сложно представить, но технически реализовать уже вполне возможно [29]. Более того, AVXS-101 уже прошел стадию изучения на животных и сейчас идет этап клинических исследований на людях.
Сегодня рассматривают два возможных способа введения препарата — внутривенно и непосредственно в спинномозговую жидкость. Второй вариант хоть и технически более сложен, но способен снизить потребность в лекарстве для взрослых пациентов, особенно с избыточным весом. Такой способ введения делает AVXS-101 доступным для большего числа людей.
В октябре 2018 года компания AveXis сделала заявление, которое подарило очередной лучик надежды всем СМАйликам: AVXS-101 подан на одобрение в регистрационные медицинские органы Соединенных Штатов, Европы и Японии. Если не возникнет никаких непредвиденных обстоятельств, то уже в середине 2019 года первый препарат для генетической терапии СМА будет зарегистрирован.
После регистрации его планируют использовать для лечения младенцев со СМА I возрастом до 9 месяцев. Однако со временем AVXS-101 будет применяться и для других групп пациентов [25].
Безусловно, несмотря на всю перспективность данного лекарственного средства, необходимо помнить о том, что технология эта еще очень новая, а значит, возможны различные неожиданные побочные эффекты в долгосрочной перспективе.
Подводя итог, можно сказать, что СМА все еще остается серьезным заболеванием, которое существенно снижает качество жизни пациентов и их семей и зачастую приводит к летальному исходу в детском или подростковом возрасте. Но динамика разработки новых лекарственных препаратов позволяет надеяться, что ситуация скоро изменится в лучшую сторону. Хотелось бы, чтобы в ближайшие годы лечение стало более эффективным и доступным для граждан разных государств, а не только резидентов Евросоюза и США. И будем ждать выход на фармацевтический рынок AVXS-101, поскольку этот препарат обещает стать новым переломным моментом в терапии обсуждаемого заболевания. Главное, чтобы как можно больше СМАйликов смогло дождаться этого дня, поскольку для многих из них и полгода — очень значительный срок.