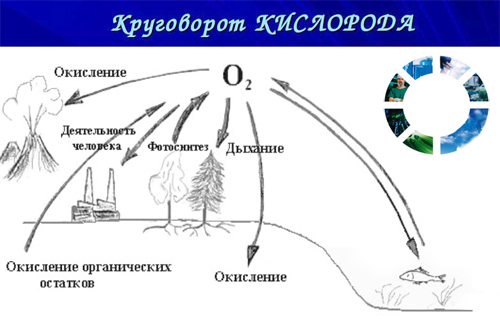
в каком виде кислород встречается в природе
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
В каком виде кислород встречается в природе
Наш урок посвящен химическому элементу, который занимает особое место в жизни человека и всего живого. Речь пойдет о кислороде. Вы познакомитесь с общей характеристикой химического элемента – кислорода по его положению в ПСХЭ, рассмотрим нахождение кислорода в природе, изучим способы получения кислорода и его физические свойства.
Также данный урок посвящен изучению истории открытия одного из самых известных неорганических веществ – кислорода. Из материалов урока вы узнаете, кому принадлежит приоритет открытия кислорода и кто дал название этом веществу.
“Кислород — это вещество, вокруг которого вращается земная химия”.
I. Познавательный фильм: “Кислород”
II. Общая характеристика кислорода как химического элемента по положению его в ПСХЭ
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8.
Обозначается символом O (лат. Oxygenium).
Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
Относительная молекулярная масса равна 32, т.е. Мr(O2)=32.
III. Валентность кислорода, физические свойства
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует. В свободном виде встречается в виде двух простых веществ: О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха, с относительной молекулярной массой =32. О3 – газ без цвета с резким запахом, с относительной молекулярной массой =48.
Кислород поддерживает дыхание и горение. Причем, если внести в сосуд с кислородом тлеющую лучинку, то она вспыхнет ярким пламенем.
Это интересно: “Какого цвета твердый кислород”
При температуре 90 K газ кислород превращается в бледно-голубую жидкость, а при температуре 54 K становится твёрдым. Но твёрдый кислород твёрдому кислороду рознь: в интервале давлений от 0 до приблизительно 130 гигапаскалей (1,3 млн атмосфер) кислород может существовать по крайней мере в шести модификациях (их обозначают греческими буквами γ, β, α, δ, ε и ζ). Эти модификации отличаются друг от друга кристаллической решёткой, магнитными и электрическими свойствами, а также цветом. Например, при давлении 5,4 гПа (это примерно в 52 тысячи раз выше атмосферного) твёрдый кислород имеет бледно-голубой цвет. При дальнейшем повышении давления (до 10 гПа) твёрдый кислород становится красным. Некоторые модификации твёрдого кислорода даже называют по их характерному цвету. Например, δ-O2 называют оранжевым кислородом, а ε-O2 — красным кислородом.
IV. Кислород в природе

Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле — около 65 %.
V. Открытие и получение кислорода
Приоритет открытия кислорода принадлежит англичанину Джозефу Пристли.В 1774 г. он обнаружил, что при разложении оксида ртути образуется газообразное вещество, в атмосфере которого тлеющая лучина вспыхивает ярким пламенем, а дышать этим газом особенно легко. Это был кислород. Уравнение реакции разложения оксида ртути:
Пристли поделился своим открытием с А.Лавуазье, и тот дал газу название «кислород».
Интересно, что еще до работ Дж. Пристли в 1771 г. опыты по разложению оксида ртути проделал шведский химик Карл Шееле. Но результаты его исследований были опубликованы только в 1775 г., поэтому Пристли о них ничего не знал.
Есть еще один интересный исторический факт. Оказывается голландский химик Корнелиус Дреббел примерно за 150 лет до Пристли и Шееле получил кислород при нагревании нитрата калия:
Он описал свойства полученного газообразного вещества: тлеющий уголек в нем вспыхивал, в атмосфере этого газа легко дышалось. Свое открытие ученый даже использовал на изобретенном им подводном судне. Однако в то время ученые не интересовались газами, и открытие Дреббела даже не заметили.
VI. Получение кислорода
Промышленный способ получения кислорода
Лабораторные способы получения кислорода
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
1. Разложение пероксида водорода
При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
2. Разложение перманганата калия
При нагревании перманганат калия разлагается с образованием кислорода.
В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
3. Разложение бертолетовой соли
Это интересно
Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
Познавательный фильм: “Кислород”
Кислород (O, Oxygenium)
История кислорода
Открытие кислорода произошло дважды, во второй половине XVIII столетия с разницей в несколько лет. В 1771 году кислород получил швед Карл Шееле, нагревая селитру и серную кислоту. Полученный газ был назван «огненным воздухом». В 1774 английский химик Джозеф Пристли проводил процесс разложения оксида ртути в полностью закрытом сосуде и открыл кислород, но принял его за ингредиент воздуха. Только после того, как Пристли поделился своей находкой с французом Антуаном Лавуазье, стало понятно, что открыт новый элемент (calorizator). Пальма первенства данного открытия принадлежит Пристли потому, что Шееле опубликовал свой научный труд с описанием открытия лишь в 1777 году.
Общая характеристика кислорода
Кислород является элементом XVI группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 8 и атомную массу 15,9994. Принято обозначать кислород символом О (от латинского Oxygenium – порождающий кислоту). В русском языке название кислород стало производным от кислоты, термина, который был введён М.В. Ломоносовым.
Нахождение в природе
Кислород является самым распространённым элементом по нахождению в земной коре и Мировом океане. Соединения кислорода (в основном – силикаты) составляют не менее 47% массы земной коры, кислород вырабатывается в процессе фотосинтеза лесами и всеми зелёными растениями, большая часть приходится на фитопланктон морских и пресных вод. Кислород – обязательная составная часть любых живых клеток, также находится в большинстве веществ органического происхождения.
Физические и химические свойства
Кислород – лёгкий неметалл, состоит в группе халькогенов, имеет высокую химическую активность. Кислород, как простое вещество, представляет собой газ без цвета, запаха и вкуса, имеет жидкое состояние – светло-голубая прозрачная жидкость и твёрдое – светло-синие кристаллы. Состоит из двух атомов кислорода (обозначается формулой О₂).
Полезные свойства кислорода и его влияние на организм
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Биологическая роль кислорода
Кислород – основа основ жизнедеятельности всех живых организмов на Земле, является основным биогенным элементом. Находится в составе молекул всех важнейших веществ, которые отвечают за структуру и функции клеток (липиды, белки, углеводы, нуклеиновые кислоты). Каждый живой организм содержит гораздо больше кислорода, чем какого-либо элемента (до 70%). Для примера, организм взрослого среднестатического человека массой 70 кг содержит 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и человек) благодаря органам дыхания и поступлению воды. Помня о том, что в организме человека самый главный орган дыхания – это кожа, становится понятно, сколько кислорода может получать человек, особенно летом на берегу водоёма. Определить потребность человека в кислороде достаточно сложно, ведь она зависит от многих факторов – возраст, пол, масса и поверхность тела, система питания, внешняя среда и т.д.
Применение кислорода в жизни
Кислород применяется практически повсеместно – от металлургии до производства ракетного топлива и взрывчатых веществ, применяемых для дорожных работах в горах; от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E941, как пропеллент и упаковочный газ.
В каком виде кислород встречается в природе
§6.1 Кислород, его распространенность в природе. Атмосфера.
Мы не случайно начинаем изучение химии важнейших элементов с кислорода. Кислород – действительно важнейший элемент. Его химия тесно связана практически со всеми элементами Периодической системы, поскольку с каждым из них кислород образует те или иные соединения. Исключение составляют только легкие инертные газы – гелий, неон, аргон.
Есть и еще одна важная причина. Кислород играет исключительную роль в существовании на Земле жизни и всей человеческой цивилизации. На поверхности планеты – в земной коре – связанный кислород является самым распространенным элементом. В составе минералов, в виде соединений с другими элементами он составляет 47 % от массы земной коры!
В атмосфере Земли кислород находится в свободном (не связанном) состоянии: здесь его 21 % по объему или 23 % по массе.
Основная масса кислорода в атмосфере планеты возникла только после появления на Земле первых фотосинтезирующих одноклеточных организмов – прокариот, известных под названием сине-зеленые водоросли. Процесс этот начался около 2 млрд. лет тому назад (см. рис. 6-1). Под действием солнечного света (отсюда название – фотосинтез) прокариоты усваивали из углекислого газа углерод и кислород. Из воды они усваивали только водород, одновременно выделяя в атмосферу свободный кислород в качестве побочного продукта жизнедеятельности.
Рис. 6-1. Одна из гипотез возникновения современной атмосферы Земли. Обратите внимание на связь между изменением состава атмосферы и сменой биологических эпох. (По книге П. Эткинса «Молекулы»).
Интересно, что только теперь, спустя 2 миллиарда лет, совершенно точно выяснился «геологический смысл жизни» каждой отдельно взятой сине-зеленой водоросли, жившей в то время. Это живое существо должно было родиться здоровым, прожить как можно более долгую жизнь (чтобы выделить в атмосферу как можно больше кислорода), оставить после себя здоровое, полноценное потомство. Оно не должно было «обижать» других прокариот, чтобы и те могли выполнить такую же миссию, отведенную им природой. Иными словами, смысл жизни заключается в том, чтобы жить.
Вероятно, это правило действует и поныне для всех живых существ. Не пройдет и одного-двух миллиардов лет, как выяснится «геологический смысл жизни» человечества. В чем он, этот смысл? Попробуйте подумать на эту тему (см. задачу 6.22 в конце этой главы).
Но вернемся к атмосфере Земли. Каким же образом в нашу эпоху восполняются потери кислорода в природе? Это происходит благодаря растениям, которые сохранили способность под действием солнечных лучей (фотосинтетически) превращать углекислый газ и воду в кислород и углеводы (строительный материал клеток растений). Процесс образования в растениях углеводов (целлюлозы, крахмала и других) можно записать таким общим уравнением (здесь n – некое целое число, достаточно большое):
Вспомните предыдущую главу, где мы рассчитали потери кислорода при работе сравнительно маломощного автомобильного двигателя, и вы поймете, почему лесные массивы зачастую называют легкими планеты. Очень важную роль играют и водоросли океана. Все растения Земли в течение года создают около 300 млрд. т кислорода. Таким образом, все блага и само существование человеческой цивилизации целиком зависят от зеленых растений.
Кислород – газ без цвета, вкуса и запаха, немного тяжелее воздуха. Если на весах уравновесить пустой стакан, а затем через трубку наполнить его кислородом, то равновесие нарушится.
Кислород слабо растворим в воде – в 1 л воды при 20 ° С растворяется 31 мл кислорода (0,004% по массе). Тем не менее, этого количества хватает для дыхания рыб, живущих в водоемах.
Природный кислород содержит три изотопа: 16 8O (99,76%), 17 8O (0,04%), 18 8O (0,20%).
Структуру молекулы кислорода в первом приближении можно представить следующим образом:
Вместе с неподеленными парами электронов каждое ядро молекулы O 2 «обслуживается» восемью электронами, что и требуется для достижения минимума энергии всей системы.
Трудно сказать, как при этом правильно изображать структурную формулу молекулы кислорода. Можно рассмотреть два варианта:
Судя по длине связи в молекуле О2 (1,207 ангстрема), вариант с кратными связями ближе к истине. Например, известно, что длина простой связи О–О в молекуле перекиси водорода Н2О2 намного больше: 1,48 ангстрема.
Однако валентность (II) для кислорода в подавляющем большинстве его соединений не вызывает никаких сомнений.