в каком классе изучают строение атома по химии
Строение атома. 8-й класс
Класс: 8
Презентация к уроку
Цель урока: создать условия для формирования таких понятий, как атом, орбиталь, изотопы, протон, нейтрон, электрон. Продолжать формировать умение работать с Периодической системой, рассмотреть физический смысл порядкового номера элемента. Познакомить с историей открытия строения атома.
Тип урока: урок усвоения новых знаний.
Ход урока
2. Изучение нового материала.
Ребята, сегодня тема нашего урока: «Строение атома».
ПЛАН УРОКА
2. Практическая часть.
Впервые понятие «атом» ввел Демокрит, но он не вкладывал в него столь глубокий смысл.
В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия».
Гораздо позже в 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. После открытия радиоактивности, эта модель не соответствовала действительности.
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки.
Планетарная модель Резерфорда
Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
А сейчас ребята, обсудим некоторые термины, запишите их в словарик.
Запись а.е.м. – означает атомную единицу массы
В ядре сосредоточена большая часть массы атома
Посмотрите на таблицу.
| частица | место нахождения | масса | заряд |
| Протон P+ | ядро | 1 а.е.м | +1 |
| Нейтрон n0 | ядро | 1а.е.м. | 0 |
| Электрон e- | орбиталь | 0 | -1 |
Порядковый номер элемента:
Практическая часть
Заполни таблицу
А сейчас ребята выполним небольшой тест
Тестовые задания
Поменяйтесь заданиями с соседом по парте, проверим ответы:
МОЛОДЦЫ! ЭТО ВАМ УДАЛОСЬ.
Установите соответствие, соединив стрелками (слайд 17)
Вы справились. Желаю дальнейших успехов в изучении химии!
Домашние задание: параграф 6, 7, упр. 3 стр.24
Урок 13 Бесплатно Строение атома
Состав атома
В ходе изучения химии вы уже познакомились со многими веществами и их свойствами. В нескольких уроках вам встречалось строение атома. Настало время познакомиться с ним более подробно.
Это нужно для того, чтобы лучше понимать понятия «валентность» и «степень окисления», уметь составлять формулы химических соединений и понимать формулы веществ, изображаенных схемами.
Здесь вы видите, из чего устроены молекулы веществ:
У меня есть дополнительная информация к этой части урока!
Эра современных представлений о строении атома началась в 1896 году, когда французский ученый Анри Беккерель открыл явление радиоактивности.
Анри Беккерель – представитель династии ученых-физиков.
Радиоактивность он открыл случайно. Ученый завернул в непрозрачный материал сульфат калия-уранила (вещество, содержащее уран) и положил его вместе с фотопластинками, а впоследствии обнаружил на пластинках засветку в форме куска этого вещества.
За открытие радиоактивности в 1903 году ему была присуждена Нобелевская премия.
С одним из интересных свойств атома связана радиоактивность.
Радиоактивность – свойство атома самопроизвольно излучать невидимые глазом частицы; оно обусловлено распадом их атомных ядер, превращением в другие элементы.
Радиоактивными являются не все атомы.
Как правило, в среднем чем больше масса ядра, тем больше его нестабильность.
Распад радиоактивного атомного ядра сопровождается выбросом трех видов излучений (атом может излучать какой-либо один вид частиц или их комбинацию):
α-лучи представляют собой ядра атомов гелия – частицы, состоящей из двух протонов и двух нейтронов
β-лучи – электроны
γ-лучи – электромагнитное излучение с очень большой частотой: на шкале электромагнитых волн оно находится левее рентгеновского излучения, а значит, является более энергетичным
У меня есть дополнительная информация к этой части урока!
Важно знать, на какие расстояния проникают различные виды излучений и какой вред они наносят живым организмам.
α-лучи – проникают на несколько сантиметров. Не проходят даже сквозь бумагу.
β-лучи – проникают на расстояние около 20 метров. Защитой может стать сталь толщиной 3 мм.
γ-лучи – проникает на расстояние около 1 километра. Для защиты используют металл или бетон толщиной в несколько сантиметров.
Также следует помнить, что радиоактивные вещества опасны не сами по себе (например, держать в руках кусок урана не очень опасно) – опасна пыль, которую могут образовывать эти вещества – при попадании внутрь организма она может нанести ощутимый вред здоровью.
Изучением радиоактивности и всего, что с ней связано, занимается отдельная область химии – радиохимия.
Используя α-излучение и испытывая его действие на тонкую металлическую фольгу, Эрнест Резерфорд обнаружил, что α-частицы, проходя через нее, отклоняются от первоначального направления движения.
У меня есть дополнительная информация к этой части урока!
Эрнест Резерфорд – английский ученый.
Считается основоположником ядерной физики – науки о превращениях атомных ядер.
Сконструировал магнитный детектор – приёмник электромагнитных волн.
Открыл α— и β-лучи, предложил для них именно такое название.
Лауреат Нобелевской преми 1908 года за исследования в области радиоактивного распада.
В 1920 году теоретически предположил существование нейтрона.
Это открытие послужило экспериментальным доказательством существования положительно заряженного ядра атома. На его основе в 1911 г. ученый создал планетарную модель атома.
Согласно планетарной модели, атом состоит из несущего положительный заряд ядра и движущихся вокруг него отрицательно заряженных электронов.
Сейчас эту модель называют модель Резерфорда-Бора. Датский физик Нильс Бор внёс уточнение в схему Резерфорда: он сказал, что электроны движутся вокруг ядра не хаотично, а по строго определенным орбитам, а также рассчитал радиусы этих орбит.
Радиус первой орбиты в атоме водорода 5,2917720859 х 10 −11 м в физики сейчас называют боровским радиусом.
Позже были открыты составные части атомного ядра: протон и нейтрон, а еще позднее было выявлено огромное число разнообразных микрочастиц.
Таким образом, по современным представлениям, атом состоит из ядра и электронов. В свою очередь, ядро состоит из протонов и нейтронов.
По своей массе протоны и нейтроны почти одинаковы, их массы равны 1 дальтону (атомная единица массы). Протон имеет положительный заряд, условно принятый равным +1, а нейтрон заряда не имеет.
Электрон имеет заряд, по модулю равный заряду протона, но отрицательный, то есть –1. Масса электрона примерно в 1800 раз меньше массы протона, поэтому ей пренебрегают. Протоны обозначают символом р, нейтроны – n, электроны – е.
Согласно современной теории ядра, протоны и нейтроны связаны между собой сильным взаимодействием.
Всего физики выделяют 4 вида взаимодействий: сильные (ядерные), слабые, гравитационные, электромагнитные.
Составляющие атом частицы обусловливают его важнейшие характеристики.
Заряд ядра – важнейшая характеристика атома и соответствующего ему химического элемента.
Положительный заряд ядра обусловлен протонами: заряд ядра равен числу протонов в нем.
Порядковый номер элемента в периодической системе Менделеева как раз и равен заряду ядра его атомов и обозначается буквой Z.
Таким образом, химический элемент – это вид атомов с одинаковым зарядом ядра.
Другой характеристикой атома, зависимой от частиц ядра, является масса ядра.
Масса ядра складывается из числа протонов и нейтронов в ядре атома.
От количества и расположения электронов в атоме зависят его качественные характеристики: способность объединяться с другими атомами и химические свойства.
Пройти тест и получить оценку можно после входа или регистрации
Строение атома

Всего получено оценок: 2987.
Всего получено оценок: 2987.
Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
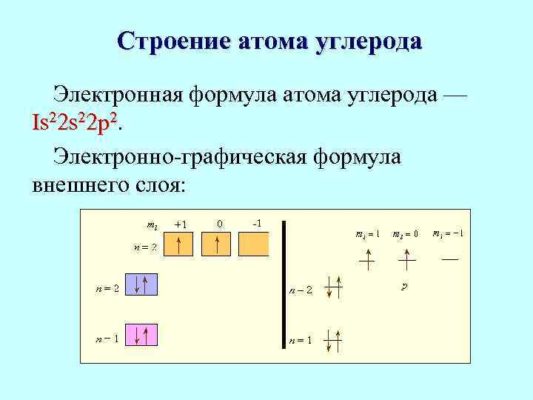
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Строение атома
Цели урока:
обучающие:
развивающие:
воспитательные:
Оборудование(демонстрационное) мультимедийный компьютерный класс.
Лабораторное оборудование (для практической работы) полиэтиленовые пленки (2 шт.), бумажная полоска; пластмассовая линейка, комочек ваты.
Раздаточный материал: таблица Менделеева.
Тип урока: изучение и первичное закрепление новых знаний.
Форма урока: урок с использованием ИКТ.
План урока:
1. Актуализация знаний и мотивация деятельности
Показ слайда по изученной теме, вопрос по рисунку.
Отвечают на вопросы учителя после просмотра слайда
2. Работа в группах. Выполнение практической работы
Объяснение цели выполнения работы, совместный анализ результатов деятельности.
Выполнение практической работы, демонстрация опыта, ответы на вопросы.
3. Открытие нового знания
Обеспечить усвоения новых знаний
Формулируют цель. Участвуют в диалоге с учителем, отвечают на вопросы, делают выводы, делают краткие записи в тетради.
Создать атмосферу и обеспечить выполнение
Выполняют под счет ученика
4. Первичное закрепление изученного материала
Закрепление изученного материала при разборе задач, вопросов.
Решают задачи в группах и отвечают на вопросы учителя.
5. Самостоятельная работа за компьютерами
Контроль за выполнением теста
Учащиеся выполняют тест за компьютерами
6. Рефлексия деятельности (итог урока)
Анализ и оценка успешности работы на уроке.
Записывают д/з, считают жетоны и работают со своим листом самооценки, чтобы определить отметку за урок по критериям учителя.
Ход урока
Организационный момент.
Науку все глубже постигнуть стремись,
Познанием вечного жаждой томись.
Лишь первых познаний блеснет тебе свет,
Узнаешь; предела для знания нет.
ФИРДОУСИ (Персидский и таджикский поэт)
Сегодня на уроке мы продолжим разговор об электризации тел и выясним, почему при взаимодействии одно тело заряжается положительно, другое – отрицательно.
Не забывайте, для того, чтобы получить сегодня хорошую оценку, набирайте жетоны за правильные ответы.
(Жетоны используются на каждом уроке, за пять набранных жетонов ставится оценка «5»).
Презентация «Строение атома»
1 слайд: Объясните, что вы видите на картинке?
Серия экспериментов «Электрическое поле»
Каждое задание проделывает группа учащихся и дают ответы на вопросы.
1. Изучение зависимости силы взаимодействия заряженных тел от абсолютного значения зарядов и расстояния между ними
Приборы и материалы: полиэтиленовые пленки (2 шт.), бумажная полоска.
Порядок выполнения работы
1. Положите две полиэтиленовые пленки рядом на стол (параллельно друг другу) и проведите по ним один раз рукой. Поднимите пленки за концы, разведите их и, медленно сближая, наблюдайте за их взаимодействием.
2. Повторите опыт с этими же пленками, натерев их рукой. Как изменилась сила взаимодействия пленок?
3. Проделайте аналогичные опыты с полиэтиленовой пленкой и бумажной полоской. Для их электризации положите на бумажную полоску полиэтиленовую пленку и потрите их рукой (первый раз – слегка, второй раз – сильнее). Каждый раз разводите полоски и, медленно поднося друг к другу, наблюдайте за их взаимодействием.
4. Ответьте на вопросы:
2. Наблюдение парения заряженной пушинки в электрическом поле
Приборы и материалы: пластмассовая линейка, комочек ваты.
Порядок выполнения работы
1. Положите пластмассовую линейку на стол и натрите ее бумагой.
2. Распушите очень маленький комочек ваты и положите его на линейку.
3. Поднимите наэлектризованную линейку и легонько сдуйте с нее пушинку вверх.
4. Поместите быстро линейку снова к пушинке и наблюдайте за ее движением в электрическом поле заряженной линейки. (Если пушинка прилипнет к линейке, сдуйте ее и снова повторите опыт.)
5. Ответьте на вопросы:
Комментарий учителя (после разбора опыта).
Этот опыт показывает возможность уравновешивания силы тяжести, действующей на тело, силой электрического поля
2 слайд:
Учащиеся отвечают на вопросы:
Открытие нового знания
Любое вещество состоит из молекул, молекулы из атомов.
О чем сегодня мы говорим на уроке? (версии учащихся)Постановка цели.
3 слайд: Итак, тема урока «Строение атома» (запишите в тетрадь)
4 слайд: (из истории)
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома.
В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
5 слайд: Ученые Джозеф Томсон и Эрнест Резерфорд предложили свои модели строения атома. Кто же был прав?
6 слайд: В 1903 году Джозеф Томсон предложил одну из первых моделей «Кекс с изюминкой», т. е. атом представляет собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны.
7 слайд: В 1911 году Резерфорд провел ряд опытов по исследованию состава и строения атома. В центре атома находится положительно заряженное ядро, вокруг ядра движутся электроны. Эту модель назвал «планетарной моделью», схожей с нашей Солнечной системой.
Запишите в тетрадь: Резерфорд – планетарная модель атома.
8 слайд: Атом состоит: из положительно заряженного ядра, в котором протоны – положительные частицы, нейтроны – без заряда (имеют только массу), вокруг ядра движутся отрицательные электроны. Сколько положительных частиц в атоме, столько и отрицательных, поэтому атом в целом нейтрален.
Зарисуйте в тетрадь схему.
Строение всех атомов зашифровано в периодической системе химических элементов, которую создал Менделеев. Порядковый номер химического элемента показывает электрический заряд ядра атома.
Положите перед собой листочки с таблицей Менделеева.
Рассмотрим химический элемент водород:
Какой у него порядковый номер?
Ученик: (предполагаемый ответ)у него первый порядковый номер,
Чему равен заряд ядра?
Ученик: (предполагаемый ответ) Заряд ядра равен 1
Сколько в атоме протонов, электронов?
Ученик: (предполагаемый ответ) число протонов в ядре 1, но т.к. атом нейтрален, то и на оболочках 1 отрицательный электрон.
А – атомная масса, Z – число электронов, N – число нейтронов
(Аналогично, для гелия, железа.)
10 слайд:
Собрать, сколько надо, частиц всех сортов,
Но в общее дело их вклады неравны.
Так кто же из этих частиц самый главный –
Пузатый протон, флегматичный нейтрон,
А может быть, юркий малец электрон?
Итак, какая задача стоит перед нами?
Выяснить, какие частицы в атоме главные?
Изменяем число электронов
Если при электризации тело получает положительный заряд, это значит, что от атома отделился отрицательный электрон. Какой заряд данной частицы? (ответы учащихся).
11 слайд: Если при электризации тело получает отрицательный заряд, это значит, что к атому присоединился отрицательный электрон. Как станет называться частица? (отрицательным ионом).
12 слайд: Какой сделаем вывод? Запишите его в тетрадь:
(Частица, которая получилась при отдаче (потере) электрона, называется положительным ионом.
Частица, которая получилась при принятии (присоединении) электрона, называется отрицательным ионом.)
Вывод: вид атома не изменился.
13 слайд: Изменим число нейтронов в атоме.
Запишите в тетрадь:
Атомы одного вида, но имеющие разные числа нейтронов (разные массы), называются изотопами.
Сделайте вывод. (вид атома не изменился).
14 слайд: Изменим число протонов в атоме.
Вывод: (вид атома изменился). Получили новый химический элемент.
Запишите в тетрадь:
Вывод: Главная характеристика химического элемента не число электронов, а заряд ядра.
Динамическая пауза
Пока занимались мы, тихо, но прытко
В класс к нам пробралась сеньора ошибка.
Чтоб убралась она без оглядки
Сделать придется физическую зарядку.
Правильно – вверх, неверно – вперед,
Первичное закрепление изученного материала. (карточки на столах)
Упражнение 1. (устно)
В ядре атома бора 10 частиц. Вокруг ядра движутся 5 электронов. Сколько в ядре протонов и сколько нейтронов?
(Учащиеся получают жетоны)
Упражнение 2. (в группе)
Изобразить атом лития
Вопросы: От атома отделили один электрон, как будет называться данная частица? (изобразить).
(За верно выполненное задание получает жетон)
Упражнение 3. (в группе)
Изобразить атом бериллия
К атому присоединился один электрон, как будет называться данная частица? (изобразить)
(За верно выполненное задание получает жетон)
Самостоятельная работа
ТЕСТ (Учащиеся рассаживаются за компьютеры).
Тест на проверку знаний по теме: «Электризация тел»
Вопрос 1. От какого слова произошло слово электричество»?






