в каком году менделеев открыл периодический закон
Открытие периодического закона Менделеева: дата и суть
Предпосылки открытия закона
В фундаменте собственных работ по систематизации химических элементов Менделеев разместил два ведущих и неизменных признака: атомная масса и свойства элементов. Он расписал на листах все имеющиеся знания об открытых и изученных химических элементах и их соединениях. Сравнивая эти данные, ученый создал естественные ряды химических элементов, похожих по своим свойствам. Сравнение этих элементов друг с другом дало понять, что элементы несхожих групп имеют общие свойства.
Таким образом, Менделеев объединил получившиеся группы химических элементов в одну систему. Объединение позволило обнаружить, что свойства элементов меняются в пределах явных совокупностей линейно (возрастание либо убывание). Вслед за тем время от времени совпадают, то есть через определенное количество элементов появляются похожие.
Химик выявил периоды, где свойства химических элементов и веществ, которые получились из них, подвергаются неизбежному изменению.
Основываясь на этих данных, Менделеев открыл периодический закон, который в соответствии с имеющейся в данный момент терминологией описывается так: «Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс».
Когда появился периодический закон
Открытие периодического закона Менделеевым произошло предположительно 1 марта 1869 г.
Периодический закон и периодическая система элементов химии имеют повторяющуюся неслучайность: кроме известной периодичности по горизонтали (период) имеется также периодичность по вертикали (группа) и по диагонали. В связи с учетом всех этих видов Д. И. Менделеев смог не только предугадать, расписать свойства веществ, которые являлись не открытыми элементами, но и показать ход их появления, земные ресурсы (руда и соединения), из которых были выявлены простейшие вещества.
Суть открытия периодического закона Менделеева заключается в росте атомного веса химических элементов, из-за которого изменения свойств происходят не размеренно, а время от времени.
Публикация периодической таблицы
Менделеев разместил периодическую таблицу всех найденных на тот момент элементов в российском журнале и открыл некоторые новые элементы для завершения таблицы. При появлении системы элементов в немецком журнале Менделеев заявил:
Периодическая таблица химических элементов
Периодическая таблица элементов является отображением открытия периодического закона Менделеева. Каждое число в таблице обозначает некоторую особенность в строении атома:
Причиной периодичности элементов является перемена структуры наружных электронных слоев атома.
Из вышесказанного напрашивается некоторое заключение: свойства химических элементов и полученные из них вещества располагаются в периодической привязанности от структуры наружных электронных слоев атомов.
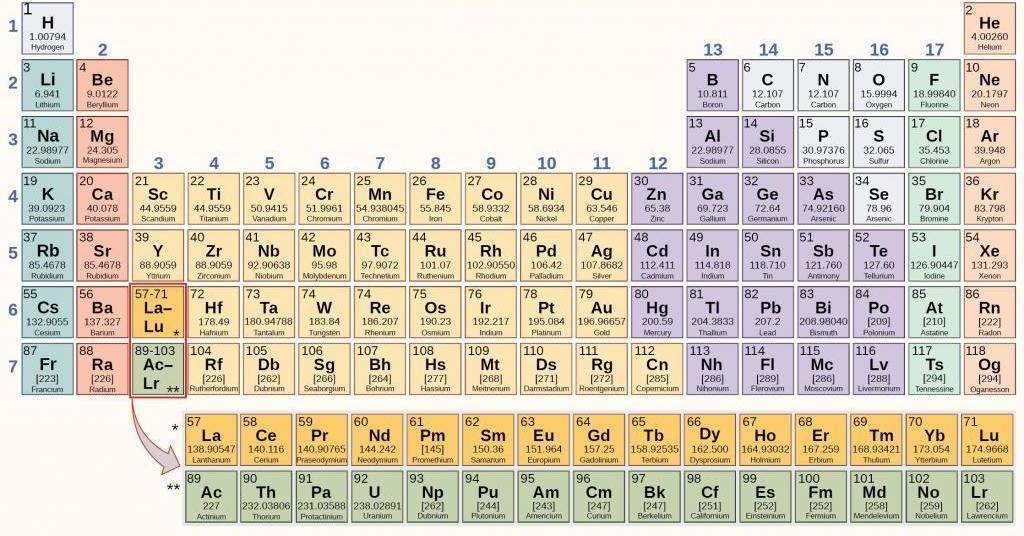
Современная периодическая таблица элементов
На сегодняшний день для группирования элементов возможно использование числа протонов в ядре взамен атомного. В таблице числится 120 элементов, расположенных слева направо в соответствии с увеличением атомного числа.
Столбцы таблицы обозначают собой группы, а строки – это периоды. Таблица включает в себя 18 групп и 8 периодов.
Металлические свойства элементов при перемещении по периоду в правую сторону снижаются, а в обратном – возрастают.
Величина атомов при движении направо продольно периоду уменьшается.
При смещении сверху вниз по группе возрастают восстановительные металлические свойства элементов.
Окислительные и неметаллические свойства при движении по периоду слева направо возрастают.
Заключение
Открытие периодического закона Менделеева дает возможность каждому химику предугадывать с определенной вероятностью свойства любого элемента перед работой с ним. Металлурги используют периодическую систему для изготовления новых сплавов, так как можно заменить один из металлов сплава другим, близким ему по свойствам. Это гарантирует незначительное изменение свойств получившегося сплава.
В каком году менделеев открыл периодический закон
Навигация
История открытия Периодического закона
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.

По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил:
Написав на карточках основные свойства каждого элемента (их в то время было известно 63) Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и с поразительной точностью описал целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году, с синтезом 117 элемента, седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Периодический закон Менделеева, суть и история открытия
Периодический закон Дмитрия Ивановича 
Закон был открыт русским ученым в 1869-м году. Менделеев представил его научному сообществу в докладе съезду Русского химического общества (доклад был сделан другим ученым, так как Менделеев был вынужден срочно выехать по заданию Вольного экономического общества Петербурга). В этом же году вышел учебник «Основы химии», написанный Дмитрием Ивановичем для студентов. В нем ученый описал свойства популярных соединений, а также постарался дать логическую систематизацию химических элементов. Также в нем впервые была представлена таблица с периодически расположенными элементами, как графическая интерпретация периодического закона. Всее последующие годы Менделеев совершенствовал свою таблицу, например, добавил столбец инертных газов, которые были открыты спустя 25 лет.
 |  |  |
| Алюминий гранулированный | Йод кристаллический | Сера молотая |
Научное сообщество далеко не сразу приняло идеи великого русского химика, даже в России. Но после того, как были открыты три новых элемента (галлий в 1875-м, скандий в 1879-м и германий в 1886-м годах), предсказанные и описанные Менделеевым в своем знаменитом докладе, периодический закон был признан.
Периодический закон Менделеева:
История открытия
Есть красивая легенда о том, что свою таблицу Менделеев увидел во сне, а утром проснулся и записал ее. На самом деле, это просто миф. Сам ученый много раз говорил, что созданию и совершенствованию периодической таблицы элементов он посвятил 20 лет своей жизни.
Все началось с того, что Дмитрий Иванович решил написать для студентов учебник по неорганической химии, в котором собирался систематизировать все известные на этот момент знания. И естественно, он опирался на достижения и открытия своих предшественников. Впервые внимание на взаимосвязь атомных весов и свойств элементов обратил немецкий химик Дёберейнер, который попытался разбить известные ему элементы на триады с похожими свойствами и весами, подчиняющимися определенному правилу. В каждой тройке средний элемент имел вес, близкий к среднему арифметическому двух крайних элементов. Ученый смог таким образом образовать пять групп, например, Li–Na–K; Cl–Br–I. Но это были далеко не все известные элементы. К тому же, тройка элементов явно не исчерпывала список элементов с похожими свойствами. Попытки найти общую закономерность позже предпринимали немцы Гмелин и фон Петтенкофер, французы Ж. Дюма и де Шанкуртуа, англичане Ньюлендс и Одлинг. Дальше всех продвинулся немецкий ученый Мейер, который в 1864-м году составил таблицу, очень похожую на таблицу Менделеева, но она содержала лишь 28 элементов, в то время как было известно уже 63.
В отличие от своих предшественников Менделееву удалось 
Менделеев: путь к Закону
Об истории открытия Периодического закона
Первая статья Д. И. Менделеева об этом законе начиналась следующими словами: «Систематическое распределение элементов подвергалось в истории нашей науки многим разнообразным превратностям». Это так. Но об одном Дмитрий Иванович умолчал: проблема «систематического распределения элементов» была для научного сообщества сугубо маргинальной, а то и просто недостойной внимания серьезного ученого. К примеру, когда один из предшественников Менделеева – Джон Ньюлендс – представил Лондонскому химическому обществу свой вариант классификации элементов (так называемый «закон октав»), один из присутствующих заметил: «А не пытался ли он [Ньюлендс] расположить элементы по алфавиту? Ведь любое расположение их может представлять случайные совпадения» (Newlands, 1866, с. 113). Таким образом, Менделеев взялся за тему, которая в то время не только не представлялась актуальной, но и вызывала насмешки. Но он все-таки решил всерьез заняться проблемой классификации элементов

Сам Менделеев вспоминал: «Писать начал, когда стал после Воскресенского читать неорганическую химию в Университете и когда, перебрав все книги, не нашел, что следует рекомендовать студентам. Писать заставляли и многие друзья, напр. Флоринский, Бородин. Писавши, изучил многое» (Архив Д. И. Менделеева. Т. 1, 1951, с. 52). Это – версия Менделеева. Однако был еще один важный стимул, заставивший Дмитрия Ивановича засесть за написание «толстого» учебника, – деньги.
К тому времени он уже начал реконструкцию недавно купленного в Тверской губернии имения Боблово, которое намеревался сделать «образцовым» и проводить там сельскохозяйственные опыты. Кроме того, у него уже была семья – сын, а вскоре должен был родиться и второй ребенок. Гонорар за учебник, который можно было переиздавать, мог стать неплохим дополнительным источником дохода. По словам Менделеева, «так как издавал сам, то получились и средства, а потом эта книга дала мне главный побочный доход – новыми изданиями» (Там же, с. 53). Правда, Дмитрий Иванович забыл упомянуть, что на издание «Основ», причем как на первое, так и на второе, университет назначил ему денежное пособие.
Д. И. Менделеев стоял у истоков российской метрологии. Точности измерения он уделял огромное значение, еще будучи студентом. «Наука начинается с тех пор, как начинают измерять, – считал он. – Точная наука немыслима без меры». Для своих опытов Менделеев или сам проектировал и мастерил приборы, или заказывал их у самых лучших мастеров. «Прототипом всех точных приборов» считал он весы. Точности взвешивания ученый уделял особое внимание, считая этот вид измерений наиболее результативным при проведении исследований
«…Мое сочинение, – писал Менделеев, – не есть учебник: это, скорее, изложение целой совокупности моих воззрений, часть которых вошла потом в мемуары, много раз публиковавшиеся. Сам я, в изложении своих лекций, его не придерживаюсь» (Менделеев, 1876, с. 4).
Первый выпуск «Основ» был опубликован в конце мая или в начале июня 1868 г. Летом этого года он работал уже над вторым выпуском учебника, который был закончен в марте 1869 г. Именно в процессе работы над «Основами» Менделеев открыл Периодический закон.
Первая проба
История открытия Периодического закона и создания Периодической системы сложна и запутана, поэтому дальше я изложу лишь общий путь Менделеева к главному достижению его жизни. Начну со свидетельства самого Дмитрия Ивановича:
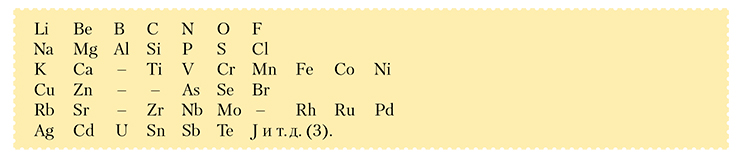
«Первая проба, сделанная в этом отношении, была следующая: я отобрал тела с наименьшим атомным весом и расположил их по порядку величины их атомного веса. При этом оказалось, что существует как бы период свойств простых тел, и даже по атомности элементы следуют друг за другом в порядке арифметической последовательности величины их пая:
Уже при рассмотрении этих легких элементов (с атомными весами от 1 до 40) Менделеев пришел к важным предположениям:
1. «Не выражаются ли свойства элементов в их атомном весе, нельзя ли на нем основать систему?» (Там же, с. 18).
2. При расположении элементов в порядке возрастания их атомных весов наблюдается «как бы период свойств». Тем самым он если и не предложил (пока!) полную формулировку Периодического закона, то, по крайней мере, ухватил его суть – периодический характер изменения свойств элементов с изменением их атомных весов, и все дальнейшие его действия были направлены на проверку этой пока еще гипотезы.
3. Нельзя ли построить систему элементов из структурных блоков следующего вида:
Иными словами, Менделеев решил выстроить систему элементов укладыванием штабелями фрагментов типа (1) так, чтобы атомные веса увеличивались сверху вниз и слева направо.
Джон Ньюлендс (1837–1898) – английский физик и химик. В 1864 г. опубликовал таблицу, в которой расположил все известные элементы в порядке увеличения их атомных весов, используя данные С. Канниццаро. Ньюлендс пронумеровал элементы, сопоставил их номера с их свойствами и, отметив, что элементы с аналогичными свойствами регулярно повторяются, сделал вывод: «Восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке…». Хотя термин «периодичность» он не употреблял, но по сути речь шла именно о периодическом изменении свойств элементов
«Галоиды [галогены] и щелочные металлы, – писал Менделеев в «Основах химии», – составляют в некотором смысле самые крайние по характеру элементы, все прочие элементы или суть металлы, приближающиеся до некоторой степени к щелочным металлам и по способности давать соли и по отсутствию водородных соединений [гидриды металлов тогда еще не были открыты. – И. Д.], но они не столь энергичны, как щелочные металлы. … Наконец, есть еще разряд элементов, таких как углерод и азот [речь идет о простых веществах. – И. Д.], в которых ни металлических, ни галоидных свойств не выражено с резкостью и которые в этом отношении занимают промежуток между двумя вышеупомянутыми разрядами простых тел. Очевидно, что этот род простых тел составляет как раз переход между галоидными элементами и ясно металлическими. … Все это дает возможность распределить элементы между группами щелочных металлов и галоидов» (Менделеев, 1871 [на обл. 1870]. Ч. 2. Вып. 3).
Эти слова показывают, как Менделеев формировал «полюса» будущей системы и чем он предполагал заполнять пространство между ними. Его замысел был замечательным, но реализовать его было непросто, поскольку Дмитрий Иванович столкнулся со следующими трудностями:
– не все элементы были к тому времени известны;
– не для всех открытых элементов были правильно определены атомные веса (и было неясно, какие из них правильные, а какие – нет);
– число элементов в разных фрагментах типа (1) оказывалось различным: между Li и F, как и между Na и Cl, умещалось по пять элементов, тогда как между К и Br надо было разместить не менее 12 известных в то время элементов:
– фрагменты (Li – F) и (Na – Cl) отличались от всех остальных не только числом входящих в них элементов, но и, что важнее, характером «начинки», а также темпом и ритмом изменения свойств простых тел и соответствующих соединений при переходе от щелочного металла к галогену (скажем, в ряду K – Br оказывались такие элементы, химия которых существенно отличалась от химии прямых аналогов);
– существовало два типа аналогий между элементами, и это надо было как-то выразить в системе. На этой последней трудности следует остановиться детальней.
В варианте (2) в первых двух строчках элементы-аналоги стоят друг под другом, что естественно. А в третьей строке As – прямой аналог P, Se – прямой аналог S и Br – прямой аналог Cl оказались где-то в стороне, их потеснили другие элементы. Тогда Менделеев решил длинные строчки «сломать»:
И что? А ничего хорошего. Мало того, что некоторые элементы (скажем, Fe, Co, Ni) вообще «зависли», хуже другое: мышьяк хоть и оказался в одном столбце с фосфором, а селен с серой, но в этих столбцах между элементами-прямыми аналогами затесались «чужаки»: между фосфором и мышьяком – ванадий, между серой и селеном – хром… Ну чем ванадий сходен с фосфором? На первый взгляд, ничем. Но только на первый взгляд. И Менделеев это знал.
Он знал, что «ванадию, судя по исследованиям Роско*, должно быть дано место в ряду азота, его атомный вес (51) заставляет его поместить [в одном столбце] между фосфором и мышьяком. Физические свойства оказываются ведущими к тому же самому определению положения ванадия: так, хлорокись ванадия VOCl3 представляет жидкость, имеющую при 14° удельный вес 1,841 и кипящую при 127°, что и приближает ее, а именно ставит выше соответственного соединения фосфора (т. е. POCl3 – И. Д.)» (Менделеев, 1869, с. 24–26).
* Генри Энфилд Ро́ско – британский химик, один из первых исследователей химии ванадия. – И. Д.
Получается, что если присмотреться, то ванадий и фосфор (равно как хром и сера, хлор и марганец) не совсем «чужие» друг другу элементы. Между ними кое-какое сходство есть, но проявляется оно только в высших соединениях. Например, высшая степень окисления хлора и марганца равна 7 (потом они окажутся в седьмой группе), и соответствующие высшие соединения этих элементов (Cl2O7 и Mn2O7; KClO4 и KMnO4, и т. д.) проявляют сходные свойства. Менделеев об этом знал и до 1869 г. Более того, об этом знали многие химики до него, но оставался вопрос: сходство высших соединений (скажем, кислородных) обусловлено сходством самих элементов, оказавшихся в особом, «предельном» состоянии, или же кислорода в них так много, что он «стирает» различия в природе самих элементов? Для Менделеева это был один из самых трудных вопросов. И ответ на него он искал около года, если не больше.
Итак, вариант системы типа (3), который вполне устраивает нас, для Дмитрия Ивановича в начале 1869 г. был совершенно неприемлем. И главная причина его отказа от этого варианта состояла в отсутствии ясных и строгих критериев объединения в один столбец элементов, как тогда говорили, разных разрядов, или, если использовать современную терминологию, элементов главных и дополнительных подгрупп. При том что Менделеев понимал: свойства элементов определяются не только величиной и весом атома, но и «внутренними различиями материи, входящей в состав атомов», т. е. внутриатомной структурой (Менделеев, 1871 [на обл. 1870]. Ч. 2. Вып. 3). Но это понимание тогда оставалось лишь блестящей догадкой.
Что делать дальше? В ситуации, когда критерии объединения элементов обоих «разрядов» в единую систему были еще не ясны, ему представилось более естественным разъединить элементы разных «разрядов». Именно поэтому, имея в руках вариант системы, по формальным признакам весьма близкий к тому, который впоследствии получил название «естественной системы» и который сейчас можно видеть в школьных и вузовских учебниках, Менделеев отказался размещать элементы «второго разряда» (дополнительных подгрупп) среди элементов первого, поскольку в этом случае «разорвалась бы естественность связи членов одного … ряда» (т. е. членов одной главной подгруппы, как бы мы сегодня сказали) (Менделеев, 1869, с. 26). Менделеев поначалу даже не решился объединить в один столбец Be=9,4; Mg=24; Ca=40; Zn=65; Sn=87; Cd=112 и Ba=137.
Задача объединения элементов разных «разрядов» лишь на первый взгляд может показаться сравнительно несложной. Надо было перегруппировать шестьдесят с лишним элементов, а не просто выбросить треть их из системы. При этом надо было сохранить их расположение в порядке возрастания атомных весов и, по возможности, периодический характер изменения их свойств. Задача осложнялась тем, что Cu, Ag, Zn и Cd Менделеев поначалу относил к элементам первого разряда (т. е. к элементам главных подгрупп).
Может быть, тогда подойдет другая форма, которую потом станут называть «длинной» (или «длиннопериодной»):
Нет, такое расположение элементов Менделеева также не устраивало. Его смущало наличие разрыва в первых двух строках, ибо пустое место внутри естественной системы может служить указанием на существование не открытого еще элемента, а подозревать существование неизвестных элементов между, например, Be и B оснований не было.
После долгих мучений Менделеев создал вариант системы, который с несвойственной ему скромностью назвал «Опытом системы элементов, основанной на их атомном весе и химическом сходстве» (далее сокр. «Опыт»). На рукописном листке с «Опытом» он проставил дату: 17 февраля 1869 г. (по ст. ст.).
Составление «Опыта» и написание статьи «Соотношение свойств с атомным весом элементов» подвели черту под важным этапом работы Менделеева по созданию рациональной систематики элементов.
Теперь он был уверен, что:
– атомный вес является одним из важнейших параметров, определяющих коренные свойства элементов, и потому «распределение элементов по атомному их весу не противоречит естественному сходству, существующему между элементами, а напротив того, прямо на него указывает» (Менделеев, 1869, с. 18–20);
– существующее «между естественными свойствами элементов и величиной их атомного веса» некоторое «точное отношение» имеет периодический характер в том смысле, что «элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств».
Опыт – сын ошибок трудных

Отсюда сложное отношение Менделеева к своему созданию. Включив «Опыт» в первую часть «Основ» и в статью «Соотношение свойств» (не считая отдельных листков с таблицей, отпечатанных для рассылки коллегам), Менделеев больше никогда его не публиковал.
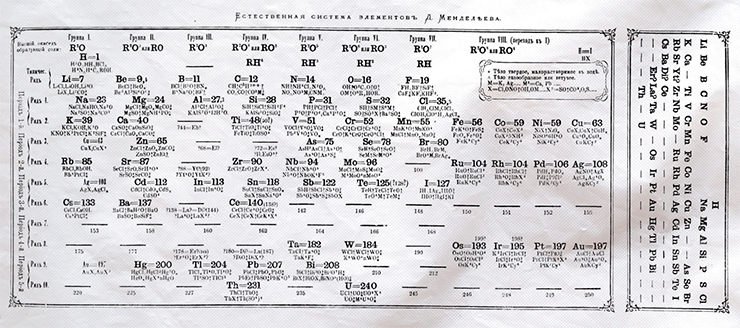
Только в статье «О месте церия в системе элементов», представленной Физико-математическому отделению СПб Академии наук академиком Н. Н. Зининым и адъюнктом А. М. Бутлеровым на заседании 24 ноября 1870 г. и опубликованной на немецком языке в «Бюллетенях» Академии, Менделеев приводит таблицу, озаглавленную просто и кратко «Система элементов» (Mendeleev, 1871). Именно последняя и стала прообразом известной сегодня короткой формы системы, которую Менделеев уже в другой статье назвал «Естественной системой химических элементов» (1870). Графическое выражение Периодического закона, представленное в «Естественной системе», является более совершенным и зрелым. Оно было включено Менделеевым во вторую часть первого издания «Основ химии» (1871).
К концу 1870 г. Дмитрий Иванович понял, что «предельные» (высшие) формы кислородных соединений и их свойства определяются не «самими свойствами кислорода» и не наличием «грани О4», т. е. особо устойчивой группировки из четырех кислородных атомов (например, H2SO4
HMnO4 и т. д.), но «состоянием», т. е., в конечном счете, природой элемента, находящегося в его высших кислородных соединениях.

«Причины, обусловливающие предел соединения двух элементов, могут быть двоякого рода, чисто геометрические и физико-химические. Первые зависят от формы частичек, которая допускает присоединение только известного числа частичек другого тела; вторые, зависящие от химических свойств материи, выражаются по преимуществу количеством теплоты, отделяющейся при соединении. Чем более два элемента при своем соединении могут выделять теплоты, тем они способнее к соединению и тем прочнее происшедшее соединение. Потому мы можем себе представить, что непрочность возможного по аналогии соединения не позволит ему образоваться… Итак, по крайней мере два фактора имеют влияние на предел соединения, а следовательно, и на атомность элементов. А потому естественно, что когда одно условие, по-видимому, постоянное (форма частиц), допускает возможность неизменной атомности, другое, изменяющееся (химическая энергия соединения), своим влиянием изменяет предел, а следовательно, и самое атомность» (Бекетов, 1869, с. 236).
Другое сообщение, которое могло заинтересовать Менделеева, было сделано на том же съезде А. Н. Энгельгардтом. Его идея состояла в том, что деление элементов на металлические и неметаллические относительно, высшие кислородные соединения таких типичных металлов, как марганец и хром, обладают кислотными свойствами, что сближает их с высшими оксидами йода, селена и т. д. А потому, если прав Бекетов, сходство, скажем, перхлората и перманганата калия, как и сходство высших оксидов марганца и хлора, обусловлено не влиянием кислорода, но сходством самих элементов, т. е. близостью их «химической энергии».
«Дмитрий Иванович, пора заняться работать»
Но вернемся к более ранним событиям 1869 г. Менделеев прекрасно понимал значимость сделанного им открытия. Но предстояло еще убедить в этом других, для чего следовало прежде всего познакомить отечественных и, что особенно важно, зарубежных химиков с открытым им законом и созданной на его основе системой элементов. Это было важно и с приоритетной точки зрения.
Как известно, в день создания «Опыта» Менделеев, который «не скучал изучать все ветви сельского хозяйства», должен был ехать в Тверскую губернию обследовать артельные сыроварни Н. В. Верещагина (Архив Д. И. Менделеева, т. 1, с. 58). Открытие Периодического закона вынудило его отложить поездку на 12 дней, чтобы закончить статью «Соотношение свойств с атомным весом элементов». Рукопись он передал Н. А. Меншуткину для публикации в «Журнале Русского химического общества»* и для сообщения о своем открытии на предстоящем заседании РХО. А сам 1 марта (ст. ст.) 1869 г. отправился на сыроварни.
* Н. А. Меншуткин был делопроизводителем и редактором журнала РХО. В1860-х гг. он стал близким другом и помощником Менделеева.
**До сих пор в литературе можно встретить утверждения, будто Менделеев «в марте 1869 года на заседании Русского химического общества … доложил об открытии периодического закона» (см., например: Спектор, 2017, с. 10).
Меншуткин просьбу Менделеева исполнил и 6 марта (ст. ст.) сделал от имени последнего сообщение о Периодическом законе**.Собрания Общества начинались в восемь вечера и обычно продолжались часа два. В тот вечер было заслушано десять докладов, в основном по органической химии. Вряд ли у Меншуткина было более 10 минут на сообщение о системе Менделеева. В протоколе Общества сказано: «За отсутствием Д. Менделеева обсуждение этого сообщения отложено до следующего заседания» (ЖРХО, 1869, с. 35). Следующее собрание состоялось 3 апреля того же года, но вопрос о классификации элементов ни тогда, ни позднее даже не поднимался.
В литературе часто дискутируется вопрос: почему Менделеев сам не выступил с докладом о своем открытии? Ответы давались разные. На мой взгляд, главная причина, по которой Менделеев не решился сам докладывать коллегам о своем открытии, состояла в неразрешенности многих важных вопросов. «Опыт» стал своего рода компромиссным вариантом системы. В 1869 г. физико-химическая часть таксономической задачи – открытие периодического характера зависимости свойств («химической энергии») элементов от их атомных весов – оказалась куда более продвинутой, нежели ее химическая часть – определение критериев объединения в одну группу неполных аналогов, т. е. элементов разных разрядов.

Это отношение с афористической краткостью выразил акад. Н. Н. Зинин: «Дмитрий Иванович, пора заняться работать». Но и игнорировать РХО Менделеев не мог, поскольку то была единственная профессиональная химическая среда в России, объединявшая химиков, работавших в самых разных местах. Именно в журнале Общества естественней всего было публиковать на русском языке статью об открытии закона, для чего необходимо было сделать хотя бы формальное предварительное представление ее на заседании РХО.
Таким образом, Менделеев нашел оптимальный путь презентации своей работы: доклад Н. А. Меншуткина, редактора журнала, от имени автора предстоящей публикации, и без риска излишних словопрений. И только в научно-популярной литературе легковесно-пошловатого толка можно встретить утверждения о том, какое колоссальное впечатление произвело сообщение об открытии Периодического закона на членов РХО.
Вопрос приоритета
Вернувшись из командировки, Менделеев, вероятно, поинтересовался у Меншуткина, как прошло заседание, и тот сообщил, что по сути никакой реакции не было, и решено было вернуться к теме доклада в апреле.

Заметим, что в отпечатанных в марте 1869 г. листках с «Опытом» нет никаких пояснений к приведенной таблице. Тому были свои причины: Менделеев торопился утвердить свой приоритет. В России у него конкурентов не было, но за границей многие занимались классификацией элементов и, что называется, наступали ему на пятки. Если бы он включил в эти листки дополнительную информацию, то для их печати потребовалось бы предварительное цензурное разрешение, что заняло бы время (Дружинин, 2019). А пока статья не вышла из печати, нужно было сделать хоть какой-то шаг для утверждения приоритета.
Заметим, что на беловом варианте «Опыта» Менделеев делает следующую запись: «Бумагу взять такую, по которой можно писать, но тонкую, чтобы было легко [по весу]». Согласно пояснению П. А. Дружинина, «пожелание легкой бумаги имело причину: Менделееву, человеку, умеющему считать деньги, требовалось, чтобы письмо не превышало минимального веса международных писем (15 г с учетом веса конверта и, возможно, сопроводительной записки), поскольку за отправку даже одного такого письма в государства Германского почтового союза в самом дешевом варианте взималось 14 коп. серебром (Там же, с. 118). Как видим, Дмитрий Иванович не желал оплачивать из своего кармана даже дополнительные расходы по утверждению Периодического закона.
Уже в начале апреля 1869 г. французский вариант «Опыта» был опубликован в немецком «Журнале практической химии» (Mendeleeff, 1869).
Разумеется, Менделеев осознавал недостаточность рассылки листков с «Опытом» для получения приоритетных гарантий. Поэтому, как только вышел номер ЖРХО с его статьей о Периодическом законе*, он немедленно, в мае 1869 г., составил ее краткую аннотацию из трех частей: заглавие, таблица («Опыт») и основные выводы. Менделеев предполагал опубликовать этот реферат в немецком ежемесячном полуреферативном журнале Zeitschrift für Chemie, который был основан группой доцентов Гейдельбергского университета.
*Не позднее 8 мая (ст. ст.) 1869 г. (Дружинин, 2019).
Сам Менделеев, изучавший немецкий язык в гимназии и в институте, а затем два года бывший на стажировке в Германии, тем не менее чувствовал себя в немецком неуверенно, особенно когда надо было написать научную статью. Поэтому он воспользовался предложением одного из редакторов этого журнала, Ф. Ф. Бейльштейна, сдавать статьи и рефераты только на русском.
Но Бейльштейн, крайне загруженный работой, отдал реферат Менделеева своему ассистенту по Технологическому институту А. А. Ферману. И тот при переводе первого и ключевого положения реферата – «элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств» – вместо термина «периодичность» использовал термин stufenweise, т. е. ступенчатое (последовательное, постепенное) изменение (Mendeleeff, 1869, с. 405).

Скорее всего, термин «периодический», возвращаюсь в XIX в., переводчик счел не вполне уместным, поскольку в математике периодической называется функция, повторяющая свои значения через некоторый регулярный интервал аргумента. Тогда как в случае системы элементов такого, строго говоря, не наблюдается: через некоторое число элементов (в разных случаях разное) повторяются элементы-аналоги. Иными словами, строгое математическое понимание периодического изменения в случае системы элементов «размывается». В то же время немецкое существительное Stufe имеет значения: ступень; ярус, фаза, стадия; интервал, градация, этап. Видимо, переводчик решил, что речь у Менделеева идет о некотором чередовании свойств элементов, напоминающем чередование лестничных ступенек или театральных ярусов. И нельзя сказать, что такое понимание, при всех его недостатках, полностью извратило суть менделеевского открытия.
Среди химиков и преподавателей химии, особенно отечественных, традиционно было принято различать три понятия: Периодический закон, Периодическая система и Периодическая таблица (иногда две последние отождествляют). Периодический закон – это закон, лежащий в основе систематики элементов и (в формулировке Менделеева) гласящий: «Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости … от их атомного веса». В настоящее время этот закон формулируется несколько иначе (свойства элементов ставятся в периодическую зависимость от заряда ядра), но, тем не менее, он остается важнейшим законом природы.
Периодическая система определяет общие принципы систематизации элементов в соответствии с Периодическим законом, т. е. топологию межэлементных отношений.
Периодическая таблица – это графическое выражение Периодического закона и системы. Как выразился Менделеев, «подобных распределений возможно большее число. Они не изменяют существа системы» и, добавлю, закона. И в настоящее время существует несколько сотен вариантов графического изображения Периодической системы (Mazurs, 1974).
К сожалению, об этих элементарных вещах в настоящее время стали забывать. И это проявилось, к примеру, в том, что 2019 г. стараниями российской научной элиты был объявлен Международным годом Периодической таблицы, но не Периодического закона, что довольно безграмотно как с исторической, так и с химической точки зрения, но хорошо гармонирует с имиджево-бессодержательным характером современной российской культуры.
Архив Д. И. Менделеева. Т. 1. Автобиографические материалы. Сборник документов / Сост. М. Д. Менделеева и Т. С. Кудрявцева. Под общей ред. С. А. Щукарева и С. Н. Валка. Л., 1951. С. 52.
Дружинин П. А. Загадка «Таблицы Менделеева»: История публикации открытия Д. И. Менделеевым Периодического закона. М.: Новое литературное обозрение, 2019. (Серия: История науки). С. 118.
Менделеев Д. И. Соотношение свойств с атомным весом элементов // Менделеев Д. И. Периодический закон. Основные статьи / Редакция, статьи и примечания Б. М. Кедрова. М., 1958.
Gordin M. D. A Well-ordered Thing. Dmitrii Mendeleev and the Shadow of the Periodic Law. New York: Basic Book, 2004. P. 28.