в каком диапазоне находится плотность плазмы крови
Биохимия крови
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД) |
| Книга: | Биохимия крови |
Оглавление
1. Общие сведения
2. свойства крови
3. Состав крови. Гематокрит
3.1. Плазма крови
Пла́зма кро́ви (от греч. πλάσμα — нечто сформированное, образованное) — жидкая часть крови, в которой взвешены форменные элементы — вторая часть крови. Процентное содержание плазмы в крови составляет 52—61 %. Макроскопически представляет собой однородную несколько мутную (иногда почти прозрачную) желтоватую жидкость, собирающуюся в верхней части сосуда с кровью после осаждения форменных элементов. Гистологически плазма является межклеточным веществом жидкой ткани крови.
Центрифуги-сепараторы выделяют из крови плазму. Плазма крови состоит из воды, в которой растворены вещества — белки (7—8 % от массы плазмы) и другие органические и минеральные соединения. Основными белками плазмы являются альбумины — 55—65 %, α1-глобулины — 2—4 %, α2-глобулины 6—12 %, β-глобулины8 — 12 %, γ-глобулины — 2-4 % и фибриноген — 0,2—0,4 %. В плазме крови растворены также питательные вещества (в частности глюкоза и липиды), гормоны, витамины, ферменты и промежуточные и конечные продукты обмена веществ, а также неорганические вещества.
В среднем 1 литр плазмы человека содержит 900—950 г воды, 65—85 г белка и 20 г низкомолекулярных соединений. Плотность плазмы составляет от 1,025 до 1,029, pH — 7,36—7,44.
Существует обширная практика собирания донорской плазмы крови. Плазма отделяется от эритроцитов центрифугированием с помощью специального аппарата, после чего эритроциты возвращаются донору. Этот процесс называется плазмаферезом.
Плазма с высокой концентрацией тромбоцитов (богатая тромбоцитами плазма) находит все большее применение в медицине в качестве стимулятора заживления и регенерации тканей организма. В настоящее время на её основе разработана многофункциональная медицинская методика, используемая в стоматологии и косметологии.
3.2. Форменные элементы
У взрослого человека форменные элементы крови составляют около 40—50 %, а плазма — 50—60 %. Форменные элементы крови представлены эритроцитами, тромбоцитами и лейкоцитами:
Кровь относится к быстро обновляющимся тканям. Физиологическая регенерация форменных элементов крови осуществляется за счёт разрушения старых клеток и образования новых органами кроветворения. Главным из них у человека и других млекопитающих является костный мозг. У человека красный, или кроветворный, костный мозг расположен в основном в тазовых костях и в длинных трубчатых костях. Основным фильтром крови является селезёнка (красная пульпа), осуществляющая в том числе и иммунологический её контроль (белая пульпа).
4. Биохимия эритроцита
4.1. Транспорт кислорода кровью
4.2. Созревание эритроцита
4.3. Структурно-метаболические особенности эритроцита
Особенности структурной организации мембраны эритроцитов
Эритроцит окружен плазматической мембраной, структура которой хорошо изучена, идентична таковой в других клетках. Цитоплазматическая мембрана эритроцитов включает бислой фосфолипидов, в то время как белки или «плавают» на поверхности мембран, или пронизывают липиды, обеспечивая прочность и вязкость мембран. Площадь мембраны одного эритроцита составляет около 140 мкм2.
На долю белков приходится примерно 49 %, липидов – 44 %, углеводов –7 %. Углеводы химически связаны либо с белками, либо с липидами и образуют соответственно гликопротеиды и гликолипиды.
Важнейшими компонентами мембраны эритроцитов являются липиды, включающие до 48 % холестерина, 17-28 % – фосфотидилхолина, 13-25 % – сфингомиелина и ряд других фосфолипидов.
Фосфотидилхолин мембраны эритроцитов несет нейтральный заряд, практически не вступает в реакции взаимодействия с положительно заряженными каналами Са2+,, обеспечивая тем самым атромбогенность эритроцитов. Благодаря таким свойствам, как текучесть, пластичность, эритроциты способны проходить через капилляры диаметром
Белки мембраны эритроцита делят на периферические и интегральные. К периферическим белкам относят спектрин, анкирин, белок 4.1., белок р55, адуцин и др. В группу интегральных белков входит фракция 3, а также гликофорины А, В, С, О, Е. Анкирин образует соединение с р-спектрином. В составе эритроцитов обнаружено около 340 мембранных и 250 растворимых белков.
Пластичность эритроцитов связана с фосфорилированием мембранных белков, особенно белков полосы 4.1.
Белок фракции 4.2. – паллидин обеспечивает связывание спектрин-актин-анкиринового комплекса с фракцией 3, относится к группе трансглутаминазных протеинов.
К числу сократительных белков мембраны эритроцитов относятся р-актин, тропомодулин, строматин и тропомиозин.
Гликофорины – интегральные белки мембраны эритроцитов, определяющие отрицательный заряд, способствующий отталкиванию эритроцитов друг от друг и от эндотелия сосуда.
Протеин 3 – основной белок актинов, регулирующий дефосфорилируемость эритроцита.
Как указывалось выше, мембрана эритроцита представляет собой сложный комплекс, включающий определенным образом организованные липиды, белки и углеводы, которые формируют наружный, средний и внутренний слои эритроцитарной мембраны.
Касаясь пространственного расположения различных химических компонентов эритроцитарной мембраны, следует отметить, что наружный слой образован гликопротеидами с разветвленными комплексами олигосахаридов, которые являются концевыми отделами групповых антигенов крови. Липидным компонентом наружного слоя являются фосфатидилхолин, сфингомиелин и неэстерифицированный холестерин. Липиды наружного слоя мембраны эритроцита играют важную роль в обеспечении постоянства структуры мембраны, избирательности ее проницаемости для различных субстратов и ионов. Вместе с фосфолипидами холестерин регулирует активность мембранно-связанных ферментов путем изменения вязкости мембраны, а также участвует в модификации вторичной структуры ферментов. Молярное отношение холестерин / фосфолипиды в мембранах клеток у человека и многих млекопитающих равно 0,9. Изменение этого соотношения в сторону увеличения наблюдается в пожилом возрасте, а также при некоторых заболеваниях, связанных с нарушением холестеринового обмена.
Снижение текучести мембраны эритроцита и изменение ее свойств отмечается также и при увеличении содержания сфингомиелина,
Средний бислой мембраны эритроцита представлен гидрофобными «хвостами» полярных липидов. Липидный бислой обладает выраженной текучестью, которая обеспечивается определенным соотношением между насыщенными и ненасыщенными жирными кислотами гидрофобной части бислоя. Интегральные белки, к которым относятся ферменты, рецепторы, транспортные белки, обладают активностью только в том случае, если находятся в гидрофобной части бислоя, где они приобретают необходимую для активности пространственную конфигурацию. Поэтому любые изменения в составе липидов эритроцитарной мембраны сопровождаются изменением ее текучести и нарушением работы интегральных белков.
Внутренний слой мембраны эритроцита, обращенный к цитоплазме, состоит из белков спектрина и актина. Спектрин является специфическим белком эритроцитов, его гибкие вытянутые молекулы, связываясь с микрофиламентами актина и липидами внутренней поверхности мембраны, формируют своеобразный скелет эритроцита. Небольшой процент липидов во внутреннем слое мембраны эритроцита представлен фосфатидилэтаноламином и фосфатидилсерином. От наличия спектрина зависит подвижность белков, удерживающих двойной бисой липидов.
Одним из важных гликопротеинов является гликофорин, содержащийся как на внешней, так и на внутренней поверхностях мембран эритроцитов. Гликофорин в своем составе содержит большое количество сиаловой кислоты и обладает значительным отрицательным зарядом. В мембране он располагается неравномерно, образует выступающие из мембраны участки, которые являются носителями иммунологических детерминант.
Строение и состояние эритроцитарной мембраны, низкая вязкость нормального гемоглобина обеспечивают значительные пластические свойства эритроцитам, благодаря которым эритроцит легко проходит по капиллярам, имеющим вдвое меньший диаметр, чем сама клетка, и может принимать самые разнообразные формы. Другим периферическим мембранным белком эритроцитов является анкирин, образующий соединение с молекулой Р-спектрина.
Функции эритроцитарной мембраны
Мембрана эритроцитов обеспечивает регуляцию электролитного баланса клетки за счет активного энергозависимого транспорта электролитов или пассивной диффузии соединений по осмотическому градиенту.
В мембране эритроцитов имеются ионно-проницаемые каналы для катионов Na+, K+, для O2, CO2, Cl– HCO3–.
Транспорт электролитов через эритроцитарную мембрану и поддержание его мембранного потенциала обеспечивается энергозависимыми Na+, K+, Ca2+ – АТФ-азными системами.
Мембрана эритроцитов хорошо проницаема для воды при участии так называемых белковых и липидных путей, а также анионов, газообразных соединений и плохо проницаема для одновалентных катионов калия и натрия.
Белковый путь трансмембранного переноса воды обеспечивается при участии пронизывающего мембрану эритроцитов белка «полосы 3», а также гликофорина.
Молекулярная природа липидного пути переноса воды через эритроцитарную мембрану практически не изучена. Прохождение молекул небольших гидрофильных неэлектролитов через эритроцитарную мембрану осуществляется также, как и перенос воды, за счет белкового и липидного путей. Перенос мочевины и глицерина через мембрану эритроцита обеспечивается за счет ферментативных реакций.
Перенос органических анионов через эритроцитарную мембрану обеспечивается, как и транспорт неорганических анионов, при участии белка «полосы 3».
Эритроцитарная мембрана обеспечивает активный транспорт глюкозы, кинетика которого обеспечивается зависимостью Михаэлиса-Ментен. Важная роль в транспорте глюкозы через эритроцитарную мембрану отводится полипептиду полосы 4,5 (белки с ММ 55 кД – возможные продукты распада полипептида полосы 3). Высказывается предположение о наличии специфического липидного окружения у белков – переносчиков сахаров в эритроцитарной мембране.
Неравномерное распределение моновалентных катионов в системе эритроцит – плазма крови поддерживается при участии энергозависимой Na+-помпы, осуществляющей трансмембранный обмен ионов Na+ эритроцитов на ионы К+ плазмы крови в соотношении 3:2. Кроме указанного трансмембранного обмена Na+/K+, Na+ помпа осуществляет еще, по крайней мере, четыре транспортных процесса: Na+→ Na+ обмен; K+→K+обмен; одновалентный вход ионов Na+, сопряженный с выходом К+.
Молекулярной основой Na+ помпы является фермент Na+, K+ –АТФ-аза – интегральный белок, прочно связанный с мембранными липидами, состоящий из 2х полипептидных субъединиц с ММ 80-100кД.
Транспортная система имеет 3 центра, связывающих ионов Na+, локализованных на цитоплазматической стороне мембраны. С наружной стороны мембраны на транспортной системе имеется 2 центра связывания ионов К+. Важная роль в поддержании высокой активности фермента отводится мембранным фосфолипидам.
Функционирование Са2+-помпы обеспечивается нуклеотидами, а также макроэргическими соединениями, преимущественно АТФ, ЦТФ, ГТФ, в меньшей степени ГТФ и ЦТФ.
Как в случае Nа+-помпы, функционирование Са2+помпы в эритроцитах связано с проявлениями активности Са2+, Mg2+ –АТФ-азы. В мембране одного эритроцита обнаруживается около 700 молекул Са2+, Mg2+ –АТФ-азы.
Наряду с барьерной и транспортной функциями, мембрана эритроцитов выполняет рецепторную функцию.
Экспериментально доказано наличие на мембране эритроцитов рецепторов к инсулину, эндотелину, церулоплазмину, а2-макроглобулину, α- и β-адренорецепторов. На поверхности эритроцитов находятся рецепторы к фибриногену, обладающие достаточно высокой специфичностью. Эритроциты также несут на мембране рецепторы к гистамину, ТхА2, простациклину.
В мембране эритроцитов обнаруживаются рецепторы для катехоламинов, снижающих подвижность жирных кислот липидов мембран эритроцитов, а также осмотическую устойчивость эритроцитов.
Установлена перестройка структуры мембраны эритроцитов под влиянием низких концентраций инсулина, гормона роста человека, простагландинов группы Е и Е2.
В мембранах эритроцитов высока и ц – АМФ активность. При увеличении концентраций в эритроцитах ц–АМФ ( до 10–6 М) усиливаются процессы фосфорилирования белков, что приводит в свою очередь к изменению степени фосфорилированности и проницаемости мембран эритроцитов для ионов Са2+.
Эритроцитарная мембрана содержит изоантигены различных систем иммунологических реакций, определяющих групповую принадлежность крови человека по этим системам.
4.4. Антигенная структура эритроцитарной мембраны
Эритроцитарная мембрана содержит различные антигены видовой, групповой и индивидуальной специфичности. Различают два вида изоантигенов эритроцитов, определяющих групповую специфичность крови человек – А и В агглютиногены. Соответственно в плазме или сыворотке крови обнаруживаются две разновидности изоантител – агглютинины α и β. В крови человека не содержатся одноименных агглютиногенов и агглютининов. Их встреча и взаимодействие может возникать при переливании несовместимых групп крови, приводить к развитию агглютинации и гемолиза эритроцитов.
Как известно, I (0) группа крови характеризуется отсутствием в эритроцитах агглютиногенов А и В при наличии в плазме или сыворотке крови агглютининов α и β, встречается у 40-50 % людей стран центральной Европы.
II (А) группа крови характеризуется наличием в мембране эритроцитов агглютиногена А, в то время как в плазме крови содержатся агглютинины β. Указанная группа крови распространена у 30–40 % людей.
III (В) группа крови характеризуется наличием агглютиногена В в мембране эритроцитов, а в плазме или сыворотке крови – наличием агглютининов типа α. Эта группа крови имеет место примерно у 10 % населения.
IV (АВ) группа крови характеризуется наличием в мембране эритроцитов фиксированных А и В агглютиногенов, при этом в плазме или сыворотке крови отсутствуют естественные агглютинины α и β. Данная группа крови встречается у 6 % населения.
Генетический контроль антигенной системы А,В,О мембран эритроцитов представлен генами О, Н, А, В, локализованными в длинном плече 9-й пары хромосом.
Агглютинины α и β относятся к классу Ig M, являются естественными антителами, образуются у ребенка на первом году жизни, достигая максимума к 8 – 10 годам.
Второе место среди антигенных свойств мембран эритроцитов по клинической значимости занимает система Rh – Hr. Впервые Резус-фактор был открыт в 1940 году К. Ландштейнером и А. Винером, содержится в эритроцитах у 85 % людей белой расы. У 15 % людей эти эритроцитарные антигены отсутствуют. В настоящее время установлена липопротеидная природа антигенов данной системы, их насчитывается около 20, они образуют различные комбинации в мембране эритроцитов. Наиболее распространенными резусантигенами являются 6 разновидностей: Rh0 (D), rh’ (C), rh’’ (E), Hr0 (d), hr’ (c), hr’’ (e). Наиболее сильным антигеном этой группы является Rh0 (D).
Антитела системы Rh и Hr – антирезусагглютинины являются приобретенными, иммунными, отсутствуют в крови Rh (-) людей с момента рождения, синтезируются при первом переливании Rh (+) крови Rh (-) реципиенту, а также при первой беременности Rh (-) женщины Rh(+) плодом. При первой беременности эти антитела синтезируются медленно в течение нескольких месяцев в небольшом титре, не вызывая серьезных осложнений у матери и плода. При повторном контакте резус-отрицательного человека с резус-положительными эритроцитами возможен резус-конфликт. Антитела системы Rh – Hr относятся к классу Ig G, поэтому они легко проникают через плацентарный барьер, вызывают реакции агглютинации и гемолиза эритроцитов плода, что сопровождается развитием гемолитической желтухи новорожденных. В случае повторного переливания несовместимой по Rh–антигенам крови донора и реципиента может наблюдаться гемотрансфузионный шок.
Кровь / Blood (часть 2 из 8)
(Продолжение. Начало см. тут)
Плазма крови
Blood Plasma
В 1 л плазмы человека содержится 900-910 г воды, 65-80 г белка и 20 г низкомолекулярных соединений.
Удельная масса плазмы равна 1,025-1,029, а ее pH незначительно колеблется в пределах 7,37-7,43, составляя в среднем (в артериальной крови) около 7,4.
A liter of human plasma contains 900-910 g of water, 65-80 g of protein, and 20 g of substances of low molecular weight.
Рис. 1. Схема жидкостных пространств организма.
Представлены округленные значения для человека массой 70 кг
The volumes are indicated in round figures, for a person
weighing 70 kg.
На рис. 1 схематически показаны три основных водных пространства организма — внутрисосудистое, интерстициальное (межклеточное) и внутриклеточное.
Интерстициальная жидкость служит внешней средой для большинства клеток организма.
Обмен веществами между плазмой крови и интерстициальной жидкостью происходит через обширную поверхность стенок капилляров, высокопроницаемых для воды и ионов.
Fig. 1 is a diagram of the three great fluid compartments in the body, the blood-vascular system, the interstitial space (the spaces between cells) and the intracellular space.
The interstitial fluid constitutes the environment of the mass of cells in the body.
By way of the large surface of the capillary walls (highly permeable to water and electrolytes) it exchanges substances with the plasma.
Обмен водой и небольшими молекулами между плазмой и интерстициальной жидкостью происходит очень быстро, поэтому состав последней, несмотря на существенные изменения в поглощении и выделении различных веществ клетками, колеблется незначительно.
Так, в опытах с тяжелой водой D2O (меченной дейтерием) было показано, что более 70% всей жидкости плазмы обменивается с интерстициальным пространством за 1 мин.
Because the exchange of water and small molecules between plasma and interstitial space is very rapid, the range within which the composition of the interstitial fluid can vary is small despite the considerable variations in uptake and release of substances by the cells.
For example, experiments with heavy water (deuterium-labelled, D2O) have shown that over 70% of the plasma fluid is exchanged with the interstitial fluid in one minute.
Электролиты плазмы
Plasma Electrolytes
Содержание электролитов.
В табл. 1 и на рис. 2 приведены данные по ионному составу плазмы крови.
К группе «органических кислот» относят молочную, лимонную и пировиноградную кислоты, а также аминокислоты.
Electrolyte concentrations.
Table 1 and Fig. 2 summarize the ionic composition of plasma.
Among the substances in the group called simply “organic acids” are lactic acid, the amino acids, citric acid and pyruvic acid.
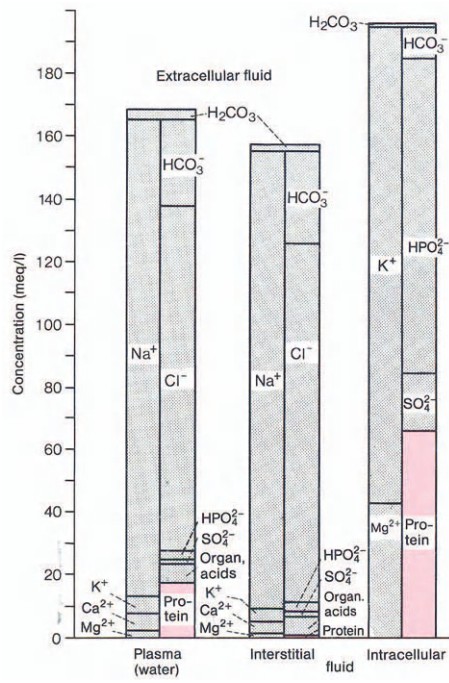
fluid, and intracellular fluid.
Концентрации веществ удобнее выражать не в единицах отношения массы к объему (г/дл или мг/дл), а в молях на литр (молярность), эквивалентах на литр (нормальность, или эквивалентная концентрация) [экв/л — = моль/(валентность • л)].
В случае если частицы растворенного вещества занимают в растворе существенное пространство и необходимо учитывать уменьшение за счет этого объема раствора, его концентрацию часто выражают в молях на килограмм растворителя (молильностъ) (см. табл. 1).
It is preferable no longer to give concentration as w/v ratio (g/dl or mg/dl) but rather in terms of molarity (mol/liter) and normality or equivalent concentration (eq/liter = mol/valence • liter).
When it is necessary to allow for the reduced volume of solvent in a solution in which the dissolved particles require a great deal of space, molality (mol/kg solvent) is often used as a measure of concentration (see Table 1).

Таблица 1. Среднее содержание электролитов и неэлектролитов в плазме крови человека
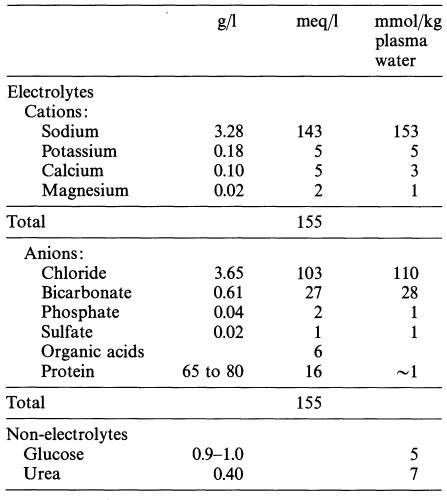
Table 1. Average concentrations of electrolytes and
nonelectrolytes in human plasma
Осмотическое давление.
Osmotic pressure.
Концентрация растворенных в плазме веществ может быть выражена как осмотическое давление.
Растворы, осмотическое давление которых такое же, как у плазмы, называют изотоническими, растворы с большим осмотическим давлением — гипертоническими, а с меньшим — гипотоническими.
The concentration of dissolved substances in the plasma can be expressed by the osmotic pressure.
That of normal plasma is about 7.3 atm (5,600 mm Hg = 745 kPa), which corresponds to a freezing-point depression of — 0.54°C.
Solutions with the same osmotic pressure as plasma are called isotonic, and by the same convention hypertonic solutions have higher, and hypotonic solutions lower osmotic pressure.
Плазма изотонична по отношению к раствору неэлектролита, молярность которого составляет всего 1/3.
Около 96% осмотического давления крови обусловлено присутствием неорганических электролитов, в основном NaCl;
давление, обусловленное данными веществами, называют кристаллоидно-осмотическим.
Молекулярная масса NaCl низка, поэтому на единицу массы этого вещества приходится много молекул.
Plasma is isotonic with a barely 1/3 molal solution of a nonelectrolyte.
96% of the osmotic pressure of blood is due to the presence of inorganic electrolytes, mainly sodium chloride (crystalloid osmotic pressure).
The molecular weight of NaCl is low, so that there are many molecules per unit weight.
Регуляция осмотического давления плазмы имеет первостепенное значение для постоянства внутренней среды организма, или гомеостаза.
Любое отклонение осмотического давления жидкостей внеклеточного пространства (плазмы крови и интерстициальной жидкости) от нормальных величин приводит к перераспределению воды между клетками и окружающей их средой.
Constancy of the internal milieu, or homeostasis, depends critically on regulation of the osmotic pressure of the plasma.
Any departure from the normal extracellular osmotic pressure (plasma and interstitial fluid) causes a redistribution of water between the cells and their surroundings.
отек).Значительное увеличение объема клеток может привести к разрыву их мембран (осмотический гемолиз эритроцитов).
Hypotonicity of the extracellular fluid causes influx of water into the cells and hence swelling (cellular edema).
Great increases in volume can destroy the cell membrane (osmotic hemolysis of erythrocytes).
В гипертонической среде, напротив, клетки теряют воду и сжимаются, что означает потерю тканями нормального тургора.
В обоих случаях жизнедеятельность клеток в той или иной степени нарушается.
Hypertonicity, on the other hand, causes the cells to lose water and shrink, so that the normal tissue turgor is lost.
In both cases the ability of the cells to function is more or less severely impaired.
Функции электролитов плазмы.
Functions of the plasma electrolytes.
Изотоничность среды — одно из основных условий поддержания жизнедеятельности изолированной переживающей ткани.
В то же время для сохранения клеточных функций этого условия недостаточно:
необходимо также, чтобы различные ионы присутствовали в определенном соотношении.
Isotonicity of the suspension medium is one of the fundamental requirements for the maintenance of function in isolated, surviving tissue.
In itself, however, it does not suffice to preserve cell function;
the various ions must be present in suitable proportions.
В табл. 2 приведены составы некоторых физиологических солевых растворов, успешно применяющихся в качестве сред для тканей in vitro.
Хотя различные влияния тех или иных ионов известны давно, механизмы, лежащие в основе этих влияний, до конца не ясны.
Table 2 gives the composition of some “balanced” saline solutions which have proved useful as suspension media for living tissue in vitro.
Although the different actions of the various ionic species have long been known, the mechanisms underlying these effects are not understood in all details.
Таблица 2. Состав наиболее распространенных физиологических растворов.
Содержание различных ионов указано в мзкв/л
Table 2. Composition of some commonly used suspension media.
The numbers indicate the concentration (meq/l) of each ion.
Белки плазмы
Plasma Proteins
Общие свойства и функции.
General properties and functions.
Высокая относительная вязкость плазмы (1,9-2,8 при относительной вязкости воды, равной 1) почти целиком обусловлена белками, содержание которых составляет 65-80 г/л.
В связи с высокой молекулярной массой белков их моляльная концентрация весьма невелика — всего лишь около 1 ммоль/кг (см. табл. 1).
Белковая фракция плазмы представляет собой смесь многих белков.
The high relative viscosity of plasma, 1.9-2.6 (water = 1), is almost entirely due to its protein content, 65-80.
The protein fraction of plasma is a mixture of many individually identifiable proteins.
some plasma proteins and of hemoglobin.
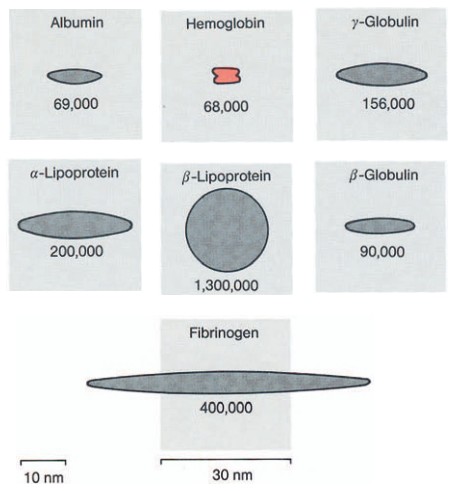
Молекулярные массы белков плазмы варьируют от 44000 до 1300000.
Частицы таких размеров относятся к коллоидам (рис. 3).
Белки плазмы крови выполняют ряд функций.
Their molecular weights range from 44,000 to 1,300,000.
Particles of this order of magnitude are classified as colloids (Fig.3)
The plasma proteins function in a number of different ways.
1. Питание.
1. Nutrition.
В организме взрослого человека содержится около 3 л плазмы, в которой растворено примерно 200 г белка.
Это вполне достаточный запас питательных веществ.
Обычно клетки поглощают не белки, а их компоненты — аминокислоты;
однако некоторые клетки, в частности относящиеся к ретикулоэндотелиальной системе (РЭС), могут поглощать белки плазмы и расщеплять их при помощи собственных внутриклеточных ферментов.
Высвобождающиеся при этом аминокислоты поступают в кровь, где сразу же могут использоваться другими клетками для синтеза новых белков.
The approximately 3 liters of plasma in an adult’s body carry about 200 g of protein in solution, a convenient reserve supply.
In general the cells of the body take up not proteins but rather their components, the amino acids;
however, certain cells — especially those of the reticuloendothelial system (RES) — can take in whole plasma proteins and break them down by means of intracellular enzymes.
The amino acids thus produced diffuse into the blood and are immediately available to other cells for the synthesis of new protein.
2. Транспорт.
2. Transport.
Многие небольшие молекулы в процессе переноса их от кишечника или депо к месту потребления связываются со специфическими белками плазмы.
Благодаря большой площади поверхности и наличию многочисленных гидрофильных и липофильных участков эти белки особенно пригодны для роли переносчиков.
Many small molecules are bound to specific plasma proteins during transport from the intestine or storage organs to the places where they are needed.
The large surface area of these proteins, with numerous hydrophilic and lipophilic attachment sites, makes them especially suitable to serve as ve hicles.
За счет связывания их липофильных групп с жироподобными нерастворимыми в воде соединениями белки могут удерживать такие вещества в растворе.
Белки плазмы участвуют также в поддержании постоянного осмотического давления, так как способны связывать большое количество циркулирующих в крови низкомолекулярных соединений.
By binding of their lipophilic groups to water-insoluble fat-like substances they can hold these substances in solution.
Their ability to bind a large number of low-molecular-weight substances during their transport in the bloodstream also assists in maintaining a constant osmotic pressure.
3. Белки плазмы как неспецифические переносчики.
3. Unspecific carrier function.
Все белки плазмы связывают катионы крови, переводя их в недиффундирующую форму.
Так, около 2/3 кальция плазмы неспецифически связано с белками.
Этот связанный кальций находится в равновесии с физиологически активным кальцием, присутствующим в крови в виде свободных ионов.
Связывание кальция белками зависит от pH: при повышении последнего (алкалоз) связывание кальция усиливается.
All the plasma proteins bind blood cations in a non-diffusible form.
For example, about 2/3 of the calcium present in plasma is unspecifically bound to proteins.
This bound calcium is in equilibrium with the physiologically effective, ionized calcium freely dissolved in the blood.
The binding of calcium is pH-dependent, being enhanced at high pH (alkalosis).
4. Роль белков в создании коллоидно-осмотического давления.
3. Production of colloid osmotic pressure.
Вследствие низкой молекулярной концентрации белков вклад их в общее осмотическое давление плазмы крови весьма невелик,
но тем не менее создаваемое ими коллоидно-осмотическое (онкотическое) давление играет важную роль в регуляции распределения воды между плазмой и межклеточной жидкостью.
В связи с тем что стенки капилляров в общем свободно пропускают небольшие молекулы, концентрация этих молекул и создаваемое ими осмотическое давление в плазме и в межклеточной жидкости примерно одинаковы.
The contribution of the proteins to the total osmotic pressure of the plasma is very small, because of their low molecular concentration.
Nevertheless, the colloid osmotic (oncotic) pressure plays an important role in regulating the distribution of water between plasma and interstitial fluid.
Because the capillary membranes are essentially freely permeable to small molecules, the concentration of these molecules — and thus the osmotic pressure associated with them — is approximately the same in the two fluids.
Что же касается белков плазмы, то их крупные молекулы лишь с большим трудом проходят через стенки капилляров (так, период полувыведения меченого альбумина из кровотока равен приблизительно 14 ч).
Благодаря этой особенности, а также тому, что белки поглощаются клетками и переносятся лимфой, между плазмой и межклеточной жидкостью создается градиент концентрации белков:
онкотическое давление плазмы равно примерно 25 мм. рт. ст. (3,3 кПа), а межклеточной жидкости — примерно 5 мм рт. ст.(0,7 кПа);
разница между ними соответственно составляет около 20 мм рт. ст. (2,7 кПа).
But the plasma-protein molecules are so large that they encounter a relatively large resistance in passing through the capillary wall (for example, isotope-labelled albumin leaves the bloodstream with a half-time of about 14 hours).
This effect, combined with the removal of protein by uptake into cells and transport through the lymph, brings about a protein concentration gradient between plasma and interstitial fluid;
the colloid osmotic pressure in the plasma is ca. 25 mm Hg (3.3 kPa) and that in the interstitial fluid is ca. 5 mm Hg (0.7 kPa),
giving a difference of ca. 20 mm Hg (2.7 kPa).
Любое изменение осмотически эффективной концентрации белков плазмы крови приводит к нарушению обмена веществами и распределения воды между кровью и межклеточной жидкостью.
Поскольку альбумин составляет самую большую фракцию белков плазмы (молекула альбумина относительно невелика, и его моляльная концентрация примерно в 6 раз больше, чем всех других белков плазмы), сдвиги в содержании альбумина особенно сильно влияют на коллоидно-осмотическое давление.
Any change in the osmotically effective concentration of plasma protein disturbs the exchange of substances and the distribution of water between blood and interstitial fluid.
Because albumin represents the largest fraction of the plasma protein (a relatively small molecule, its molal concentration is about 6 times higher than that of all the other plasma proteins), changes in albumin concentration have an especially pronounced effect on colloid osmotic pressure.
Снижение концентрации альбумина в плазме часто приводит к задержке воды в межклеточном пространстве (интерстициальный отек).
В связи с этим искусственные кровезаменители, как правило, должны обладать тем же онкотическим (и кристаллоидно-осмотическим) давлением, что и плазма.
В качестве коллоидов в таких растворах часто используют полисахариды (гидроксиэтилкрахмал, декстран) и полипептиды (желатину), так как получение в чистом виде белков плазмы крови человека — очень дорогостоящая процедура.
Reduction of the plasma albumin concentration often leads to retention of water in the interstitial space (interstitial edema).
Therefore artificial plasma solutions in general should have the same colloid (and crystalloid) osmotic pressure as the plasma.
Polysaccharides (hydroxyethyl starch, dextran) and polypeptides (gelatine) are usually used as the colloids, because it is very expensive to extract human blood proteins in pure form.
5. Буферная функция.
5. Buffer function.
6. Предупреждение кровопотери.
6. Protection against loss of blood.
Свертывание крови, препятствующее кровотечению, частично обусловлено наличием в плазме фибриногена.
Процесс свертывания включает целую цепь реакций (в которых в качестве ферментов участвует ряд белков плазмы) и заканчивается превращением растворенного в плазме фибриногена в сеть из молекул фибрина, образующую сгусток.
The coagulability of blood, which interferes with bleeding, is based in part on the fibrinogen content of the plasma.
The process involves a chain of reactions in which a number of blood proteins that act as enzymes cooperate, terminated by the conversion of dissolved fibrinogen into the fibrin meshwork of which the clot is composed.
Разделение белков плазмы.
Fractionation of plasma proteins.
Качественное и количественное определение белков плазмы крови широко вошло в повседневную практику (рис. 4).
Электрофорез белков плазмы служит важным методом клинической диагностики, так как многие заболевания сопровождаются характерными изменениями в составе этих белков.
Qualitative and quantitative analyses of the plasma proteins are carried out routinely (Fig. 4).
Protein electrophoresis is an important diagnostic aid, for many diseases involve characteristic changes in the plasma-protein spectrum.
Рис. 4. Электрофореграмма сыворотки крови человека.
Окрашенные полосы на бумажной ленте (Б) соответствуют зубцам на фотометрической кривой, отражающим указанное процентное содержание фракций разных белков.
А. Схема прибора для электрофореза на бумаге
Fig 4. Electropherogram of human serum.
The stained bands on the paper strip (bottom) correspond to peaks in the photometric curve, which represent the indicated percentages of the various protein fractions.
Top: diagram of the apparatus for paper electrophoresis
Электрофорезом называется движение электрически заряженных частиц, находящихся во взвешенном состоянии или растворенных в жидкой среде, по градиенту напряжения.
Молекулы белков построены из аминокислотных остатков, соединенных пептидными связями.
Electrophoresis is the migration of electrically charged particles, dissolved or suspended in a fluid, along a voltage gradient.
Protein molecules are built up of single amino acids joined together by peptide bonds.
Электролитические свойства этих молекул частично обусловлены ионизацией аминогрупп (— NH2) и карбоксильных (—СООН) групп, особенно тех, что расположены на концах боковых цепей.
Такие группы электрически заряжены в соответствии с pH раствора (—NH3 + или —СОО — ).
Для буферной функции белков еще важнее рН-зависимые имидазольные группы остатка гистидина одного из главных компонентов молекулы гемоглобина.
especially when these are present in side chains, they are electrically charged in accordance with the pH of the solvent (—NH3 + or —COO — ). As far as the buffering action is concerned, the pH-dependent imidazole groups of the amino acid histidine (a major component of the hemoglobin molecule) are even more significant.
Электрофоретическая подвижность белка зависит в основном от приложенного напряжения, размеров и формы молекулы и ее электрического заряда, который в свою очередь определяется разницей между значениями изоэлектрической точки (ИТ) для данного белка и pH раствора.
Как видно из табл. 3, ИТ различных белков плазмы на ту или иную величину ниже 7.
The electrophoretic mobility of a protein is basically a function of the applied voltage, the size and shape of the molecule, and its electric charge, which depends on the difference between its isoelectric point (IP) and the pH of the solution.
As can be seen in Table 3, the IPs of the different plasma proteins are below pH 7 by varying amounts.


Для того чтобы не только разделить белки, но также определить их молекулярные массы, применяют метод ультрацентрифугирования.
На ультрацентрифуге Сведберга можно получить ускорение от 100 000 до 750 000 g.
При данном ускорении скорость оседания молекул зависит от их удельной массы и формы (рис. 3) и плотности среды.
Особенно хорошо белковые компоненты в какой-либо смеси можно разделить методом центрифугирования в градиенте плотности, так как при этом каждый из компонентов занимает в пробирке определенный уровень.
For a given centrifugal force, the rate of sedimentation depends on the specific weight and the shape of the molecule (Fig. 3) and on the density of the suspension medium.
In density-gradient centrifugation the protein components of a mixture can be especially well separated, for each becomes concentrated at a particular level in the tube.
Еще более тонким способом разделения белков служит электрофорез в сочетании с иммунопреципитапией (иммуноэлектрофорез).
При этом исследовании электрофоретически разделенные белковые фракции диффундируют в геле по направлению к капле внесенной в него сыворотки.
Когда белковый антиген достигает сыворотки, происходит осаждение антител — в геле появляется беловатая полоса мутности.
При помощи этого метода было показано, что электрофоретически однородные белковые фракции могут состоять из нескольких белков, различающихся по иммунологическим свойствам (табл. 3).
A still more refined separation of plasma proteins can be achieved with a combination of electrophoresis and immunoprecipitation.
In this procedure, immunoelectrophoresis, electrophoretically separated protein fractions are allowed to diffuse within a gel into a drop of antibody-containing serum.
When the protein antigen encounters the serum, antibody precipitation occurs, and is evident as a whitish zone of turbidity in the gel.
In this way it has been shown that electrophoretically uniform protein fractions can consist of several immunologically distinguishable proteins (cf. Table 3).
Свойства и функции отдельных белковых фракций.
Properties and functions of individual fractions.
Поскольку чаще всего для разделения белков используют электрофорез, в дальнейшем будут обсуждаться лишь белковые фракции, выделяемые этим методом.
На рис. 3 схематично показаны относительные размеры и форма основных белков плазмы.
Because electrophoresis is the analytical procedure most commonly used, discussion will be restricted to the components distinguishable by this method.
Fig. 3 shows diagrammatically the size relationships and the shapes of the most important plasma proteins.
Около 60% общего белка плазмы приходится на долю альбумина, содержание которого составляет 35-45 г/л.
Молекулярная масса альбумина — одного из самых низкомолекулярных белков плазмы — равна 69000.
Поскольку концентрация альбумина высока, а размеры его молекулы невелики, этот белок на 80% определяет коллоидно-осмотическое давление плазмы.
With a molecular weight of 69,000, it is one of the smallest proteins in the plasma.
Because of its relatively high concentration and the small size of the molecule, it is responsible for almost 80% of the colloid osmotic pressure of the plasma.
Общая площадь поверхности множества мелких молекул альбумина очень велика, поэтому они особенно хорошо подходят для выполнения функции переносчиков многих транспортируемых кровью веществ.
К веществам, связываемым альбумином, относятся:
билирубин, уробилин, жирные кислоты, соли желчных кислот и некоторые экзогенные вещества-пенициллин, сульфамиды, ртуть и т. д.
The many small molecules have a very large total surface area, so that they are especially well suited to act as carriers, binding a number of substances for transport in the bloodstream.
Among the substances bound by albumin are bilirubin, urobilin, fatty acids, bile-acid salts and a few extraneous substances such as penicillin, sulfonamides and mercury.
Одна молекула альбумина может одновременно связать 25-50 молекул билирубина (мол. масса 500).
При многих патологических состояниях, в частности воспалительных заболеваниях и поражениях печени и почек, содержание альбумина снижается.
A single albumin molecule, for example, can bind 25-50 molecules of bilirubin (MW 500) at a time.
In many pathological states — in particular, inflammatory diseases and cases of liver and kidney damage — the amount of albumin is reduced.
Глобулинами называют группу белков, которые могут быть разделены электрофоретически.
В порядке убывания электрофоретической подвижности различают α1-, α2-, β- и γ-глобулины (рис. 4).
Однако даже эти субфракции неоднородны по составу белков:
каждую из них можно разделить при помощи других методов, например иммуноэлектрофореза (табл. 3).
The term “globulin” designates a group of electrophoretically separable components.
In order of diminishing mobility in the electric field, these are called α1-, α2-, β- and γ-globulins (Fig. 4).
Even these subfractions, however, do not represent individual proteins.
With other procedures, such as immunoelectrophoresis, each can be further separated (Table 3).
Фракция α1-глобулинов состоит из многих коньюгированных белков, простетической группой которых являются углеводы — преимущественно гексозы и гексозамины.
Эти белки называют гликопротеинами.
Около 2/3 всего количества глюкозы плазмы присутствует в связанной форме в составе гликопротеинов.
The subgroup of α1-globulins consists of a number of conjugated proteins, with carbohydrate prosthetic groups predominantly in the form of hexoses and hexosamines;
these are called glycoproteins.
About 2/3 of the glucose in the plasma is bound as glycoprotein.
Эту связанную глюкозу невозможно определить с помощью клинических проб на сахар в плазме, лишенной белков;
она может быть измерена лишь после отделения от белков методом кислотного гидролиза (в этом случае ее концентрация составляет 0,8-1,65 г/л).
К субфракции гликопротеинов относится еще одна группа углеводсодержащих белков протеогликаны (мукопротеины), в состав которых входят мукополисахариды.
This bound glucose is not detected by clinical tests for blood sugar in deproteinated plasma.
This subfraction also includes another group of carbohydrate-containing proteins, the proteoglycans (mucoproteins);
these contain glucosaminoglycans (mucopolysaccharides).
Фракция α2-глобулинов включает гаптоглобин, относящийся по химическому строению к протеогликанам, и медьсодержащий белок церулоплазмин.
На каждую молекулу последнего приходится 8 атомов меди, обусловливающих оксидазную активность этого белка.
Церулоплазмин связывает около 90% всей меди, содержащейся в плазме (однако с током крови к клеткам переносится медь, связанная не церулоплазмином, а альбумином).
In the α2-globulin fraction there are haptoglobin, which chemically is classified as a proteoglycan, and the copper-containing ceruloplasmin.
The latter has 8 atoms of copper per molecule, which are responsible for the oxidase activity of the protein.
About 90% of the total plasma copper is bound to ceruloplasmin.
However, the copper transported in the bloodstream to the cells of the body is bound to albumin rather than to ceruloplasmin.
К β-глобулинам относятся основные белковые переносчики липидов и полисахаридов.
Важное значение липопротеинов состоит в том, что они удерживают в растворе нерастворимые в воде жиры и липоиды и обеспечивают тем самым их перенос кровью.
Около 75% всех жиров и липоидов плазмы входят в состав липопротеинов.
The β-globulins include the most important carrier proteins for lipids and polysaccharides.
The lipoproteins are of great functional significance in that they can hold non-water-soluble fats and lipoids in solution and act as a vehicle for their transport in the blood.
About 75% of all fats and lipoids in the plasma are bound as lipoproteins.
Небольшие количества липопротеинов обнаруживаются и во фракции α1-глобулинов, однако большинство относится к β-глобулинам;
главный из них-это β-липопротеин, молекула которого на 77% состоит из липидов.
Исследование липопротеинов плазмы методом ультрацентрифугирования и электрофореза (электрофоретическая подвижность липопротеинов обусловлена их белковым компонентом) — это важное средство диагностики различных форм гиперлипопротеинемий.
Small amounts of lipoproteins are also found in the α1-fraction, but the majority migrate with the β-globulins.
Of these, the most important is β- lipoprotein, a molecule of which can comprise as much as 77% lipid.
Analysis of the lipoprotein mixture in the plasma by means of ultracentrifugation and electrophoresis (the electrophoretic mobility of the lipoproteins is due to their protein component) has become a useful tool in diagnosis of the various forms of hyperlipoproteinemia.
Кроме липопротеинов к β-глобулинам относится группа металлсодержащих белков, один из которых трансферрин служит переносчиком меди и, что особенно важно, железа.
Каждая молекула трансферрина содержит два атома трехвалентного железа;
именно трансферрин обеспечивает транспорт этого элемента кровью.
В норме трансферрин плазмы лишь на 30% насыщен железом, и содержание железа составляет 1 мг Fe 3+ на 1 л плазмы.
Apart from the lipoproteins, the fraction comprises a group of metal-binding proteins; one of these, transferrin, serves as a carrrier of copper and, most importantly, of iron.
This metalloprotein binds 2 (ferric) iron atoms per molecule,
and is the vehicle for iron transport in the blood.
The serum transferrin is normally only about 30% saturated with iron (1 mg Fe 3+ /l serum).
К неоднородной группе γ-глобулинов относятся белки с самой низкой электрофоретической подвижностью:
их изоэлектрические точки ближе к нейтральному значению pH, чем у других белков плазмы (табл. 3).
Данная группа включает большинство защитных и обезвреживающих веществ крови (иммуноглобулинов).
Поскольку потребности в белках, выполняющих такие специфические функции, бывают различны, размеры и состав фракции γ-глобулинов существенно варьируют.
Почти при всех заболеваниях, особенно воспалительных, содержание γ-глобулинов в плазме повышается.
The heterogeneous group of γ-globulins includes the proteins with the lowest electrophoretic mobility;
their isoelectric points, accordingly, are nearer the neutral point than those of the other plasma proteins (cf. Table 3).
Among the γ-globulins are most of the protective and defensive substances of the blood (immunoglobulins).
Because the demand for proteins with such special functions varies, there are wide fluctuations in the quantity and composition of the γ-globulin fraction;
in almost all diseases, particularly the inflammatory ones, the amount of γ-globulins increases.
При этом общее количество белков плазмы обычно остается приблизительно тем же, так как повышение содержания γ-глобулинов сопровождается примерно равным уменьшением фракции альбумина;
в результате так называемый альбумин-глобулиновый коэффициент снижается.
К γ-глобулинам относятся также агглютинины крови, называемые анти-А и анти-В.
The total amount of plasma protein in general remains approximately the same, however, because the increase in γ-globulins is accompanied by a roughly equal decrease in albumin;
the so-called albumin-globulin ratio is reduced.
The erythrocyte-agglutinating substances anti-A and anti-B are also γ-globulins.
Фибриноген выявляется в виде узкой отдельной полосы, расположенной между полосами β- и γ-глобулинов.
Этот белок представляет собой растворимый предшественник фибрина;
последний превращается в нерастворимую форму, обеспечивая образование сгустка крови.
Fibrinogen appears as a narrow separate band, between the β- and γ-globulin fractions.
Fibrinogen is the dissolved precursor of fibrin, which precipitates out of solution to form a blood clot.
Молекула фибриногена имеет удлиненную форму (соотношение длина/ширина равно 17:1).
Высокая вязкость растворов фибриногена обусловлена тенденцией его молекул образовывать агрегаты в виде «ниток бус».
Fibrinogen is an elongated molecule with an axial ratio (length: width) of 17 : 1.
The high viscosity of fibrinogen solutions results from the tendency of these molecules to aggregate in a string-of-beads formation.
Характерные изменения фракции фибриногена обнаруживаются лишь при некоторых редких заболеваниях, поэтому электрофоретически выявляемые сдвиги в содержании этого белка не имеют большого диагностического значения.
Кроме того, при электрофорезе на бумаге подвижность удлиненной молекулы фибриногена в большей степени зависит от свойств бумаги, чем подвижность других белков плазмы.
Из этих соображений при электрофорезе белков крови на бумаге, применяемом в клиниках, обычно используют не плазму, а сыворотку, в результате чего на типичной электрофореграмме полоса фибриногена отсутствует (рис. 4).
Characteristic changes in the fibrinogen fraction appear only in a few rare diseases, so that there is little diagnostic value in electrophoretic demonstrations of altered fibrinogen concentration.
Moreover, the mobility of this elongated molecule in paper electrophoresis is more dependent on the kind of paper used than is that of the other plasma proteins.
For these reasons, serum rather than plasma is usually used in clinical paper electrophoresis of blood proteins;
the typical electropherogram shown in Fig. 4 thus has no fibrinogen band.
При нормальном питании в организме человека за сутки вырабатывается около 17 г альбумина и 5 г глобулина.
Период полураспада альбумина у человека равен 10-15 сут, а глобулина — примерно 5 сут;
это означает, что за такой срок 50% общего количества белка сменяется новосинтезированным.
A human on a normal diet synthesizes about 17 g albumin and 5 g globulin in 24 hours.
The halflife of albumin in the human is 10-15 days, and that of globulin is about 5 days.
That is, when these times have elapsed 50% of the protein present on the first day has been replaced by newly synthesized protein.
Вещества, транспортируемые плазмой крови
Transported Plasma Components
Как было показано в предыдущих разделах, неорганические электролиты и белки плазмы уже самим своим присутствием оказывают огромное влияние на ее важнейшие функции.
В этом смысле данные вещества можно считать функциональными элементами плазмы.
As has been shown in the preceding sections, the inorganic electrolytes and the proteins transported by the plasma critically affect, by their very presence, its most important functional properties.
In this sense the inorganic electrolytes and the proteins are functional elements of the plasma.
Существует и другая группа компонентов плазмы — вещества, которые просто переносятся плазмой и в физиологических концентрациях мало влияют на ее свойства.
Для таких веществ плазма служит прежде всего переносчиком.
Эта неоднородная группа включает:
а) питательные вещества, витамины и микроэлементы;
б) промежуточные продукты обмена;
в) гормоны и ферменты;
г) вещества, подлежащие выведению.
There is another group of plasma components which are simply transported and have little effect — within the physiological range of concentrations — on the characteristic physicochemical properties of the plasma.
For this heterogeneous group of substances the plasma is first and foremost a means of transport.
Among them are
(a) nutrients, vitamins and trace elements,
(b) products of intermediary metabolism,
(c) hormones and enzymes, and
(d) substances to be excreted.
fats, lipoids and steroids). The concentration of these substances, however, fluctuates widely (Table 4).


После приема жирной пищи содержание липидов в крови может достигать 20 г/л, и плазма в этом случае приобретает молочно-белый цвет (липемия).
Около 80% всех жирных кислот (глицериды, фосфолипиды и эфиры холестерола) образуют липопротеиновые комплексы, связываясь с глобулинами.
Неэтерифицированные жирные кислоты соединяются преимущественно с альбумином.
About 80% of the fatty acids are bound to globulin as glycerides, phospholipids and cholesterol esters (lipoproteins);
most of the non-esterified fatty acids form albumin complexes.
В отличие от липидов, содержание которых в плазме варьирует в зависимости от особенностей обмена веществ в данный момент, концентрация важнейшего из углеводов — глюкозы поддерживается на относительно постоянном уровне 0,8-1,2 г/л (4-7 ммоль/л), хотя скорости ее поглощения клетками и утилизации подвержены значительным колебаниям.
К питательным веществам, переносящимся кровью, относятся также аминокислоты, среднее содержание которых в плазме составляет около 0,04 г/л.
Источником аминокислот служат прежде всего белки пищи.
These are derived primarily from the proteins in food.
В плазме крови постоянно присутствуют все витамины и важные питательные вещества, обладающие свойствами витаминов (например, холин).
Концентрация этих веществ в плазме варьирует, причем зависит не только от содержания их в пище и синтеза кишечной флорой, а для ряда витаминов определяется, кроме того, особыми факторами, облегчающими их всасывание.
Многие витамины свободно циркулируют в плазме, однако некоторые из них, особенно жирорастворимые и ряд водорастворимых (например, витамин В12), связываются белками.
All the vitamins and the essential nutrients with the character of vitamins (e.g., choline) are continually present in the plasma.
But their concentration varies, not only because of differences in the amounts present in food or synthesized by the intestinal flora.
The concentration of some vitamins depends on the presence of specific factors that facilitate absorption;
for example, absorption of vitamin В12 is affected by Castle’s “intrinsic factor.”
Whereas many vitamins are transported in free solution in the plasma, others — especially the fat-soluble vitamins and a few water-soluble ones such as vitamin В12 — are bound to proteins.
Микроэлементами называют элементы, необходимые для построения структурных молекул, гормонов и т. п.
Один из важнейших микроэлементов — это железо.
Оно всасывается в кишечнике в виде белкового комплекса — мукозального трансферрина, причем скорость всасывания зависит не от снабжения, а от потребности в нем организма.
One of the more important trace elements (elements indispensable as components of structural molecules as well as of hormones and the like) is iron.
It is absorbed from the intestine at a rate that depends not on supply but on the body’s demands.
Iron is absorbed as a protein complex (mucosal transferrin)
Большая часть других металлов, относящихся к микроэлементам, циркулирует в плазме в составе металлсодержащих белков (металлопротеинов).
Так, 90% меди связано с белком церулоплазмином.
Кобальт является важным компонентом витамина В12 (кобаламина).
Практически весь йод присутствует в составе комплекса с так называемым тироксин-связывающим белком.
90% of the copper, for example, is bound to the protein ceruloplasmin. Cobalt is an essential component of vitamin В12 (cobalamin). Practically all the iodine takes the form of a complex with the so-called thyroxine-binding protein.
Из всех интермедиатов в наибольшем количестве в плазме присутствует молочная кислота.
Содержание ее увеличивается при недостатке кислорода и интенсивной мышечной нагрузке.
К органическим кислотам, постоянно присутствующим в крови, относится и пировиноградная кислота.
Она образуется в результате метаболизма аминокислот и углеводов и поэтому играет ключевую роль в энергетическом обмене.
Among the intermediary products of metabolism, lactic acid is present in the greatest quantities.
Its concentration rises in oxygen deficiency and during hard muscular work.
Another organic acid that is always present is pyruvic acid, a key substance in energy metabolism because of its involvement in the metabolism of both amino acids and carbohydrates.
Конечные продукты обмена (шлаки), которые не могут быть использованы и подлежат удалению из организма.
Важнейшие из них — это диоксид углерода, мочевина, мочевая кислота, креатинин, билирубин и аммиак.
Все эти вещества, за исключением диоксида углерода, содержат азот и выводятся почками.
Transported substances to be excreted.
The substances in this group are not utilized further, but are end products of metabolism which must be eliminated from the body.
The most important of these are carbon dioxide, urea, uric acid, creatinine, bilirubin and ammonia.
All of these except carbon dioxide contain nitrogen and are excreted by the kidneys.
При нарушении функции почек уровень азотсодержащих продуктов обмена в крови увеличивается.
Этот уровень измеряют по методу Кьельдаля.
позволяющему определить содержание азота в плазме после осаждения из нее белков.
Данный параметр используется при диагностике заболеваний почек.
When kidney function is impaired, their plasma concentration rises.
They are measured as an aid to the diagnosis of kidney diseases, by Kjeldahl’s method for determining nitrogen content of plasma after precipitation of the proteins.
Для практических целей считают, что уровень небелкового азота (НБА), определяемый по методу Кьельдаля, соответствует содержанию азота в шлаках, однако около 1/5 общего НБА приходится на долю аминокислот, не являющихся шлаками.
В табл. 4 перечислены основные компоненты плазмы, содержащие НБА.
The value for nonprotein nitrogen (N.P.N.) thus obtained corresponds, for practical purposes, to the nitrogen in the above-mentioned waste products.
But about 1/5 of the N.P.N. is incorporated in the plasma amino acids, which are not waste products.
In Table 4 the most important components of the N.P.N. of normal plasma are summarized.
По материалам учебника Human Physiology ( R. F. Schmidt, G. Thews) и его опубликованного перевода.
Материалы обработал: Евгений Бартов

