энтерофурил или рифаксимин что лучше
Этиотропная терапия острых кишечных инфекций
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается.
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается. Сложности в получении объективной информации о фактической этиологической структуре ОКИ ведут к тому, что практические врачи ориентируются в большинстве случаев на собственный опыт и региональные данные. Активное внедрение в практическую деятельность стационаров страховой медицины требует максимального снижения стоимости обследования и лечения пациентов и, как следствие, ведет к упрощению диагностики, зачастую в ущерб ее качеству, а также применению препаратов преимущественно отечественного производства.
Ежегодно в США патогенные микроорганизмы, передающиеся пищевым путем, вызывают около 76 млн случаев кишечных инфекций, в том числе 325 000 больных госпитализируется и 5 000 умирает. Только число случаев шигеллеза по оценкам экспертов составляет около 450 000, из них около 6 000 госпитализируется; а инфекции, вызванной норовирусами, — около 23 млн., из которых почти 40% связано с пищевым путем передачи. Число же официально регистрируемых случаев ОКИ в Российской Федерации в десятки раз меньше и не превышает 700 000 в год.
Немаловажной проблемой диагностики кишечных инфекций является формальный подход не только к назначению диагностических исследований, но и к оценке их результатов. Так, например, проведенный нами анализ 1522 историй болезни пациентов гражданских и военных стационаров, перенесших ОКИ в 2003–2006 гг., показал, что при поступлении их в стационар осмотр стула не проводился или данные о результатах осмотра отсутствуют в 31,4% историй болезни при легком течении заболевания, 16,6% — средней степени тяжести и 42,7% при тяжелом течении. Отсутствие патологических примесей в испражнениях отмечено у 32,8% больных с легким течением кишечной инфекции, 21,9% — среднетяжелым и даже у 6,1% — тяжелым.
Копрологические исследования чаще всего не проводятся при тяжелом течении болезни — 36,14%, в то время как при легком течении и средней степени тяжести болезни таких случаев было достоверно меньше — 11,06% и 5,78% соответственно (p > 0,001). При копрологическом исследовании патологических изменений в копрограмме не обнаружено в среднем у 29,83% больных при легкой степени тяжести кишечной инфекции, 11,02% — средней и 7,84% тяжелой. В то же время, несмотря на выявление копрологических признаков колита у 13,6% пациентов с острым гастроэнтеритом и у 25,5% острым энтеритом, изменения в окончательный диагноз внесены не были. А в тех случаях, когда в диагнозе отмечено наличие колита, копрологические признаки отсутствовали у 50,6% больных острым гастроэнтероколитом 46,1% — острым энтероколитом.
Диагностические посевы испражнений выполнялись у 49,0% пациентов двукратно, 23,5% — трехкратно и 17,0% — однократно. С увеличением степени тяжести эпизода ОКИ увеличивалась доля пациентов, у которых диагностические исследования проводились однократно. Так, при легком течении заболевания в 57,5% случаев выполнены три и более диагностических посева испражнений для выявления патогенной микрофлоры и всего лишь в 18,8% случаев исследования выполнялись однократно. При средней степени тяжести инфекции трехкратные посевы проведены в 19,9%, а однократные — в 15,6% случаев, в то время как у 64,5% больных выполнено два посева. При тяжелом течении заболевания в 44,4% случаев микробиологические исследования выполнены лишь один раз. Вместе с тем серологические исследования с целью установления этиологии заболевания проводятся чаще при тяжелом течении болезни — 58,54%, чем при среднетяжелом — 25,2% и легком — 19,22% (p Купить номер с этой статьей в pdf
Подходы к лечению больных синдромом избыточного бактериального роста в тонкой кишке, развившимся в связи с патологией верхних отделов желудочно-кишечн
В статье оценивается эффективность терапии синдрома избыточного бактериального роста (СИБР) в тонкой кишке у больных с патологией верхних отделов желудочно-кишечного тракта (ЖКТ). В исследование включено 30 больных с патологией верхних отделов ЖКТ с СИБР.
In this paper, we assess efficiency of therapy of excessive bacterial growth syndrome in small intestine in patients with pathology of upper segments of gastrointestinal tract (GIT). The study included 30 patients with pathology of upper segments of GIT and excessive bacterial growth syndrome (EBGS). The main reasons of EBGS development in the studied patients were chronic pancreatitis with pancreas exocrine insufficiency and conducting eradication therapy in patients with duodenal ulcer associated with Н. pylori.
Синдром избыточного бактериального роста (СИБР) определяется как состояние, при котором повышено содержание микробов в тонкой кишке. У здоровых людей количество бактерий в тощей кишке составляет 10 3–4 КОЕ/мл, увеличиваясь до 10 7 /мл в подвздошной кишке. Количественной границей, позволяющей констатировать СИБР, является выявление ≥ 10 5 колониеобразующих единиц/мл (КОЕ/мл) в аспирате из проксимальных отделов тонкой кишки [1].
Факторами, препятствующими колонизации тонкой кишки микробами из вышележащих отделов, являются: соляная кислота, пепсин, желчные кислоты, лизоцим, секрет поджелудочной железы, нормальная моторика кишечной трубки, функционирующий илеоцекальный клапан, секреторный иммуноглобулин А. Повреждения этих защитных механизмов (снижение секреции соляной кислоты, панкреатической и билиарной секреции, применение антибиотиков, нарушение моторики кишечника, несостоятельность илеоцекального клапана, нарушение продукции секреторных иммуноглобулинов и др.) приводят к развитию СИБР, появлению разнообразной клинической симптоматики (расстройство стула, метеоризм, абдоминальные боли и др.) и возникновению мальдигестии и мальабсорбции [1].
Для диагностики СИБР могут быть использованы инвазивные и неинвазивные методы. При использовании инвазивных методов проводят аспирацию содержимого двенадцатиперстной или проксимальных отделов тонкой кишки или забор биоптата с последующей культивацией аспирата или биоптата. Методики имеют определенные ограничения: невозможность культивации 20–60% микробов в лабораторных условиях, контаминация проб во время их забора, высокий процент ложноотрицательных результатов, низкая воспроизводимость и др. [2, 3]. К непрямым методам относятся тесты, основанные на изучении метаболитов микрофлоры после нагрузки тем или иным субстратом (лактулозой, глюкозой, лактозой и др.). Лактулоза является искусственным синтетическим дисахаридом, состоящим из фруктозы и галактозы, который не переваривается пищеварительными ферментами человека, но ферментируется водородпродуцирующими бактериями желудочно-кишечного тракта. В норме лактулоза разлагается и утилизируется бактериями в толстом кишечнике с образованием водорода, который всасывается в кровь и выделяется с выдыхаемым воздухом. При СИБР лактулоза подвергается брожению в тонкой кишке, вследствие чего концентрация водорода возрастает раньше, чем в норме [4].
Тактика ведения больных предполагает выявление и воздействие на причину развития СИБР, а на сам СИБР, при его устойчивом характере, путем проведения антибактериальной терапии. Возможно использование разных антибактериальных препаратов: метронидазола, тетрациклина, Бисептола, ципрофлоксацина, ванкомицина, рифаксимина. Выбор антибактериального препарата зависит от путей миграции микробной флоры. Так как при изучаемой патологии флора поступает из дыхательных путей и верхних отделов желудочно-кишечного тракта, для проведения настоящего исследования был избран Бисептол.
Бисептол — комбинированный противомикробный препарат, состоящий из сульфаметоксазола и триметоприма. Сульфаметоксазол, сходный по строению с парааминобензойной кислотой (ПАБК), нарушает синтез дигидрофолиевой кислоты в бактериальных клетках, препятствуя включению ПАБК в ее молекулу. Триметоприм усиливает действие сульфаметоксазола, нарушая восстановление дигидрофолиевой кислоты в тетрагидрофолиевую — активную форму фолиевой кислоты, ответственную за белковый обмен и деление микробной клетки. Препарат обладает широким спектром противомикробной активности, включающим большинство грамотрицательных (Salmonella spp. (включая Salmonella typhi и Salmonella paratyphi), Escherichia coli (энтеротоксигенные штаммы), Proteus spp., Klebsiella spp., Entеrobacter spp., Shigella spp., Yersinia spp.) и грамположительных (Streptococcus spp., Staphylococcus spp., Enterococcus faecalis, Streptococcus pneumoniae, Bacillus anthracis, Listeria spp., Nocardia asteroides) аэробных бактерий.
В исследовании проводилась оценка эффективности препарата Бисептол (сульфаметоксазол 400 мг, триметоприм 80 мг) в коррекции синдрома избыточного бактериального роста у больных с патологией верхних отделов желудочно-кишечного тракта.
Задачами исследования были:
1) оценка клинической эффективности на основании анализа дневника пациента и динамики клинических данных;
2) изучение динамики результатов водородного теста;
3) определение динамики результатов карболеновой пробы;
4) исследование переносимости и безопасности терапии по частоте развития клинических побочных эффектов, динамике клинического и биохимического анализов крови.
1) наличие СИБР по данным водородного дыхательного теста;
2) больные язвенной болезнью, ассоциированной с инфекцией Н. pylopi, хроническим атрофическим гастритом со сниженной секреторной функцией;
3) больные, длительно получающие ИПП;
4) больные после проведения антибактериальной терапии (эрадикация и др.);
5) больные хроническим панкреатитом с внешнесекреторной недостаточностью поджелудочной железы;
6) больные с хронической патологией печени и желчевыделительной системы и сниженной продукцией желчи.
Материал и методы исследования
Изучено 30 больных с патологией верхних отделов желудочно-кишечного тракта с синдромом избыточного бактериального роста, отвечающих критериям включения.
Дизайн исследования
На первом визите проводили оценку состояния больного, сбор анамнеза и необходимые диагностические процедуры: водородный тест, оценка времени транзита карболена по пищеварительному тракту — карболеновая проба, клинический анализ крови, биохимический анализ крови (АЛТ, АСТ, билирубин, ЩФ, ГГТ, мочевина, креатинин). При соответствии пациента критериям включения назначали препарат Бисептол по 2 таблетки 2 раза в день в течение 7 дней. Оценку клинических симптомов проводили в баллах по следующим градациям: 0 — нет, 1 — симптом выражен слабо, 2 — симптом выражен умеренно, 3 — симптом выражен сильно, 4 — симптом выражен очень сильно и требует лечебной коррекции. На втором визите (на 8-й день) проводили осмотр пациента, оценивали физикальные данные и клинические проявления в баллах. Проводили контрольные исследования (водородный тест, карболеновую пробу, клинический анализ крови, биохимический анализ крови (АЛТ, АСТ, билирубин, ЩФ, ГГТ, мочевина, креатинин)). Оценивали переносимость и безопасность по клиническим (нежелательные явления) и лабораторным данным.
Результаты исследования
В исследование были включены 30 больных: 14 женщин, 16 мужчин. Средний возраст составил 52,3 ± 16,8 года. Заболевания, которые привели к развитию СИБР, представлены в табл. 1.
Основными причинами развития СИБР у исследуемых больных были: хронический панкреатит (ХП) с внешнесекреторной недостаточностью поджелудочной железы (ВСНПЖ) и проведение эрадикационной терапии у больных язвенной болезнью двенадцатиперстной кишки (ЯБДК), ассоциированной с Н. pylori. Из 13 больных ХП с ВСНПЖ, у 8 по данным эластазного теста фиксировалась умеренная ВСНПЖ (эластаза I кала от 100 до 200 мкг/г), у 5 пациентов — тяжелая (менее 100 мкг/г). У всех пациентов проводилась адекватная заместительная ферментная терапия микронизированными препаратами (Креон, Эрмиталь) в суточных дозах 100 000–150 000 Ед липазной активности в зависимости от исходной степени ВСНПЖ.
У 14 больных язвенной болезнью (12 пациентов с локализацией язвы в двенадцатиперстной кишке, 2 — сочетанной локализации) проводилась эрадикационная терапия в течение 10 дней. У 7 пациентов проводилась последовательная терапия (Омитокс 20 мг 2 раза в день + амоксициллин 1000 мг 2 раза в день 5 дней, затем Азитрал 500 мг 2 раза в день — 5 дней). У 7 больных — тройная терапия первой линии (Омез 20 мг 2 раза + амоксициллин 1000 мг 2 раза + кларитромицин 500 мг 2 раза). Другие возможные причины развития СИБР включали нарушенную моторику кишечника у больной с синдромом раздраженного кишечника (диарея) и билиарную недостаточность у больных с патологией печени с нарушением желчевыделения (жировой гепатоз и дисфункция желчного пузыря, холестероз желчного пузыря).
Оценка клинической эффективности
Клинические проявления СИБР оценивали в баллах по данным индивидуального дневника. Их динамика после 7-дневного курса терапии представлена в табл. 2. Основным симптомом у изучаемых пациентов был метеоризм, который беспокоил практически всех пациентов. Другие жалобы (переливание, учащенный кашицеобразный стул, боли по ходу кишки, урчание) наблюдали с частотой 46,7–76,7%. После проведенного курса терапии достоверно уменьшилась интенсивность представленных симптомов, увеличилось количество пациентов с оформленным стулом.
Результаты изучения водородного теста до и после лечения
Водородный дыхательный тест с нагрузкой лактулозой проводили с использованием анализатора Gastrolyzer. Измеряли базальный уровень концентрации водорода в выдыхаемом воздухе, который не должен превышать 10 ppm (в этом случае от проведения водородного дыхательного теста воздерживались как минимум на 16 часов из-за возможного получения ложных результатов). Далее пациенту давали 10 г лактулозы. После первого (натощак) измерения уровня водорода последующий замер производили через 15 мин, затем на 15-й, 30-й, 45-й, 60-й, 90-й и 120-й минутах.
СИБР констатировали при повышении концентрации водорода более чем на 10 ppm от базального уровня в течение от 15 до 60 мин. Как правило, максимальное повышение концентрации водорода фиксируется не ранее 60-й минуты теста, чаще после 90-й минуты, поскольку именно столько времени требуется для прохождения лактулозы в толстую кишку. При увеличении концентрации водорода раньше этого времени возможны два варианта СИБР.
Первый вариант: СИБР с полноценной функцией илеоцекального клапана.
При исследовании выявляется кривая с двумя пиками. Появление первого пика повышения концентрации водорода свидетельствует о наличии СИБР в тонкой кишке с полноценной функцией илеоцекального клапана и о том, что бактерии, находящиеся в тонкой кишке, способны метаболизировать лактулозу. Второй пик свидетельствует о том, что большая часть лактулозы не абсорбируется в тонкой кишке и подвергается процессу ферментации в толстой кишке.
Второй вариант: СИБР сочетается с нарушением функции илеоцекального клапана. При этом варианте кривая характеризуется быстрым повышением концентрации водорода (в течение 60 мин), которое сохраняется до 90-й минуты, превышая исходный уровень как минимум на 20 ррm и отсутствием снижения ее между первым и вторым наивысшим показателем. В таких случаях можно предполагать ретроградный заброс химуса из толстой кишки в тонкую кишку (терминальную часть подвздошной кишки) через илеоцекальный клапан, что приводит к СИБР в терминальном отделе тонкой кишки.
До лечения первый вариант СИБР наблюдали у 10 (33,3%), второй вариант — у 20 (66,7%) пациентов. Исчезновение СИБР после проведенного курса лечения отметили у 20 (66,7%) больных. При этом эффективность лечения зависела от исходного варианта СИБР: из 10 больных с первым вариантом (с полноценной функцией илеоцекального клапана) разрешение СИБР по данным водородного теста наступило у 8 (80%); при втором варианте эффект лечения наблюдали у 12 (60%) из 20 пациентов. Основная патология также влияла на эффективность терапии СИБР. Из 14 больных язвенной болезнью коррекция СИБР наступила у 12 (85,7%). При ХП положительный результат лечения наблюдали у 7 (53,8%) из 13 пациентов. В связи с малым размером выборки представленные различия и в том, и в другом случае не достоверны.
Результаты изучения карболеновой пробы до и после лечения
Карболеновая проба использовалась для оценки времени кишечного транзита и состояла в назначении пациенту 4 таблеток активированного угля с фиксацией времени визуального определения появления угля в кале и оценки времени пассажа карболена по кишечнику. До лечения средние значения времени кишечного транзита составляли 12,5 ± 4,8 часа, после лечения продолжительность увеличилась до 14,4 ± 3,4 часа (р ≤ 0,05, различия достоверны).
Оценка переносимости и безопасности проводимой терапии
Переносимость и безопасность проводимой терапии оценивали по частоте развития (нежелательных явлений) побочных эффектов, динамике клинического и биохимического анализов крови.
Нежелательные явления наблюдали у двух больных. У одной больной возникла горечь во рту, которая была выражена умеренно, купировалось самопроизвольно, отмена Бисептола не проводилась. У одного пациента развилась крапивница, которая купировалось при приеме Супрастина. Отмена препарата не проводилась. Таким образом, частота нежелательных явлений составила 6,7%. Выраженность их можно расценить как слабую, связь с приемом изучаемого препарата как вероятную.
Какой-либо динамики основных показателей клинического и биохимического анализов крови после лечения не наблюдали.
Обсуждение
Эффективность терапии была выше у больных СИБР с сохраненной функцией илеоцекального клапана — 80% — по сравнению с вариантом с несостоятельностью илеоцекального клапана, где она составила 60%. Это можно объяснить тем, что при первом варианте СИБР основной микрофлорой, попадающей в тонкую кишку из вышележащих отделов желудочно-кишечного тракта, полости рта, верхних дыхательных путей, являются аэробы. Бисептол обладает широким спектром противомикробной активности, включающим грамотрицательную и грамположительную аэробную микрофлору. При втором варианте (попадание микробов из толстой кишки при нарушенной функции илеоцекального клапана) существенная роль принадлежит контаминации тонкой кишки анаэробной микрофлорой из толстой, на которую Бисептол не действует. Таким образом, данные водородного теста позволяют более обоснованно осуществлять выбор антибактериальной терапии СИБР: при сохраненной функции илеоцекального клапана и преобладающем заселении тонкой кишки микрофлорой из верхних отделов желудочно-кишечного тракта возможно назначение Бисептола, при нарушении функции илеоцекального клапана есть основания для выбора препарата, воздействующего на анаэробную микрофлору, контаминирующуюся из толстой кишки.
Коррекция СИБР по результатам водородного теста сопровождалась положительной динамикой клинической картины с исчезновением или существенным снижением выраженности симптомов. Сохранение измененных результатов водородного теста, как правило, сочеталось с отсутствием положительной динамики симптомов.
Результаты настоящего исследования показали, что эффективность Бисептола в лечении СИБР у больных с патологией верхних отделов желудочно-кишечного тракта составила 66,7%. Терапия приводила к достоверному снижению интенсивности симптомов, характеризующих СИБР, а также увеличению времени кишечного транзита. Переносимость и безопасность препарата была хорошей, частота побочных эффектов составила 6,7%, интенсивность их была слабой. Изменений в показателях клинического и биохимического анализов крови не наблюдали.
Выводы
Литература
ФГБУ ДПО ЦГМА УД Президента РФ, Москва
Пищевые токсикоинфекции
В этом выпуске «Аптечного практикума» мы знакомим читателей с газетной версией разработки из нового справочно-обучающего пособия «Консультируем и рекомендуем», которое выйдет из печати осенью этого года. В новой версии пособия мы представляем локализированные разработки по новым рейтингам запросов клиентов аптек (Pharma-Q, весна 2016, Ipsos Healthcare), которые позволяют быстро ориентироваться в предложениях при таких запросах.
Коротко о заболевании
Причина: употребление некачественной (просроченной, плохо приготовленной, неправильно хранившейся) пищи, обсемененной энтеропатогенными микроорганизмами. Круг условно-патогенных и патогенных микробов, которые способны синтезировать энтеротоксины, провоцирующие пищевые токсикоинфекции, достаточно широк: клебсиеллы, клостридии, шигеллы, кишечная палочка, стафилококки, протей, сальмонеллы и др.
Симптомы: частая диарея (≥10 раз в сутки), тошнота, рвота, боли в животе, общее недомогание. Как правило, появляются через 2—5 ч после употребления испорченного продукта.
Оставим за кадром случаи тяжелых отравлений, требующих вызова «скорой помощи» и стационарного лечения. В центре внимания — спектр лекарственных препаратов для терапии легких и умеренных пищевых токсикоинфекций, не сопровождающихся «экстремальными» симптомами. Заметим, что в данных исследования (Pharma-Q, весна 2016, Ipsos Healthcare) клиентские запросы по таким симптомам, как «частые», отметили почти половина опрошенных респондентов (40,9%).
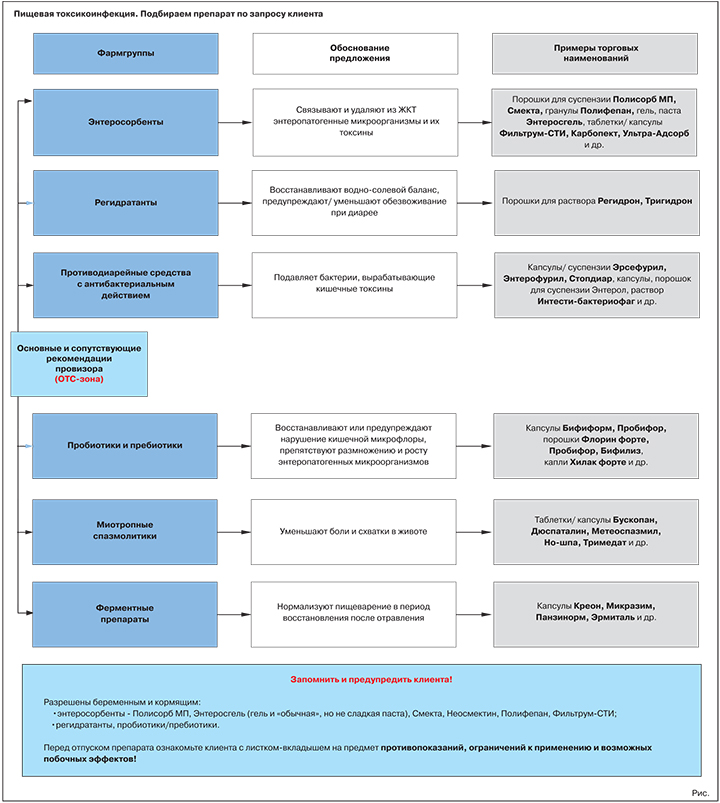
Что вправе посоветовать первостольник (OTC-зона)
Практически все группы препаратов, играющих ведущую роль в лечении пищевых токсикоинфекций, инфекционной диареи, имеют своих представителей в безрецептурном сегменте. Именно ими вправе оперировать первостольник при консультировании посетителей аптек.
Основная рекомендация № 1. Средства с энтеросорбирующим действием
Обоснование предложения: применяются на первом этапе лечения (очищение кишечника) — связывают и удаляют из ЖКТ энтеропатогенные микроорганизмы и их токсины.
Факторы выбора препарата
1. Сорбционная емкость
Сорбционная емкость отражает «силу действия» энтеросорбента, а именно — количество вредных веществ, которое он может поглотить на единицу своей массы (м2/г).
Самая низкая сорбционная емкость у «классического» угля активированного в таблетках — 1,5—2 м2/г. У капсулированных препаратов Карбопект и Ульра-адсорб эта величина больше, т.к. в их состав входит уголь с повышенной пористостью.
Другие энтеросорбирующие лекарственные препараты в порядке возрастания сорбционной емкости располагаются так: 16—40 м2/г — препараты лигнина*; 100 м2/г — препараты диосмектита*; 150 м2/г — препарат полиметилсилоксана гидрата (Энтеросгель); 300 м2/г — препарат коллоидного кремния диоксида (Полисорб МП).
Добавим, что наряду с Полисорбом МП на фармрынке России есть и другое средство, содержащее коллоидный кремния диоксид, — Вайтсорб. Однако оно зарегистрировано как БАД к пище.
2. Ограничения к приему, возможные побочные эффекты
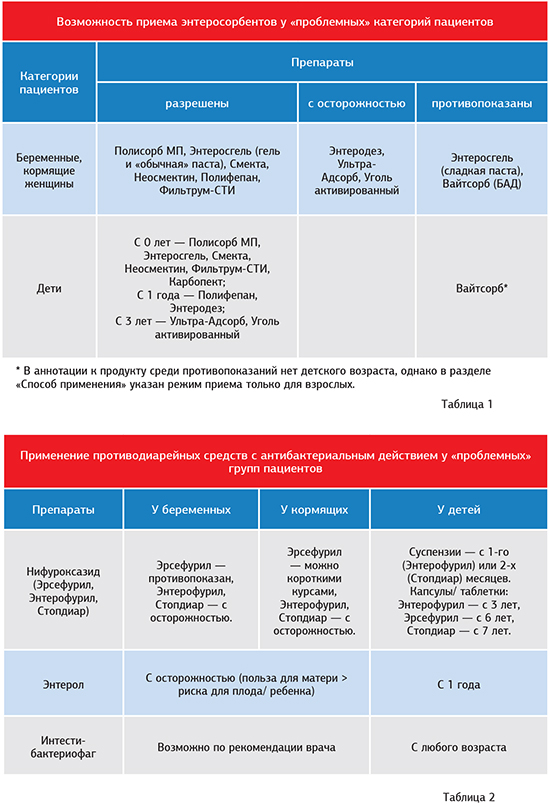
За некоторыми исключениями энтеросорбенты разрешены к приему даже у таких «проблемных» групп пациентов, как беременные и кормящие женщины, маленькие дети (табл. 1).
Большинство препаратов группы противопоказано пациентам с язвой желудка и двенадцатиперстной кишки. Не подпадают под это «табу» Энтросгель и препараты диосмектита. Более того, Смекта и ее генерики оказывают положительное (гастропротекторное) действие на поврежденную слизистую оболочку желудка.
К возможным нежелательным явлениям при приеме энтеросорбентов относится запор. Нет соответствующего пункта в разделе «побочные эффекты» у препарата Карбопект, который содержит среди вспомогательных веществ пектин. Не вызывает запоров при правильном режиме дозирования и комбинированный препарат Лактофильтрум — в нем энтеросорбент лигнин дополнен послабляющим пребиотиком лактулозой. Однако следует иметь в виду, что в списке официальных показаний к приему этого препарата нет пищевых токсикоинфекций и инфекционной диареи.
Основная рекомендация № 2. Пероральные регидратанты (глюкозо-электролитные смеси)
Обоснование предложения: применяются при острой диарее (в сочетании с энтеросорбентами) для восстановления водно-солевого баланса и профилактики/ уменьшения обезвоживания.
Варианты предложения: Регидрон, Тригидрон.
Факторы выбора препарата
1. Порядок отпуска
Только Регидрон и Тригидрон разрешены к отпуску без рецепта. Аналогичные по составу, но отличающиеся по количественному содержанию солей и глюкозы, препараты Гидровит и Гидровит форте относятся к рецептурным средствам.
2. Ограничения к приему
Регидратанты разрешены беременным и кормящим женщинам. Регидрон и Тригидрон показаны к приему исключительно у взрослых; у детей (с первого года жизни) по назначению врача могут применяться только рецептурные Гидровит и Гидровит форте.
Возможные сопутствующие рекомендации
Противодиарейные средства с антибактериальным действием
Обоснование предложения: применяются (в сочетании с регидратантами) для прямого или опосредованного подавления роста и размножения бактерий, вырабатывающих энтеротоксины.
Варианты предложения: препараты нифуроксазида (Эрсефурил, Энтерофурил, Стопдиар и др.), Энтерол, Интести-бактериофаг и др.
Пробиотики и пребиотики
Обоснование предложения: нормализуют состояние кишечной микрофлоры, препятствуют размножению и росту энтеропатогенных микроорганизмов.
Особенности группы
Миотропные спазмолитики
Обоснование предложения: уменьшают боли и схватки в животе за счет снятия спазмов гладкой мускулатуры.
Варианты предложения: Бускопан, Дюспаталин, Метеоспазмил, Но-шпа, Тримедат и др.
Особенности группы
Ферментные препараты
Обоснование предложения: пищевые отравления приводят к нарушению функций отделов ЖКТ, выделяющих пищеварительные ферменты. Препараты панкреатина помогают нормализовать переваривание пищи в период восстановления после пищевой токсикоинфекции.
Варианты предложения: Креон, Мезим форте, Микразим, Панзинорм, Эрмиталь, Фестал и др.
Особенности группы
К рецептурным препаратам, которые могут быть назначены врачом (и только им) при пищевых токсикоинфекциях, относятся:
В данном случае в компетенции провизора лишь предложение синонимической замены в рамках МНН.
–––––––––––––––––––––
* Панфилова В.Н., Таранушенко Т.Е. Применение энтеросорбентов в клинической практике. Педиатрическая фармакология, 2012, том 9, № 6.
.gif)
.gif)
.gif)