элькар или стимол что лучше
Коррекция функциональных изменений сердечно-сосудистой системы препаратом L-карнитина у детей и подростков с сочетанной патологией
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей [24]. Особое место среди этих патофизиологических факторов занимает тканевая гипоксия, возникающая в результате нарушения процессов биологического окисления, ключевые этапы которого происходят в митохондриях [1, 14, 15, 19, 20]. Митохондриальные нарушения полиморфны и могут иметь различные варианты и степень клинической выраженности: от минимальных до грубых, угрожающих жизни изменений. Результатом тканевой гипоксии являются нарушения синтеза АТФ, транспорта энергии от места продукции к эффекторным структурам клеток, нарушение утилизации энергии АТФ [8, 11, 20, 21].
Многочисленные клинические исследования, проведенные в последние годы, свидетельствуют о том, что относительная недостаточность энергетического фона может наблюдаться и у практически здоровых лиц. При этом скрытые нарушения клеточной энергетики могут быстро декомпенсироваться, приводя к снижению активности ферментов митохондриальной дыхательной цепи, вследствие чего возникает широкий спектр метаболических функциональных нарушений, в том числе со стороны нервной и сердечно-сосудистой систем [2, 3, 16, 22, 23]. Поэтому в настоящее время в лечении различных патологических состояний у детей большое значение придается метаболической терапии. В связи с этим важен поиск и создание безопасных и эффективных лекарственных средств комплексного воздействия на обмен веществ. К таким препаратам относят карнитин — низкомолекулярное соединение, производное аминомасляной кислоты, содержащееся во всех органах, особенно в больших количествах в тканях с необходимостью высокого энергетического обеспечения — мышцах, миокарде, мозге, печени, почках [1, 2, 6, 10, 11, 20]. Существуют две изомерные формы карнитина: D- и L-изомеры. В тканях млекопитающих присутствует только L-изомер, выполняющий в организме несколько функций: энергетическую (участвует в катаболизме липидов с образованием большого количества АТФ, модулируя внутриклеточный гомеостаз кофермента А с образованием свободного коэнзима А) и дезинтоксикационную (выводит из организма в виде ацилкарнитина соединения, обладающие мембранотоксическим и ингибирующим активность некоторых ферментов действием).
По данным многих клинических исследований, основными клиническими признаками дефицита L-карнитина являются быстрая утомляемость и снижение работоспособности; мышечная слабость, гипотония и гипотрофия, отставание физического развития; задержка психомоторного развития, снижение школьной успеваемости, сонливость или раздражительность; нарушение функции сердца вплоть до кардиомиопатии; увеличение размеров печени и нарушение ее функции [8, 9, 14–19].
Потребность в L-карнитине индивидуальна, а при умственных, физических и эмоциональных нагрузках повышается в 4–20 раз. Обычный пищевой рацион, включающий продукты животного происхождения, покрывает потребность в L-карнитине лишь на 25%, поэтому очевидна необходимость использования дополнительных источников L-карнитина для обеспечения оптимальной физиологической потребности.
В настоящее время появился новый источник L-карнитина — биологически активная добавка к пище Карнитон, зарегистрированная Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека. В состав препарата Карнитон аминокислота карнитин входит в форме L-карнитина тартрата, который наиболее полно усваивается организмом; в 1 мл препарата содержится 500 мг L-карнитина.
Целью данной работы явилась оценка эффективности влияния применения препарата Карнитон на состояние сердечно-сосудистой системы у детей и подростков с сочетанной соматической патологией в период реабилитации после частых респираторных заболеваний.
Работа осуществлялась под руководством сотрудников кафедры педиатрии МГМСУ на базе детского кардиологического санатория «Быково» МВД России.
В несравнительное исследование был включен 71 ребенок от 9 до 14 лет (34 мальчика и 37 девочек), находившийся в санатории в период с ноября 2009 года по январь 2010 года. Критериями отбора явились наличие жалоб вегетативного характера, изменения на стандартной электрокардиограмме (ЭКГ), эхокардиографии (ЭХО-КГ). Всем детям в течение 30 дней в первую половину дня назначался препарат Карнитон в возрастной дозе. В период лечения другие энерготропные и кардиотрофические препараты не назначались. С целью коррекции вегетативных изменений применялась немедикаментозная терапия (режим, прогулки, лечебная физкультура; физиотерапевтическое лечение, включающее массаж и водные процедуры). Нами не было зафиксировано ни одного случая аллергической реакции, непереносимости или отказа от приема препарата Карнитон. Назначение энерготропной терапии в первой половине дня было обусловлено возбуждающим нервную систему действием, что может вызывать трудности засыпания при вечернем приеме [6, 17, 20, 22].
Эффективность терапии препаратом Карнитон оценена по данным опроса детей, результатам стандартной ЭКГ и ЭХО-КГ после курса лечения. Статистический анализ результатов проведен стандартными методами. Степень достоверности количественных показателей оценивалась по t-критерию Стьюдента. Статистически значимыми считали различия при величине p ≤ 0,05.
Обследование включало физикальный осмотр, анализ генеалогического анамнеза, клинико-анамнестических данных, общеклинические исследования, стандартную ЭКГ, ЭХО-КГ с оценкой результатов в соответствии с нормативными показателями, применяемыми в педиатрии [4]. Оценка умственной работоспособности проводилась по методике Э. Крепелина, физическая работоспособность — по пробе с дозированной физической нагрузкой.
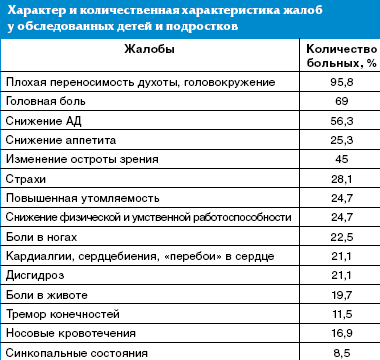
Характер жалоб у детей и подростков носил неспецифический характер, при этом наиболее часто отмечались головокружения и плохая переносимость духоты (95,8% детей), головная боль (69%), снижение артериального давления (АД) — у 56,3% пациентов. У каждого четвертого ребенка отмечались снижение аппетита, повышенная утомляемость со снижением физической и умственной работоспособности, у каждого пятого — или повышенная утомляемость, и/или кардиалгии, и/или дисгидроз, что расценивалось как проявление перманентного течения синдрома вегетативно-сосудистой дистонии (табл.).
Отмечены жалобы на нарушения сна, ночные страхи — у 28,1% пациентов, боли в ногах (22,5%), носовые кровотечения — у 16,9% обследованных. Особое внимание обращалось на детей с вегетативными пароксизмами в анамнезе, симптомами которых были боли в животе, тремор конечностей, синкопальные состояния. Всем детям с синкопальными состояниями ранее проводилось электроэнцефалографическое исследование, и было исключено органическое поражение головного мозга.
При физикальном осмотре патология опорно-двигательного аппарата в виде нарушения осанки, в том числе рахитически измененная (килевидная) грудная клетка (4,2% детей), выявлена у 98,7% больных. Снижение массы тела до 10-го центиля отмечено у 30% детей, избыточная масса — у 7%. При аускультации у 84% пациентов выслушивался низкотембровый систолический шум на верхушке и в V-точке. В процессе обследования исключена органическая патология сердечно-сосудистой, нервной систем. Анализ анамнестических, клинико-инструментальных данных свидетельствовал о том, что изменения сердечно-сосудистой системы носили вторичный характер, обусловленный нарушением вегетативной регуляции, наличием очагов хронической инфекции в носоглотке, полости рта, нарушением двигательного режима, что было выявлено практически у всех обследованных детей. Среди сопутствующих заболеваний наиболее часто встречались миопия (45%), аллергические заболевания, в том числе бронхиальная астма (22,5%), реже отмечались хронический гастродуоденит (6%), хронические запоры (4%).
При стартовом обследовании стандартной ЭКГ изменения зарегистрированы у всех детей. В 71,8% случаев отмечено вертикальное, а в 15,5% — горизонтальное расположение электрической оси сердца. У большинства детей (56,3%) выявлены нарушения автоматизма сердца в виде синусовой брадикардии (45%), эктопического ритма (14%), синусовой тахикардии (9,9%). Нарушения возбудимости сердца зарегистрированы у 45% пациентов, нарушения проводимости в виде атриовентрикулярной блокады (АВБ) I степени отмечены у 4,2%. Эти данные свидетельствуют о выраженных влияниях парасимпатического отдела на сердечно-сосудистую систему у обследованных детей и подростков, что согласуется с характером жалоб, предъявляемых пациентами.
После курса лечения препаратом Карнитон было отмечено статистически значимое (p
Т. И. Рычкова*, кандидат медицинских наук, доцент
И. П. Остроухова*, кандидат медицинских наук
С. А. Яцков**
Л. К. Акулова**
Т. М. Васильева*
* МГМСУ, Москва
** Детский кардиологический санаторий «Быково» МВД России, Московская область
Постинфекционная астения у детей: выбор оптимальной терапии
С наступлением осенне-зимнего сезона у врачей-педиатров заболеваемость их пациентов острыми респираторными вирусными инфекциями (ОРВИ) приобретает исключительную актуальность.
Постинфекционный астенический синдром
Врачам хорошо известна структура вирусов, провоцирующих это заболевание: на 65‒90% в ней представлены вирусы гриппа и парагриппа, аденовирусы и респираторно-синцитиальный вирус. В половине случаев (52%) педиатры имеют дело с вирусной моноинфекцией, в 36% выявляется ассоциация из 2 (и более) вирусов. 1
У каждого ребенка ОРВИ протекает с разной степенью тяжести. Сказывается не только разнообразие патогенов, но и возраст, состояние иммунитета, наличие неблагоприятного преморбидного фона (аденоиды, аллергия), врожденные патологии.
Тем не менее алгоритмы ведения маленьких пациентов с ОРВИ хорошо отработаны. В общей педиатрической практике детям назначается симптоматическая противовирусная терапия, проводится санация очагов хронической инфекции. 2 Вот только нередко бывает, что на смену катаральным явлениям приходит иная клиническая картина – астенический синдром, проявления которого – утомляемость, слабость, раздражительность, плаксивость – наблюдаются у 55‒64% пациентов. 3,4
И это вполне объяснимо: на борьбу с вирусной инфекцией организм тратит много сил и энергии. Даже при повышении температуры лишь на один градус потребность организма в энергии возрастает на 13%. 5 Свою роль играют лекарственная нагрузка и вирусная интоксикация, которые приводят к изменениям в обмене веществ, к ухудшению аппетита (организм недополучает необходимых веществ, ответственных за выработку энергии и восстановление), снижению защитных сил организма.
И это серьезно, потому как астенические расстройства значительно ухудшают качество жизни, усложняют адаптацию в дошкольных и школьных учреждениях, нарушают процесс обучения, снижают коммуникативную активность.
Говоря о повышенной утомляемости, следует разграничивать два разных понятия: «физиологическая усталость», которая возникает у практически здоровых людей после физической или умственной нагрузки и всегда исчезает после отдыха, и «астения» как ощущения слабости и утомляемости, которые не связаны с какой-либо нагрузкой, возникают и в покое и не исчезают после отдыха. 5
Надо заметить, специалисты рассматривают ощущение утомления и усталости как побуждение к прекращению активности, деятельности, любых усилий и т.д. Если анализировать этот феномен с позиций базовых биологических реакций: нападение – бегство и сохранение – отказ, то астения может рассматриваться как активация системы сохранения энергии посредством отказа и прекращения как физической, так и умственной деятельности. Снижение активности – это универсальный психофизиологический механизм сохранения жизнедеятельности системы в случае любой угрожающей ситуации, который действует по принципу: меньше активности – меньше потребности в энергии. Таким образом, астения – это общая реакция организма на любое состояние, угрожающее истощением энергетических ресурсов. 5
Постинфекционный астенический синдром:
На важное значение астении после перенесенных ОРВИ для клинической практики указывают не только многочисленные научные изыскания, но и тот факт, что в Международной классификации болезней 10-го пересмотра среди других астенических состояний отдельно выделен синдром G93.3 – синдром усталости после перенесенной вирусной инфекции. 6
Астенический синдром (синдром хронической усталости в англоязычной литературе) весьма многолик. В классификации этого состояния постинфекционный астенический синдром относится к классической вторичной (или реактивной) астении, возникающей у исходно здоровых лиц как реакция на напряжение адаптации в условиях стресса, а также в периоде реконвалесценции (после окончания болезненного процесса и продолжающееся до полного восстановления нормального питания и функционирования всех органов) после инфекционных заболеваний. Наиболее подвержены астеническим реакциям дети со сниженными адаптивными возможностями организма.
Ведущий патогенетический механизм развития астении связывают с нарушением функции ретикулярной формации, регулирующей активность коры и подкорковых структур, называемой также «энергетическим центром» центральной нервной системы (ЦНС). 3 К другим механизмам развития этого синдрома относят аутоинтоксикацию продуктами метаболизма, нарушение регуляции выработки и использования энергетических ресурсов на клеточном уровне. Метаболические расстройства, имеющие место при астении, приводят к гипоксии, ацидозу с последующим нарушением процессов образования и использования энергии. 3
Астения, без сомнения, представляет серьезную опасность повышенной истощаемости психических и физических функций организма. В реальной клинической картине ее механизмы могут проявляться не только эмоционально-поведенческими расстройствами (эмоциональной лабильностью, неусидчивостью, чувством тревоги, раздражительностью, беспокойством, внутренним напряжением, неспособностью расслабиться и пр.), но и соматическими проявлениями – нарушениями терморегуляции, респираторными, гастроинтестинальными, вегетативными или функциональными расстройствами (головными болями, потливостью, ухудшением аппетита, перебоями в сердце, одышкой, нарушениями сна). 4
Отмечено, длительно протекающая астения может стать причиной обострения хронического заболевания или реинфекции. Потому это состояние, вне зависимости от причины, вызвавшей его, требует коррекции. Тактика ведения пациентов с постинфекционным астеническим синдромом предполагает комплексный подход, предусматривающий прежде всего полноценный восстановительный период и рациональную фармакотерапию. Ее целью должны быть устранение энергодефицита и гипоксии, церебропротекция и нормализация метаболизма. При этом использование психостимуляторов для лечения больных с постинфекционной астенией нежелательно. 4
L-карнитин в комплексной терапии астенического синдрома
Более 100 лет назад (1905 г.) русскими учеными Р. Кримбергом и В.С. Гулевичем из мышечных тканей животных было выделено витаминоподобное вещество – карнитин. Позже выяснилось, что биологической активностью обладает только L-стереоизомер карнитина (L-карнитин, левокарнитин). Более полувека ушло на то, чтобы его синтезировать. И еще десятилетия – на изучение основных функций карнитина в организме: участие в биоэнергетическом обмене веществ, связывание и выведение из тканей органических кислот – промежуточных продуктов окислительных процессов и др. Столь важное значение карнитина в метаболизме жиров, глюкозы, аминокислот и энергообразовании позволило отнести его к незаменимым веществам.
Карнитин содержится во всех органах, особенно в больших количествах в тканях, нуждающихся в высоком энергетическом обеспечении, – мышцах, миокарде, мозге, печени, почках. Потребность в карнитине индивидуальна (в среднем 200‒500 мг в сутки для взрослого человека) и возрастает в 4‒20 раз при умственных, физических и эмоциональных нагрузках, заболеваниях и функционально особых состояниях (стресс, беременность, спорт и т.п.). Эндогенный синтез у взрослого человека обеспечивает только около 10% потребности организма в карнитине и требует участия витаминов С, В3, В6, фолиевой кислоты, железа, ряда аминокислот и ферментов; при дефиците хотя бы одного из компонентов развивается недостаточность карнитина с ее многообразными системными проявлениями. У детей раннего возраста эндогенный синтез L-карнитина практически не осуществляется, что делает их более уязвимыми к дефициту экзогенного поступления карнитина с продуктами питания (особенно животного белка). Обычный пищевой рацион покрывает потребность в карнитине в лучшем случае наполовину. Все это обусловливает необходимость использования его дополнительных источников. 7
Являясь важным компонентом энергообеспечения клетки, L-карнитин воздействует на многие процессы жизнедеятельности организма, повышает его выносливость к нагрузкам – физическим и интеллектуальным, а его дефицит, сопровождающийся снижением концентрации вещества в сыворотке крови и тканях, может приводить к разнообразным нарушениям. Принимая во внимание это, а также то, что естественное поступление этого биологического вещества в организм и его эндогенный синтез (особенно при инфекционных заболеваниях) не покрывают всех потребностей, необходим дополнительный прием препаратов L-карнитина. 7
Особенно очевидным это становится при рассмотрении функций L-карнитина. Основная из них – биоэнергетическая: L-карнитин обеспечивает транспорт длинноцепочечных жирных кислот из цитоплазмы через внутреннюю мембрану в матрикс митохондрий, где осуществляется процесс β-окисления с последующим образованием АТФ, регулирует интенсивность митохондриального энергообмена путем конъюгации ацильного радикала и высвобождения КоА. 7 Доказано значение L-карнитина для связывания высокореакционных органических кислот (уксусной и др.), а также участие в процессе гликолиза, обмене кетоновых тел и холина.
L-карнитин обладает антигипоксантным, антиоксидантным действием, предотвращает дегенеративное поражение клеток нервной системы, способствуя восстановлению их целостности и функций. 7
Препараты на основе L-карнитина производятся во многих странах мира в различных лекарственных формах для перорального и парентерального введения. В России с 2000 года широко используется лекарственный препарат L-карнитина Элькар® (МНН: левокарнитин), разработанный отечественной компанией «ПИК-ФАРМА».
Области применения левокарнитина и уникальное сочетание его терапевтических эффектов отражены в зарегистрированных показаниях к применению препарата Элькар. 8
Витаминоподобное вещество L-карнитин участвует в переносе жирных кислот в митохондрии, где они используются для образования энергии (АТФ). Окисление жиров при участии L-карнитина дает до 75% внутриклеточной энергии. Это больше, чем в процессе окисления глюкозы.
L-карнитин, помимо биоэнергетической, выполняет ряд важных метаболических функций: 8
Два десятилетия наблюдений, многочисленных исследований и клинического применения препарата Элькар® при лечении различных заболеваний и патологических состояний у детей и взрослых показали высокую эффективность, безопасность и открыли широкие возможности его применения для лечения пациентов в кардиологии, эндокринологии, неврологии, гастроэнтерологии, спортивной медицине. В педиатрии препарат применяют при заболеваниях и состояниях, сопровождающихся снижением аппетита, уменьшением массы тела, истощением; у детей с самыми разными патологиями с рождения (недоношенные, дети с ослабленными пищевыми рефлексами, с гипотрофией, гипотонией и адинамией, перенесшие асфиксию и родовую травму); при заболеваниях, сопровождающихся недостатком карнитина или его повышенной потерей; в составе комплексной терапии ряда кожных болезней, при интенсивных спортивных тренировках и, конечно же, в период реконвалесценции после заболеваний, в том числе и ОРВИ.
Так, в исследовании С.О. Ключникова (2005) у часто болеющих детей, помимо иммунной патологии, был установлен клеточный энергодефицит. Для его устранения детям с ЛОР-патологией назначались энерготропные препараты, включая левокарнитин. Нормализация показателей фагоцитарной активности нейтрофилов, активности ферментов энергообмена лейкоцитов крови (СДГ, ЛДГ, ГФДГ, ГДГ) и восстановление ферментативной активности лимфоцитов (от 18 до 27%) привели к снижению заболеваемости ОРВИ у детей после приема курсового приема энерготропной терапии. 9 При этом у детей с дисбалансом вегетативной регуляции на фоне приема комплексной терапии с включением препарата левокарнитина в 100% случаев отмечено улучшение вегетативной реактивности, что привело к уменьшению жалоб, нормализации сна и аппетита, повышению физической выносливости. 9
Авторы исследования отметили отсутствие каких-либо побочных эффектов препарата левокарнитина даже у детей с отягощенным аллергоанамнезом и признаками поражения ЦНС. 10
Позже, в сравнительном плацебо-контролируемом исследовании по оценке эффективности применения Элькар® в лечении детей с хроническими бронхолегочными заболеваниями, сопровождающимися нарушениями гемодинамики в системе малого круга кровообращения (хронический бронхит, бронхоэктатическая болезнь, пороки развития легких, гиперчувствительный пневмонит, бронхиальная астма), Л.И. Агапитовым и Ю.М. Белозеровым (2010) 11,12 были продемонстрированы антиоксидантные свойства левокарнитина. После курса лечения у детей с хроническими бронхолегочными заболеваниями, получавших препарат Элькар в течение 4 недель (50 мг/кг в сутки), увеличились максимальная и тотальная эндотелий-зависимая вазодилатация (p 11,12
Оценку эффективности левокарнитина (Элькар®) у детей с бронхиальной астмой физического напряжения дали исследования Г.А. Новика (2009, 2012). Пациенты основной группы (с подтвержденным постнагрузочным бронхоспазмом) получали Элькар в течение 2 месяцев, дети группы сравнения препарат не получали (обе группы пациентов были сопоставимы по клиническим и лабораторным показателям). При динамическом наблюдении показатели внешнего дыхания и величина просвета бронхов у детей обеих групп существенно не изменились, но у детей основной группы, в отличие от контрольной, повысилась толерантность к физической нагрузке (р 13
Влияние Элькара на состояние вегетативной регуляции и повышение устойчивости к нагрузкам показано в исследовании С.Л. Морозова (2015). Так, при оценке показателей вариабельности сердечного ритма у детей отмечались нормализация состояния вегетативной нервной системы и, как следствие, повышение адаптации. 2
Улучшение адаптации, а также обмена веществ и энергообеспечения тканей при применении Элькар®, но уже у юных спортсменов доказало и исследование Л.А. Балыковой и соавт. 14,15 Дети со стрессорной кардиомиопатией принимали препарат курсом 1,5 месяца в лечебной дозе 75‒100 мг/кг/сут, спортсмены без признаков поражения сердца ‒ в профилактической дозе 30‒50 мг/кг/сут.
Прием левокарнитина (Элькар®) показал изменения в эффекторных и иммунорегуляторных звеньях врожденного и адаптивного иммунитета. У большинства юных спортсменов при приеме Элькар® показатели гуморального иммунитета достигли нормы, что в сочетании с улучшением показателей клеточного иммунитета (увеличение абсолютного количества нейтрофилов и их метаболической активности) способствовало повышению противоинфекционной резистентности организма и снижению заболеваемости ОРВИ. Кроме того, лечение способствовало возрастанию уровня физической работоспособности, оптимизации гемодинамики в области сердца и уменьшению уровня биохимических, психологических и других маркеров стресса. 14,15
Эффекты препарата Элькар ® при восстановлении после болезни:
Таким образом, приведенные данные исследований, а также многие другие, не вошедшие в этот обзор, свидетельствуют о сочетании метаболических, нейропротекторных и иммунокоррегирующих свойств левокарнитина и эффективности отечественного лекарственного препарата на его основе Элькар® (L-карнитин) в терапии и профилактике обширного круга состояний и заболеваний, сопровождающихся явлениями астении, в том числе и после ОРВИ.
Применение Элькара позволяет существенно улучшить состояние здоровья детей, нормализуя механизмы вегетативной регуляции, стабилизируя клеточный энергообмен, что, в свою очередь, способствует возрастанию их физической активности и повышению иммунитета.
Элькар в практике педиатра
Фармакология
Е.Николаева, доктор медицинских наук, Московский НИИ педиатрии и детской хирургии Росздрава
Карнитин относится к незаменимым витаминоподобным веществам. В 1905 г. П.З. Кримбергом и В.С. Гулевичем он был впервые выделен из экстракта мышечной ткани. Основные метаболические функции карнитина связаны с процессами преобразования биологической энергии, поэтому в особенно больших количествах он содержится в тканях, нуждающихся в высоком энергетическом обеспечении, — скелетных мышцах, миокарде сердца, головном мозге, печени и почках.
Карнитин обеспечивает перенос жирных кислот в митохондрии, где происходит их окисление и высвобождение ацетил-КоА – субстрата для цикла Кребса. Карнитин осуществляет модуляцию внутриклеточного гомеостаза кофермента А в матриксе митохондрий, таким образом регулируя интенсивность биоэнергетического метаболизма. Исключительно важна (его) роль карнитина в детоксикации и выведении из тканей избытка уксусной и ряда других органических кислот, накапливающихся в ходе окислительно-восстановительных превращений. Кроме того, карнитин участвует в процессах гликолиза, синтеза жирных кислот, обмена кетоновых тел и холина [5]. У взрослых потребность организма в карнитине, составляющая 200—500 мг/сут, удовлетворяется за счет эндогенного его образования не более чем на 10—25% Синтез карнитина осуществляется главным образом клетками печени (в меньшей степени — почек) путем трансформации двух аминокислот: лизина и метионина. Источником аминокислот служат белки пищевых продуктов, а также собственные протеины мышечной ткани. В синтезе карнитина участвуют витамины С,В3, В6,В12, фолиевая кислота и железо.
Отмечено, что потребность в карнитине резко возрастает при стрессе, физических, умственных и эмоциональных перегрузках, интеркуррентных заболеваниях, недостаточном питании, а также в период беременности и лактации. Именно в ситуациях высокого расходования энергетических ресурсов, требующих повышенного катаболизма, становится очевидным исключительное значение для организма карнитинзависимых биологических процессов.
У детей, особенно раннего возраста, эндогенный синтез карнитина крайне ограничен, причем на активность эндогенного образования влияет функциональное состояние печени и почек, а выведение карнитина из организма значительно усиливается при интеркуррентных заболеваниях, дисфункции почечных канальцев, расстройствах деятельности желудочно-кишечного тракта. Обычный пищевой рацион далеко не полностью обеспечивает потребность в карнитине [1].
Таким образом, недостаточность эндогенного синтеза карнитина и его поступления с пищевыми продуктами создают возможность для развития дефицита этого вещества в организме, особенно при состояниях, способствующих повышенному выведению и нарушению всасывания. В результате нередко развивается недостаточность карнитина с ее многообразными системными проявлениями.
Главными органами-мишенями служат скелетные мышцы и миокард, во вторую очередь страдают клетки головного мозга, печень и почки. Основные признаки дефицита L-карнитина являются следствием развивающихся нарушений энергетического обмена и метаболизма липидов и связанных с этим расстройств других видов обмена веществ (быстрая утомляемость, мышечная слабость, гипотония, отставание физического и психомоторного развития, снижение успеваемости, сонливость или раздражительность, нарушение функции сердца и печени). Все это обусловливает необходимость использования дополнительных источников карнитина для лечения и профилактики его недостаточности карнитина в организме.
Существуют две изомерные формы карнитина: D- и L-стереоизомеры.
Установлено, что в тканях млекопитающих присутствует только L-стереоизомер, и именно он биологически эффективен. В настоящее время в большинстве стран мира используют только препараты на основе L-карнитина. Сведений о каких-либо значительных побочных эффектах их применения нет.
D-изомер карнитина — синтетического происхождения; в изолированном виде он не используется, однако имеются лекарственные формы на основе рацемической смеси D,L-карнитинов. Экспериментальные исследования с чистыми изомерами показали, что D-карнитин — не просто неэффективное или биологически инертное вещество, а потенциально токсичное соединение, которое негативно влияет на биосинтез в печени, конкурентно ингибирует процессы усвоения L-карнитина и нарушает его проникновение в миокард, мышечную ткань и почки [6].
Эффективность элькара при различных заболеваниях у детей, изучалась в ведущих медицинских учреждениях страны — Московском НИИ педиатрии и детской хирургии Росздрава, Научном центре здоровья детей РАМН, Российском государственном медицинском университете, Тверской государственной медицинской академии, Волгоградском государственном медицинском университете и др.
В МНИИ педиатрии и детской хирургии элькар уже в течение 5 лет применяется при лечении наследственных заболеваний (в том числе сердечно-сосудистой системы и врожденной патологии), для коррекции развития детей раннего возраста, в психоневрологии, при радиационном риске и т.д.
На фоне длительного лечения элькаром (в суточной дозе 30—50 мг на 1 кг массы тела; в течение 4 мес) у 35 детей с митохондриальными заболеваниями отмечено достоверное улучшение клинического статуса: снижение утомляемости, повышение мышечного тонуса и силы мышц, улучшение походки и координации движений, повышение умственной работоспособности. При этом зарегистрированы снижение уровня лактата и пирувата в крови, улучшение перекисного окисления липидов. У 11 больных с доказанным низким уровнем общего карнитина в крови отмечено достоверное его повышение после приема элькара в течение 3 нед. Ликвидация недостаточности карнитина при митохондриальных заболеваниях — важное средство борьбы с лактат-ацидозом и коррекции энергетического дефицита. В период лечения элькаром ухудшения состояния детей(;) не зафиксировано; у пациентов с митохондриальным синдромом MELAS отсутствовали инсультоподобные приступы. Длительное лечение элькаром (в суточной дозе 50—100 мг/кг; в течение 4 мес) 12 детей с органическими ацидемиями способствовало стабилизации их общего состояния (улучшение аппетита, купирование приступов тошноты и рвоты, повышение мышечного тонуса, нормализация метаболических показателей). После 3-недельного приема элькара у 6 детей с резко пониженным уровнем карнитина в крови он достоверно повысился, преодолев нижнюю границу нормы. Одновременно произошло достоверное снижение ранее повышенного уровня лактата в крови и уменьшилась патологическая почечная экскреция органических кислот.
Использование элькара (суточная доза 20—30 мг/кг; в течение 3 мес) у 36 детей с синдромами Марфана и Элерса—Данло привело к повышению толерантности к физической нагрузке, уменьшению частоты и интенсивности головной боли, увеличению мышечной силы и тонуса. У всех больных с доказанным дефицитом карнитина (23 ребенка с синдромом Элерса—Данло и 8 — с синдромом Марфана) после терапии элькаром в течение 3 нед его содержание в крови увеличилось [4].
При лечении 30 больных с синдромом Ретта (элькар в суточной дозе 30—50 мг/кг; в течение 3 мес) установлено (оценка с помощью балльной шкалы) достоверное снижение выраженности большинства клинических показателей: уменьшились проявления аутизма, повысилась психическая активность и социализация поведения, активизировалась речевая деятельность, улучшились эмоциональные реакции, целенаправленные движения рук и мышечный тонус, появились новые моторные навыки (ходьба, сидение и др.).
После применения элькара (суточная доза 20—30 мг/кг; в течение 3 мес) у всех 50 пациентов с туберозным склерозом отмечены повышение двигательной и общей психической активности, общего фона настроения и параметров устойчивости внимания. У детей школьного возраста улучшались качество оперативной памяти, концентрация, распределение и переключение внимания.
Использование элькара (суточная доза 20 мг/кг : в течение 2 мес — 3 курса в год) у 30 детей с резким дефицитом длины тела, страдающих моногенными синдромами (Нунан, Рассела—Сильвера, Рубинштейна—Тейби и др.), способствовало увеличению скорости роста, достоверному улучшению переносимости физической нагрузки, уменьшению функциональных изменений ЦНС.
Анализ эффективности элькара при выхаживании 87 недоношенных детей и новорожденных с последствиями родовой травмы продемонстрировал, что после 1,5-месячного курса (суточная доза 50 – 100 мг/кг в 3 равных приема перед едой) у всех детей улучшился аппетит, произошла заметная прибавка массы тела, повысилась двигательная активность, улучшилась реакция захвата предметов, значительно активизировалась познавательная деятельность, появилась реакция на музыкальные звуки.
Препараты L-карнитина входят в число основных лекарственных средств, назначаемых в комплексной терапии при заболеваниях сердца, особенно при кардиомиопатиях у детей. Эффективность использования сердечной мышцей жирных кислот в качестве источника энергии тесно связана с уровнем L-карнитина в миокарде. Как показали наблюдения, прием элькара заметно улучшил сократимость сердечной мышцы у 65 детей с кардиомиопатией различной природы (дилатационной, гипертрофической, на фоне первичных митохондриальных синдромов); стойко уменьшилась выраженность симптомов сердечной недостаточности, сократились размеры сердца, более благоприятным стал отдаленный прогноз [5].
В Тверской государственной медицинской академии проанализирована эффективность элькара у 15 детей, страдавших диабетической кардиомиопатией. Его назначали дополнительно к общепринятой метаболической терапии — с целью нормализации метаболических процессов в миокардиоцитах и улучшения выработки энергии в форме АТФ (30 мг/кг в сутки в 2—3 приема в течение 3—4 нед). В результате проведенного лечения у больных нормализовалась диастолическая функция левого желудочка. По данным допплер-эхокардиографии, улучшились скоростные показатели трансмитрального диастолического потока, уменьшилась ригидность миокарда в фазу диастолы. Кроме того, отмечен переход от гипокинетического типа гемодинамики к эукинетическому, что проявлялось увеличением конечного диастолического и ударного индексов, снижением общего периферического сопротивления сосудов. У 11 детей, не получавших элькар в составе кардиометаболической терапии, достоверной положительной динамики показателей трансмитрального диастолического потока и центральной гемодинамики не отмечалось [1].
Сотрудниками Волгоградского государственного медицинского университета проведено динамическое клинико-биохимическое исследование 24 детей в возрасте от 4 до 32 дней жизни, находившихся на лечении в отделении патологии новорожденных по поводу патологической гипербилирубинемии. Комплекс консервативной терапии, помимо внутривенной инфузии растворов глюкозы, эссенциале, энтерального приема витаминов В2, Е, метионина, фенобарбитала и др., дополнительно включал элькар в суточной дозе 50—150 мг/кг (в 2 приема; длительность курса лечения от 14 до 28 дней). Группой сравнения служили 10 новорожденных, получавших то же лечение, за исключением элькара. Исследование показало, что применение элькара в комплексной консервативной терапии неонатальной желтухи способствует ускорению темпов регресса симптомов желтухи, достоверному снижению уровня непрямого билирубина и повышению коэффициента снижения билирубина [3].
В научном Центре здоровья детей РАМН элькар использовался для лечения 170 детей разного возраста (от первых месяцев жизни до 18 лет) с перинатальным неблагополучием в анамнезе и различным исходом патологии нервной системы. При назначении элькара ориентировались на средние возрастные дозы; длительность курсов лечения составляла 1—3 мес.
Клинические эффекты элькара отмечены в сенсорной, двигательной, вегетативной сферах и психическом реагировании при различных патологических состояниях нервной системы. Действие препарата более отчетливо проявилось в ведущем звене нарушения развития (в частности, отмечены улучшение регуляторных процессов у детей с расторможенностью, повышение эмоциональной устойчивости и коммуникативной функции при аутизме) [1].
Таким образом, многочисленные и разносторонние исследования убедительно доказали эффективность элькара для лечения и профилактики различных заболеваний у детей, начиная с самого раннего возраста.