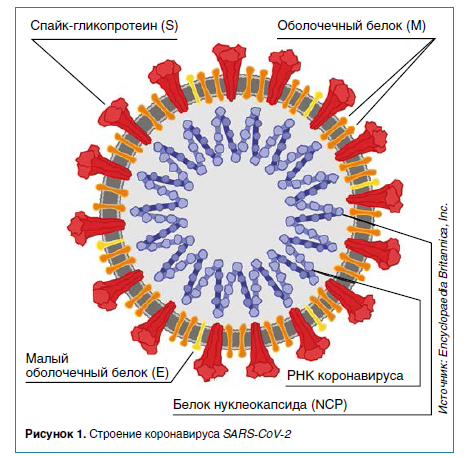
Что такое уровень резистентности при ковиде
Иммунитет к COVID-19: есть или нет?
По данным на 4 декабря в мире зарегистрировано более 65 миллионов случаев заражения COVID-19. По мере распространения вируса ученые узнают все больше о том, как наша иммунная система реагирует на него. Запоминает ли она вирус? Как быстро возникает такая память и как долго хранится? Можно ли заразиться повторно и к чему это приведет? Собрали информацию, известную на данный момент.
Как появляется иммунитет к вирусам?
Спойлер: Долговременную защиту создают потомки В- и Т-клеток, сумевших справиться с вирусом. Первые вырабатывают антитела, а вторые уничтожают клетки, в которые проник вирус.
За специфический иммунитет к вирусам отвечают защитные клетки крови – Т- и В-лимфоциты. Распознав вирус, они активируются и начинают с ним бороться. Т-лимфоциты убивают уже зараженные клетки, подавляя распространение вируса. В-лимфоциты производят антитела, которые нейтрализуют «свободно плавающие» в крови вирусы, не давая им прикрепиться к клеткам. После уничтожения вируса часть знакомых с ним лимфоцитов сохраняется, становясь клетками памяти. Если им снова встретится тот же вирус, иммунный ответ запустится быстрее. В результате инфекция пройдет легче или даже не вызовет симптомов.
Так возникает иммунитет к вирусам, хорошо известным человеку. Но SARS-CoV-2 с нами меньше года и пока неясно, у всех ли появляется иммунитет к вирусу. Также неизвестно, защитит ли иммунитет от повторного заражения, а если нет – будет ли болезнь протекать легче.
Спасут ли нас антитела к COVID-19?
Спойлер: У большинства переболевших людей вырабатываются антитела к вирусу. Но нет уверенности, что они защитят от повторного заражения.
Какую информацию дают тесты на антитела?
Всегда ли появляются антитела к COVID-19?
У большинства пациентов с COVID-19 независимо от наличия симптомов вырабатываются антитела, среди которых преобладают именно нейтрализующие. При этом у некоторых пациентов с легким течением инфекции таких антител может быть мало или совсем не быть. Как правило, выявить IgM в сыворотке можно, начиная с 5–7 дня после возникновения симптомов, а через 28 дней их уровень начинает падать. Обнаружить антитела IgG можно на 7–10 день, их количество начинает уменьшаться примерно через 49 дней. Падение уровня антител часто вызывает опасения, что защита ослабнет и иммунитет пропадет. Но после острой фазы инфекции антител всегда становится меньше, поскольку производящие их В-клетки живут недолго.
Как долго сохраняются нейтрализующие антитела?
Недавно ученые проанализировали данные 30 082 пациентов, переболевших COVID-19 в легкой и среднетяжелой форме. У большинства из них нейтрализующие антитела сохранялись в течение пяти месяцев. Но для получения более точной картины за пациентами нужно наблюдать и дальше – хотя бы в течение года.
Судя по единичным случаям повторного заражения, антитела не гарантируют пожизненного иммунитета к SARS-CoV-2. И это нормально для респираторных инфекций. Иммунитет к коронавирусам, вызывающим MERS и SARS, длится как минимум пару лет, а к коронавирусам, вызывающим простуду – не больше года. Однако наличие антител с большой вероятностью должно смягчить симптомы в случае реинфекции (повторного заражения).
А если антител мало?
Для защиты от SARS-CoV-2 важно не только количество, но и качество антител. Например, у многих выздоравливающих пациентов мало антител, зато они очень хорошо нейтрализуют вирус. Но определять качество антител сложнее и дольше, чем измерять их уровень, поэтому такой подход встречается редко.
Даже отсутствие антител еще не означает отсутствия иммунитета к вирусу. Защищать могут и выжившие В-клетки памяти. Уже на ранних этапах повторной инфекции они быстро размножаются, что приводит к росту уровня специфичных антител.
Главный вопрос – какой уровень антител необходим для защиты. Зная это, мы сможем проводить вакцинацию более эффективно.
Можно ли надеяться на Т-клетки?
Спойлер: Т-лимфоциты могут защитить от SARS-CoV-2, даже если в организме мало специфичных антител или они еще не появились. Именно Т-клетки, а не антитела, могут быть наиболее важными для возникновения стойкого иммунитета к вирусу.
Как меняется уровень Т-клеток при COVID-19?
Уровень Т-клеток повышается как у переболевших COVID-19, так и у получивших одну из экспериментальных вакцин. Специфичные Т-лимфоциты появляются уже в первую неделю после заражения, а Т-клетки памяти – через 2 недели и остаются в организме более 100 дней с начала наблюдения. Если человек перенес COVID-19 бессимптомно и не выработал антитела, единственный способ подтверждения болезни – определение уровня специфичных Т-лимфоцитов. Но оценивать их количество дольше и сложнее, чем измерять уровень антител, поэтому такой метод практически не используют.
Может ли Т-клеточный иммунитет к SARS-CoV-2 быть у тех, кто не болел?
Способные распознать SARS-CoV-2 Т-клетки есть у множества людей, никогда не встречавшихся с ним (судя по оценкам, у 20–50% популяции). Скорее всего, эти клетки возникают при заражении родственными коронавирусами – виновниками простуды. Структуры этих вирусов схожи, и Т-клетка, знакомая с одним из них, может распознать и другой – так возникает «перекрестная реактивность». При этом неизвестно, могут ли такие Т-клетки защитить от заражения SARS-CoV-2, повлиять на ход инфекции и ответ на вакцину. Нужно долго наблюдать за множеством добровольцев с предсуществующим иммунитетом, чтобы увидеть, кто из них заболеет и насколько серьезно.
Можно ли повторно заразиться COVID-19?
Спойлер: Подтвержденные случаи есть, но их мало, и они не позволяют прогнозировать течение заболевания. Скорее всего, случаев повторного заражения будет все больше.
Многие ли заболевают повторно?
Большинство людей до сих пор не заразилось COVID-19 в первый раз, не говоря о втором. Однако уже сейчас есть ограниченные, но убедительные данные о повторном заражении SARS-CoV-2 после выздоровления. Сообщения о таких случаях появлялись неоднократно с начала пандемии, но большая часть из них не была подтверждена. Важно различать настоящую реинфекцию и следы старого вируса, что не всегда просто из-за особенностей диагностики COVID-19.
Как подтвердить повторное заражение?
Стандартные тесты ищут в мазках и образцах слюны генетический материал SARS-CoV-2 – молекулу РНК. В отличие от самого вируса она может долго – до нескольких недель – сохраняться в организме и стать причиной ложноположительного результата теста. Может показаться, что человек снова заразился, и болезнь протекает бессимптомно, но на самом деле это не так. А бывает и ложноотрицательный результат, когда недостаточно чувствительные тесты не находят вирусную РНК, несмотря на присутствие вируса в организме.
Единственный надежный способ подтвердить реинфекцию – расшифровать вирусный геном. SARS-CoV-2 постепенно мутирует, в результате чего возникают его разновидности с небольшими отличиями в РНК – штаммы. Крайне маловероятно, что человек может снова заразиться тем же штаммом вируса. «Прочитав» РНК вируса из старых и новых образцов, а также оценив иммунный ответ в ходе инфекции, можно подтвердить повторное заражение.
Чего ждать при реинфекции COVID-19?
Повторное заболевание может быть как бессимптомным, так и протекать тяжелее, чем в первый раз. Легкое течение инфекции может быть обусловлено защитой Т-клеток, а осложненное – более агрессивным штаммом вируса, чувствительность которого к антителам уменьшилась из-за мутаций.
Когда у нас будет коллективный иммунитет?
Спойлер: Нескоро. Переболело слишком мало людей, и вакцины пока не появились в широком доступе.
Что такое коллективный иммунитет?
Согласно концепции коллективного иммунитета, распространение заболевания в популяции прекращается, когда большая ее часть приобретает устойчивость к возбудителю. У каждого заболевания свой порог защиты – доля людей, у которых должен выработаться иммунитет. Он может возникать естественным способом – после болезни, или искусственным – в результате вакцинации.
Правда ли, что всем нужно переболеть COVID-19?
Полагаться на возникновение группового иммунитета после свободного распространения SARS-CoV-2 – неэтичная и, возможно, неэффективная стратегия. По мнению ВОЗ, в большинстве стран вирусом инфицировано менее 10% населения – значит, до всеобщей устойчивости еще далеко. При летальности инфекции примерно 0,3–1,3%, цена достижения коллективного иммунитета естественным путем может быть слишком высока. Нельзя не учитывать и риск осложнений у пациентов с COVID-19, а также чрезмерную нагрузку на систему здравоохранения, возникающую при таком подходе. Кроме того, мы мало знаем о надежности естественной защиты: возможно, для возникновения стойкого иммунитета нужно будет переболеть несколько раз.
Последний факт может стать проблемой и для вакцинации – более безопасного способа добиться коллективного иммунитета. Если защитный эффект антител будет недолгим, а SARS-CoV-2 продолжит изменяться, нам придется постоянно модифицировать вакцины и прививаться с определенной периодичностью – как в случае с вирусом гриппа.
Пока никто не знает, как долго сохраняется иммунитет к SARS-CoV-2 и какой уровень антител и Т-клеток необходим для защиты. Но информация о новом коронавирусе постоянно обновляется, и со временем ученые найдут ответ на эти вопросы. Предварительные выводы делают на основе данных о родственных коронавирусах, а также исследований на животных и клинических испытаний вакцин, которые идут прямо сейчас. Кажется, что перенесенная инфекция в целом защищает от повторного заражения, подтвержденные случаи которого пока довольно редки. Но ситуация в любой момент может измениться – и к этому нужно быть готовым.
Благодарим врача-инфекциониста Оксану Станевич за помощь в подготовке текста
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Что такое уровень резистентности при ковиде
Своевременная и качественная диагностика – один из ключевых факторов в борьбе с COVID-19: диагностика необходима и для оценки общей эпидемиологической ситуации, и в случае принятия решения по каждому конкретному пациенту. По данным сайта стопкоронавирус.рф на 12.05.2020 г. проведено более более 5,8 миллионов тестов на наличие нового коронавируса. Цифра огромная. Однако, насколько достоверны результаты? Появляется все больше историй о типичной картине COVID-19 при отрицательных анализах. Почему так может происходить?
Сначала поговорим о ПЦР-тестах, которые специфически выявляют РНК вируса в пробах.
Взятие пробы для ПЦР
Показано, что для выявления нового коронавируса подходят смывы из носоглотки – из ротоглотки вероятность ложноотрицательного анализа немного выше [ 1 ]. Один из важнейших аспектов – время взятия материала. Проведенные исследования показывают, что при взятии материала у больного в первый день проявления симптомов COVID-19 положительный диагноз поставят с вероятностью 94 %, а вот к 10-му дню это будет всего лишь 67 %! [ 2 ].
Существует четкая закономерность: чем позже от возникновения симптомов взят материал, тем меньше шансов обнаружить в нем вирусную РНК.
Есть и хорошие новости: в течение первой недели от возникновения симптомов носоглоточные смывы имеют порядок от 100 000 до 1 000 000 копий вирусной РНК в 1 мл, что делает их легко обнаруживаемыми даже не самыми чувствительными системами. Исследования также показали, что вирусная нагрузка в верхних дыхательных путях может быть одинаковой у людей с проявленной симптоматикой и при бессимптомном течении болезни [ 3 ].
Транспортировка и хранение проб для ПЦР
Точность разных ПЦР-тест-систем
После попадания образцов в лабораторию правильность диагноза будет зависеть во многом от тест-системы, которую там используют. На сегодняшний день помимо двух тест-систем, разработанных еще в январе в ГНЦВБ «Вектор», зарегистрировано 8 ПЦР-тест систем [ 5 ]:
Из них системы «Вектора» и «Вектор-Беста» (последняя через сеть лабораторий «Инвитро» [ 6 ]) используются для исследования проб от государственных медицинских организаций. Здесь хочется отметить, что система «Вектора» не содержит в своем составе внутреннего контрольного образца, который должен добавляться во все пробы для контроля правильности выделения РНК и реакции обратной транскрипции [ 7 ]. Отсутствие такого контроля может также потенциально приводить к некоторому количеству ложноотрицательных результатов. Хорошая новость заключается в том, что остальные зарегистрированные тест-системы имеют в своем составе внутренний контроль, а также, по-видимому, обладают более высокой чувствительностью, т.е. дают меньше ложноотрицательных результатов.
Таким образом, в городах, где представлены сетевые лаборатории, есть возможность сдать анализ частным образом и надеяться на точность проведения процедуры. В первые дни появления симптоматики точность будет выше.
Экспресс-системы
Что касается экспресс-тест-систем, то есть опасения, что созданные в сжатые сроки «уникальные» тесты по своему качеству будут уступать системам, основанным на обычной ПЦР. Насколько надежны эти системы покажет время, однако уже сейчас количество ложноотрицательных результатов ПЦР в совокупности с длительностью ожидания результата привело к тому, что в клиниках страны диагноз стали ставить не на основе ПЦР-анализа, а на основе результатов компьютерной томографии (КТ).
КТ
Преимущество КТ-диагностики при наличии клинической картины – это скорость постановки диагноза и более высокая чувствительность по сравнению с реальностью ПЦР-диагностики: 97,2 % против 83,3 % согласно данным небольшого китайского исследования [ 12 ]. Начиная с 4-5 дня заболевания можно различить так называемый симптом «матового стекла», на стадии прогрессирования такие участки консолидируются, возникает симптом «булыжной мостовой», «обратного ореола», а в пиковая стадии – «белое легкое» [ 13 ]. Возникает закономерный вопрос: отличается ли картина пневмонии, вызванной именно новым коронавирусом, от заболеваний другой вирусной природы. Ответ – нет. Вирусные пневмонии, будь то аденовирус, грипп или другие респираторные вирусы, выглядят на КТ одинаково.
Однако в условиях пандемии, когда подавляющее большинство вирусных пневмоний имеют коронавирусную природу, использование КТ для диагностики становится более чем оправданным. В последней версии методических рекомендаций Минздрава по профилактике, диагностике и лечению COVID-19 указано, что «наличие клинических проявлений в сочетании с характерными изменениями в легких по данным КТ или обзорной рентгенографии органов грудной клетки вне зависимости от результатов однократного лабораторного исследования на наличие РНК SARS-CoV-2 и эпидемиологического анамнеза» является клинически подтвержденным случаем COVID-19 [ 14 ]. Отметим также, что объем поражения легких при РГ и КТ может не иметь прямой корреляции с клинической тяжестью заболевания.
ИФА (иммуноферментный анализ)
ПЦР-тест-системы, как и КТ-диагностика выявляет COVID-19 в острой фазе. Однако весьма актуальна и информация об уже переболевших, на основании которой можно судить об охвате населения заболеванием, а также о числе бессимптомных случаев. Ответы на эти, а также на многие другие вопросы, может дать тест-система на антитела. На сегодняшний день разработкой таких тест-систем помимо «Вектора» занимаются такие организации как «Вектор-Бест», «НПО «Диагностические системы», ФНКЦ ФХМ ФМБА России, «МБС-Технологии», а также «Генетико» и Институт молекулярной биологии РАН [5]. К сожалению, тест-системы на антитела требуют намного больших усилий и времени на разработку, чем ПЦР-системы, а их чувствительность и специфичность оставляет желать лучшего. Так, проведенное в США исследование доступных система на антитела показало, что лишь 3 из 14 систем дают надежные результаты (т.е. не более 1% ложноположительных результатов), но при этом их чувствительность не превышает 90% относительно положительных контрольных образцов [ 15 ]. Какова будет чувствительность и специфичность разрабатываемых российских систем – пока неизвестно.
Итак, самое разумное, что вы можете сказать клиентам:
Регистрируйся на нашем сайте и получай доступ ко в сем материалам о COVID-19 в специальном разделе.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
