Что такое цитотоксическое действие
Что такое цитотоксическое действие
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.
Что такое цитотоксическое действие
Цитотоксические аллергические реакции (гиперчувствительность II типа)
Аллергические реакции II типа могут носить системный или локализованный характер. Цитолитические реакции имеют место при переливании несовместимых групп крови, резус-несовместимости матери и плода, лежат в основе развития ряда аутоиммунных заболеваний, в частности, аутоиммунной лейкопении, анемии, тромбоцитопении, а также трансплантационного иммунитета и других форм патологии.
При аллергических реакциях II типа индуктором аллергии является антиген клеточной мембраны.
Возможны два основных варианта подобных антигенов:
1. Антиген является структурным компонентом клеточной мембраны (антигены гистосовместимости – МНС I и МНС II, Rh-антигены эритроцитов, антигены эритроцитов системы АВО и др.);
2. Органоспецифические антигены, модифицированные под влиянием ксенобиотиков, инфекционных патогенных факторов, воздействий физической или химической природы на структуру клеток.
Антигены, индуцирующие развитие цитолитических реакций, могут иметь и внеклеточное происхождение (антигены миелина, коллагена, базальной мембраны клубочков почек).
В отличие от анафилактических реакций при ряде цитотоксических реакций антиген-аллерген персистирует в организме, выполняя роль сенсибилизирующей и разрешающей доз воздействия, т.е. вызывает выработку антител-агрессоров и вступает с ними в реакции взаимодействия на клеточном уровне. Подобный феномен имеет место при аутоиммунных заболеваниях, трансплантационном иммунитете. В тех случаях, когда аллерген является естественным компонентом мембраны клеток (групповые или Rh-антигены эритроцитов) реакции развиваются при введении в организм комплементарных антител.
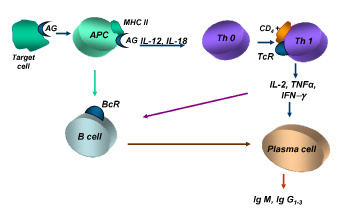
Антигенпрезентирующие клетки на фоне антигенной стимуляции обеспечивают не только экспрессию на цитоплазматических мембранах модифицированной части антигена в комплексе с белками гистосовместимости MHC II, но и интенсивную продукцию IL-12 и IL-18. Последние вызывают пролиферацию антигенчувствительного клона Th1. В свою очередь Th1 секретируют γ-интерферон, IL-2 и TNF-α, обеспечивающие переключение биосинтеза иммуноглобулинов в дифференцирующихся В-лимфоцитах с IgМ на IgG. Ответственными за развитие цитолитических реакций являются комплементсвязывающие цитолитические антитела классов IgG1, IgG2, IgG3 и IgM (рис. 1).
Рис. 1. Индукция иммунного ответа при цитотоксических реакциях
Различают три основных механизма цитолиза клеток в реакциях II типа:
• антителозависимая клеточная цитотоксичность;
• антителозависимый фагоцитоз опсонизированных клеток.
Комплементзависимый цитолиз обусловлен активацией комплемента комплексом антиген-антитело на мембране клеток по классическому пути, что приводит к формированию гидрофильного канала в мембране клетки с последующим развитием осмотического лизиса клетки.
Антителозависимая клеточная цитотоксичность возникает в том случае, если Fab-фрагменты аллергических антител связаны с антигеном клеточной мембраны, а к свободным Fc-фрагментам антител фиксируются макрофаги, эозинофилы, нейтрофилы с помощью соответствующих рецепторов. Нейтрофилы, макрофаги и NK-клетки обеспечивают цитолиз, взаимодействуя с Fc-фрагментом IgG, эозинофилы обеспечивают цитолиз при участии IgE и IgA.
В механизмах развития цитотоксичности при участии различных видов лейкоцитов важная роль отводится активации лизосомальных ферментов, освобождению катионных белков, лейкотриенов, лейкокининов, миелопероксидазы, свободных радикалов, вызывающих деструкцию клеток мишеней. Фагоцитоз опсонизированных клеток происходит в соответствии с общеизвестными закономерностями: разрушение клеток мишеней обеспечивается действием гидролитических ферментов в фаголизосомах, а также участием кислородзависимых и кислороднезависимых систем киллинга.
В последнее время выделяют четвертый механизм повреждающего действия на клетки-мишени, сопровождающийся развитием антителозависимой клеточной дисфункции (в ряде источников именуемые как рецепторно-опосредованные аллергические реакции, или V тип гиперчувствительности).
В роли антигенов при указанных реакциях выступают нейромедиаторы или гормоны (ацетилхолин, инсулин, тиреотропный гормон), индуцирующие синтез антител главным образом класса IgG.
Последние взаимодействуют со структурами, расположенными в рецепторном комплексе, вызывая стимулирующий или ингибирующий эффект на клетку-мишень.
Примером рецепторно-опосредованного стимулирующего типа аллергических реакций является развитие гипертиреоидного состояния при имитации антителами эффектов тиреотропного гормона. Описана возможность ингибирующего влияния антител на клетки и подавление ими эффектов инсулина.
Иммунокомплексные аллергические реакции (гиперчувствительность III типа)
Иммунокомплексная патология может носить локализованный и системный характер.
К местным проявлениям иммунокомплексной патологии относятся феномен Артюса, некоторые случаи лекарственной и пищевой аллергии. В ряде случаев иммунокомплексная патология приводит к развитию системных заболеваний (сывороточная болезнь, аутоиммунные заболевания, в частности гломерулонефрит, ревматоидный артрит, системная красная волчанка, артриты, эндокардит).
К числу аллергенов, вызывающих развитие иммунокомплексной патологии, относятся различные лекарственные препараты, антитоксические сыворотки, гамма-глобулины, пищевые, ингаляционные, вирусные и бактериальные аллергены.
К факторам риска развития иммунокомплексных реакций относится наследственная или приобретенная недостаточность системы элиминации иммунных комплексов, т.е. фагоцитоза, системы комплемента, недостаточность экспрессии CR1-рецепторов на мембранах эритроцитов, способных адсорбировать иммунные комплексы.
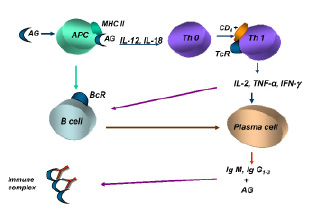
Механизмы развития иммунокомплексной патологии могут быть представлены следующим образом (рис. 2):
• презентация антигена макрофагами в комплексе с белками II класса МНС Тh1 и антигенчувствительным клонам В-лимфоцитов;
• секреция Тh1 гуморальных индукторов иммунопоэза ИЛ-2 и гамма-интерферона;
• стимуляция пролиферации и дифференцировки соответствующих антигенчувствительных клонов В-лимфоцитов, усиление продукции преципитирующих и комплементсвязывающих антител классов IgG1, IgG2, IgG3 и IgM.
Рис. 2. Индукция иммунного ответа при иммунокомплексных реакциях
При развитии иммунокомплексной патологии изначально ни антиген, ни антитело не связаны с клеточной мембраной. Образование высокотоксических растворимых комплексов происходит в системной циркуляции при условии взаимодействия антигена с антителом при небольшом избытке антигена; ММ токсических комплексов составляет 900`000 – 1`000`000. Они плохо фагоцитируются и долго находятся в организме.
Иммунные комплексы обладают способностью отслаивать эндотелий и фиксироваться на базальной мембране сосудов. При этом возникают обнажение коллагена, активация XII фактора Хагемана и связанного с ним каскада реакций освобождения медиаторов воспаления: активация калликреин-кининовой системы, коагуляционного и тромбоцитарного звеньев системы гемостаза, системы фибринолиза.
Для иммунокомплексных реакций характерно развитие выраженных расстройств микроциркуляции в различных органах и тканях, формирование циркуляторной гипоксии, снижение трофики органов и тканей, повышение проницаемости сосудистой стенки и другие нарушения.
Важная роль в патогенезе иммунокомплексной патологии отводится и медиаторам тучных клеток, тромбоцитов, нейтрофильных и базофильных лейкоцитов, активирующихся при участии антигена и системы комплемента.
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Что такое цитотоксическое действие
Материалы и методики исследования
В работе использовали химически синтезированные пептиды. Исследовали их цитотоксическое действие в отношении клеток эритромиелоидной лейкемии человека К-562 и клеток гистиоцитарной лимфомы человека U-937. Клетки культивировали в среде RPMI-1640, дополненной глутамином, гентамицином и 10% эмбриональной телячьей сывороткой. Для оценки жизнеспособности клеток после их обработки пептидами в качестве маркера клеточной гибели использовали краситель трипановый синий. К суспензии клеток добавляли 0,4%-й раствор трипанового синего и подсчитывали в камере Горяева под микроскопом количество клеток, включивших краситель (количество погибших клеток) и не включивших краситель (количество живых клеток).
Активность каспазы 3 определяли колориметрическим методом по скорости расщепления синтетического субстрата Ac-DEVD-pNAс помощью набора «Caspase 3 AssayKit, Colorimetric» («Sigma», США). Клетки (1 млн/мл) инкубировали с разными концентрациями пептидов в течение 3 часов при 37°С; объем проб составлял 150 мкл, использовали по три параллели. Контролями служили пробы, в которых клетки инкубировали в тех же условиях, но без добавления пептидов. По окончании инкубации клетки центрифугировали 10 мин при 300 g, к полученным осадкам добавляли лизирующий раствор и оставляли их на ледяной бане на 30 мин. Далее пробы центрифугировали 20 мин при 10000 g при 4°С. Супернатанты отбирали и использовали для приготовления проб в соответствии с рекомендациями изготовителей набора «Caspase 3 AssayKit, Colorimetric». Полученные пробы в 96-луночных планшетах инкубировали при 37°С в течение 3 часов, затем оптическую плотность измеряли на спектрофотометре Sectra Max 250 при 405 нм. Активность каспазы представляли в процентах от контроля (клетки без пептида).
Статистическую обработку данных проводили в программе Statistica 6. Графики строили в программе SigmaPlot 11.
Результаты исследования и их обсуждение
Ранее было показано, что антимикробные пептиды бактенецин ChBac3.4 и протегрин 1 (PG1) оказывают токсическое действие на опухолевые клетки [13]. Целью данной работы явилось изучение механизмов этого действия. Чтобы оценить, насколько быстро реализуются токсические эффекты PG1 и ChBac3.4 на клетки-мишени, изучали динамику их цитотоксического действия в отношении клеток U-937 (клетки гистиоцитарной лимфомы человека) и К-562 (клетки эритромиелоидной лейкемии человека), инкубируя клетки с пептидом в течение 15, 30, 60, 120 и 180 мин и оценивая количество живых и мертвых клеток с использованием витального красителя трипанового синего.
На рис. 1 (а, б) представлены данные, полученные после инкубации клеток с PG1.