Что такое циторедуктивная операция
Материалы конгрессов и конференций
IV РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ЦИТОРЕДУКТИВНЫЕ ОПЕРАЦИИ ПРИ РАКЕ ЯИЧНИКОВ
К.И. Жорданиа
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Рак яичников является частым онкогинекологическим заболеванием, занимая второе место по частоте возникновения и первое по смертности. Среди всех онкологических патологий у женщин рак яичников твердо занимает четвертое место по летальности, и в последнее десятилетие отмечается его значительное омоложение.
Как известно, основные роли в терапии рака яичников принадлежат трем методам лечения: хирургическому, лекарственному и лучевому.
Оперативному вмешательству в настоящее время придается первостепенное значение как самостоятельному методу и как важнейшему этапу в комплексе лечебных мероприятий. Лапаротомия позволяет произвести тщательную ревизию органов брюшной полости и забрюшинного пространства, способствует морфологической верификации диагноза, определению степени дифференцировки опухоли и, что самое главное, позволяет удалить опухолевую ткань целиком или частично.
При злокачественных опухолях яичников операцией выбора считается экстирпация матки с придатками, резекция большого сальника. В последние два десятилетия объем оперативного вмешательства несколько расширился. Некоторые исследователи призывают дополнительно производить аппендэктомию, спленэктомию, резекцию пораженных отделов кишки, а также забрюшинную лимфаденэктомию.
На последней хотелось бы остановиться несколько подробней в связи с важностью обнаружения метастазов этих локализации в правильном определении стадии процесса и, следовательно, адекватности терапии и оценке прогноза заболевания.
Данные литературы свидетельствуют о том, что даже у больных I-II стадиями рака яичников более чем в 30% наблюдений и только при целенаправленном исследовании диагностируются метастазы в забрюшинные лимфоузлы различных локализаций. Поэтому разработанные классификации FIGO и TNM, неоднократно модифицированные, не полностью удовлетворяют онкологов, т.к. даже несмотря на многочисленные поправки, они остаются весьма условными (1,2).
Реально подходя к пониманию данного вопроса, можно прийти к заключению, что, вероятно, существует, по крайней мере, две стадии при раке яичников: истинно первая, при которой процесс ограничен яичником, и вторая, при которой процесс приобрел уже системный характер. Правда, определить эту грань между стадиями в настоящее время практически невозможно. А если учесть еще и возможность редкого, но все же встречаемого эктопического возникновения эпителиальных злокачественных опухолей яичников, то определение стадии процесса вызывает еще большие трудности.
Сложность пальпаторной и визуальной диагностики метастазов в забрюшинные лимфоузлы объясняется тем, что даже пораженные опухолью лимфоузлы бывают не увеличенными, плотноэластической консистенции, свободно или относительно смещаемыми. Кроме того, забрюшинно только в парааортальной зоне насчитывается от 80 до 120 лимфоузлов, и практически каждый из них может быть поражен метастазами (3,4,5,6).
Крайне ярко проявляется вышесказанное клинически. Большинство исследователей отмечают высокую частоту рецидивов: от 23% у больных с «ранними стадиями» заболевания, которым была проведена операция в полном объеме с последующей, хоть и редуцированной, химиотерапией.
Учитывая вышеизложенное, становится понятным, насколько сложным является установление стадии болезни при раке яичников и насколько важную роль это играет в выработке адекватной терапии, а, следовательно, и в прогнозе заболевания.
Теоретически тотальная забрюшинная лимфаденэктомия должна приводить к лучшим результатам выживаемости, однако, те немногочисленные авторы, которые имеют достаточный опыт в проведении подобных операций, отмечают целый ряд осложнений, вплоть до летальных исходов.
Касаясь вопроса лечебной тактики при так называемых «ранних стадиях» заболевания, необходимо подчеркнуть, что в настоящее время и, вероятно, в обозримом будущем, терапия должна начинаться только с операции, независимо от возраста женщины и ее желания иметь детей, потому что, только после лапаротомии можно получить максимальную информацию о состоянии заболевания (2). При этом хирурги должны стремиться к максимальному радикализму с учетом частоты рецидивов и метастазов, о чем говорилось выше. Столь жесткий подход продиктован крайне низкой выживаемостью больных раком яичников.
Конечно же, реалистически подходя к вопросу лечебной тактики при ранних стадиях заболевания, приходится признать, что не все больные оперируются радикально. В ряде случаев, явно рискуя, хирурги вынуждены идти навстречу пожеланиям молодых женщин, которые, по тем или иным мотивам, не соглашаются на радикальное оперативное лечение. В подобных случаях необходим строгий индивидуальный подход. Органосохраняющие операции возможны, но лишь при самом тщательном исследовании контралатерального яичника, придатков, цитологическом и гистологическом исследовании операционного материала с определением степени дифференцировки опухоли, ее пролиферативного потенциала и других биологических параметров.
Значительно больше проблем возникает перед клиницистами при лечении больных с далеко зашедшими стадиями заболевания. Поэтому подавляющее число публикаций как отечественных, так и зарубежных авторов посвящено именно больным этой категории. В настоящее время ни у кого не вызывает сомнений необходимость при первичном лечении этих больных применения комбинированных или комплексных методов лечебных мероприятий. В то же время отдельные стороны и детали комбинированного лечения продолжают носить противоречивый характер в связи с большим количеством мнений различных исследователей, касающихся тактики, схем химиотерапии, этапности, длительности лечения и т.д.
Изучая значение последовательности лечебных воздействий при III-IV стадиях рака яичников, уже давно пришли к выводу, что вариант «операция + химиотерапия» значительно улучшает выживаемость пациенток при сравнении с таковыми, которым на первом этапе было проведено лекарственное лечение (7,8,9). Данное утверждение можно обосновать и чисто теоретически:
- 1) неэффективность фармакологических препаратов снимается удалением основной массы опухоли со слабым кровотоком;
2) эффективность химиопрепаратов связана с высокой митотической активностью малых опухолей;
3) наименьшие остаточные опухоли требуют меньшего количества курсов химиотерапии, в то время как при больших массивах повышается вероятность появления резистентных форм;
4) удаление основных опухолевых масс приводит к относительной нормализации иммунной системы пациентки;
5) удаляются по возможности фенотипически резистентные опухолевые клетки.
Ниже мы постараемся коротко расшифровать перечисленные критерии возможной эффективности циторедуктивных операций.
Для солидных новообразований характерен сравнительно бедный кровоток, что снижает концентрацию фармакологического препарата в опухолевых тканях и, соответственно, эффективность проводимого лечения. Особенно это проявляется в центральных областях опухоли, где часты обширные некрозы, связанные с нарушением трофики тканей. К некротическим участкам примыкают кровоснабжающиеся из мелких сосудов многочисленные, особенно жизнеспособные участки злокачественных тканей. Такое представление подтверждается, правда косвенно, низким содержанием свободной глюкозы и высоким уровнем молочной кислоты во внутритканевой жидкости солидных опухолей. Все это приводит к временному снижению митотической активности злокачественных клеток и в результате к снижению эффективности проводимой химиотерапии, тропной к ДНК клетки только в определенную фазу.
Для максимального эффекта большинства фармакологических агентов необходима фракция клеток с быстрым ростом, поэтому при удалении основной массы малочувствительных к химиотерапии клеток остаются более чувствительные небольшие очаги (диссеминаты), обладающие высокой митотической активностью.
Кроме того, удаление большой массы опухоли приводит к восстановлению относительной иммунокомпетентности организма-опухоленосителя, в первую очередь за счет снижения иммуносупрессии, индуцированной неоплазмой, и, как следствие, отмечается повышение активности клеточного иммунитета.
В связи с этим в настоящее время рекомендуются следующие стандартные положения для оперативных вмешательств:
Первичная циторедуктивная операция предусматривает удаление максимально возможного объема опухоли и метастазов перед началом лекарственной терапии. Первичная циторедуктивная операция является стандартом помощи при распространенном раке яичников, особенно при Ш стадии заболевания. Целью циторедуктивной операции должно являться полное удаление опухоли или оставление ее минимального объема по окончании операции. Роль циторедуктивной операции при IV стадии по FIGO противоречива, но больные с наличием только плеврального выпота, метастазами в надключичные лимфоузлы или единичными кожными метастазами могут лечиться, как при III стадии заболевания. Не показан данный объём операции больным с метастазами в печень и легкие. С другой стороны, неоадъювантная химиотерапия является приемлемой альтернативой циторедуктивной операции при IV стадии заболевания или у больных, у которых заболевание не может быть оптимально уменьшено в связи с техническими трудностями.
Промежуточная циторедуктивная операция операция выполняется после короткого курса индукционной химиотерапии (обычно 2-3 курса). Выполнение операции на данном этапе является приемлемым подходом в терапии пациенток, у которых первая операция была либо пробной, либо малоуспешной.
Вторичная циторедуктивная операция. Большинство вторичных циторедуктивных операций выполняются при локализованных рецидивах, возникших после комбинированного лечения. Предварительный анализ показал, что кандидаты для выполнения подобных операций могут быть определены с учетом факторов прогноза. Чаще всего это опухоли, которые рецидивируют спустя год и более после завершения первичного лечения и адекватно отвечали на проводимую ранее химиотерапию.
Паллиативные операции в основном производятся для облегчения состояния больной, например, при кишечной непроходимости на фоне спаечного процесса или прогрессировании заболевания.
Однако, несмотря на столь весомые аргументы в пользу операций, производимых на первом этапе, существуют и их противники, которые выдвигают целый ряд критических замечаний, с которыми нельзя не считаться (10,11,12). Так, например, отмечается высокий процент послеоперационных осложнений, отсрочено начало столь необходимого лекарственного лечения и, наконец, утверждается, что комбинированная химиотерапия не менее эффективна, а подчас заменяет циторедуктивную операцию. К сожалению, соответствующие рандомизированные проспективные исследования по изучению целесообразности первичного удаления опухоли еще не проводились. Однако, доказана большая продолжительность жизни больных после отсроченного удаления опухоли (после 3-х курсов химиотерапии препаратами платины) по сравнению с больными, которым хирургическое лечение вообще не проводилось. Кроме того, во всех ретроспективных исследованиях показано, что продолжительность жизни больных обратно пропорциональна величине остаточной опухоли к моменту начала химиотерапии (10,11,12).
В заключение необходимо отметить, что к настоящему времени, методы оперативного лечения при раке яичников практически не изменились, за небольшим исключением, в то время как лекарственное лечение стало более эффективным и продолжает совершенствоваться. Появились новые перспективные методы консервативной терапии на стыке генетики, иммунологии, химиотерапии и лучевого лечения. Поэтому следует признать, что рак яичников является прерогативой консервативной медицины.
1) Berek JS, Hacher NF. Staging and second-look operations in ovarian cancer. In: Alberts DS, Sur-vit EA, eds. Ovarian cancer. Boston: Martinus Nijhoff,1985-109-27.
2) Young RC, Decker DG, Wharton JT, Piver MS, Sindelar WF, Edwards BK, et al. Staging laparot-omy in early ovarian cancer. JAMA 1983;250:3072-6.
3) Eadson DF, Ford D, Bishop DT. Breast and ovarian cancer incidence in BRCA-1-mutation car-ries. Am J Genet 1995;56:265-71.
4) Plentl FV, Friedman EA. Lymphatic system of the Female Genitalia. Philadelphia: WB Saun-ders;1971.
5) Burghard E, Hellmuth P, Lahousen M, Stettner H. Pelvic Lymphadenectomy in operative treat-ment of ovarian cancer. Am J Obstet Gynecol 1986;155:315-9.
6) Chen SS, Lee L. Incidence of paraaortic and pelvic lymph node metastasis in epithelial ovarian cancer. Gynecol Oncol 1983;16:95-100.
7) Skipper HE, Adjuvant chemotherapy. Cancer 1978;41:936-40.
8) Goldie JH, Coldman AJ. Cancer Trat Rep.1979;63:1727-33.
9) Bookman M, Berek JS. Biologic and immunologic therapy of ovarian cancer. Hematol Oncol Clin North Am 1992;6:941-65.
10) Hunter RW, Alexander NDE, Soutter WP. Am J Obstet Gynecol 1992;166:504-1.
11) Van der Burg MEL, van Lent M, Buyse M, Kobierska, Colombo N, Favalli G.N Engl J Med. 1995:332:629-34.
12) Berek JS. Interval debulking of epithelial ovarian cancer: an interim measure. N Engl J Med.1995;332:675-7.
Канцероматоз брюшины: кому и зачем нужны циторедуктивная операция и HIPEC
Злокачественные опухоли могут метастазировать — распространяться на другие ткани и органы. Если первичная опухоль расположена в брюшной полости, она может распространиться по брюшине — это состояние называется перитонеальным канцероматозом. Такой вариант течения болезни значительно ухудшает прогноз — в среднем, в зависимости от вида опухоли и полученного лечения продолжительность жизни человека составляет от полугода до двух лет. Долгое время пациентам с канцероматозом брюшины могли предложить только паллиативную помощь, но появились и другие методы.
Рассказываем о циторедуктивной операции и гипертермической внутрибрюшинной химиотерапии (HIPEC), которые могут продлить жизнь людям с таким диагнозом.
Этот текст мы написали вместе с Онкоцентром «СМ-Клиника».
Что такое перитонеальный канцероматоз?
Брюшина — оболочка, выстилающая стенки брюшной полости, таза и поверхность внутренних органов — печени, матки, яичников, селезенки, кишечника. Любой патологический процесс, затрагивающий брюшную полость, может распространяться по брюшине за счет движения жидкости и клеток в этом пространстве. Например, эпителиальные опухоли яичников возникают из эпителия маточных труб, который сообщается с брюшиной. Из-за роста опухоли злокачественные клетки «отслаиваются» и могут свободно плавать в перитонеальной жидкости. Как правило, эти клетки имплантируются в область таза и другие части брюшины.
Канцероматоз выглядит как множество опухолевых узлов, покрывающих брюшину. Размер и количество узлов могут быть различными.
При каких опухолях чаще всего развивается канцероматоз брюшины?
Перитонеальный канцероматоз у женщин чаще всего развивается при раке яичников, а у мужчин — при раке толстой кишки и желудка. Например, при раке желудка опухолевые узлы на брюшине возникают у 60% пациентов.
В более редких случаях канцероматоз брюшины может быть самостоятельным заболеванием. Иногда расположение первичной опухоли установить не получается.
Какие симптомы могут указать на перитонеальный канцероматоз?
У этого состояния неспецифические признаки. Среди них:
— увеличение объема живота из-за скопления жидкости в брюшной полости — асцит
— тошнота, вздутие живота
— необъяснимая потеря веса
Злокачественный (то есть вызванный опухолью) асцит, в свою очередь, может вызывать другие симптомы, среди которых:
Перитонеальный канцероматоз может вызывать кишечную непроходимость. В этом случае продвижение содержимого желудка и кишечника через ЖКТ затруднено или отсутствует. Злокачественная кишечная непроходимость чаще встречается у пациентов с раком яичников и колоректальным раком.
Как диагностируют канцероматоз брюшины?
Заподозрить перитонеальный канцероматоз можно с помощью УЗИ, КТ и МРТ брюшной полости и малого таза.
В частности, КТ брюшной полости позволяет приблизительно оценить, насколько опухоль распространена. МРТ будет эффективнее для осмотра малого таза и позволит врачу оценить степень поражения находящихся там органов, например матки, мочевого пузыря.
Однако эти методы позволяют обнаружить только крупные очаги — опухолевые узлы до 5 мм редко отчетливо видны во время УЗИ, КТ и МРТ. Наибольшей точностью обладает лапароскопия: через прокол врач вводит в брюшную полость камеру, осматривает брюшину и, если необходимо, проводит биопсию — забирает часть опухоли на исследование.
Почему канцероматоз брюшины сложно лечить?
«Традиционные» методы лечения онкологических заболеваний — лучевая терапия, операция — не эффективны в случае с канцероматозом брюшины. Облучать такую большую область слишком опасно. Не все опухолевые очаги можно удалить хирургическим путем — метастазы могут быть очень маленького размера, незаметными для врача, или располагаться в труднодоступном месте. Оставшиеся опухолевые клетки спровоцируют рецидив заболевания.
Стандарты лечения канцероматоза брюшной полости включают системную химиотерапию, облегчение симптомов. В последние годы в списке методов появились циторедуктивная операция и HIPEC — гипертермическая внутрибрюшинная химиотерапия.
Что такое циторедуктивная операция и HIPEC?
Для этого брюшную полость пациента промывают нагретым до 42°C градусов раствором химиопрепаратов. В брюшную полость устанавливают катетеры, через которые в организм пациента попадает раствор. Такой способ введения позволяет охватить все отделы брюшной полости. Для отслеживания температуры в брюшную полость помещают датчики.
Местное, а не системное (внутривенное) применение цитостатиков позволяет увеличить дозу препаратов и при этом избежать побочных явлений. Высокая температура в сочетании высокими дозами химиотерапии усиливают противоопухолевый эффект.
Спустя примерно час–полтора раствор удаляют из брюшной полости, промывают ее физраствором и зашивают. В общей сложности такое вмешательство занимает 8–10 часов.
 |
Техник наблюдает за процессом HIPEC-терапии
Кому может подойти такой метод лечения?
Отдельные исследования и мета-анализы демонстрируют эффективность этого метода — циторедуктивная операция в сочетании с гипертермической внутрибрюшинной химиотерапией увеличивает продолжительность жизни пациентов с перитонеальным канцероматозом. Например, в этом исследовании приняли участие пациентки с III стадией эпителиального рака яичников. Авторы приходят к выводу, что добавление гипертермической внутрибрюшинной химиотерапии к циторедуктивной операции увеличивает период без прогрессирования заболевания, общую продолжительность жизни и не повышает количество побочных эффектов по сравнению с циторедуктивной операцией.
Эта лечебная опция считается оптимальным вариантом лечения пациентов с опухолями аппендикса и псевдомиксомами брюшины.
Предполагается также, что профилактическое применение HIPEC может снизить риск развития канцероматоза брюшины в будущем. Не так давно появились данные о положительных результатах профилактического применения HIPEC при раке ободочной кишки, желудка и поджелудочной железы.
Кому циторедуктивная операция и HIPEC не подходят?
Необходимость таких вмешательств определяется исходя из истории болезни, тщательного обследования и общего состояния пациента. Циторедуктивную операцию в сочетании с HIPEC могут не провести, если:
— метастазы вышли за пределы брюшины
— заболевание прогрессирует несмотря на проведенную ранее химиотерапию
— есть кишечная непроходимость, вызванная опухолью
— общее состояние пациента тяжелое
— есть высокая опухолевая нагрузка — опухолевые импланты покрывают значительную часть толстой и тонкой кишки
В целом, исследования, оценивающие эффективность метода, как правило, основаны на результатах нерандомизированных испытаний.
Безопасность процедуры пока изучается. Например, авторы этого исследования пришли к выводу, что циторедуктивная операция в сочетании с HIPEC безопасна и чаще даже безопаснее в сравнении с другими широко распространенными онкологическими процедурами, в частности, операцией Уиппла (способ лечения рака поджелудочной железы — прим. ред.). Однако и сами авторы, и их коллеги отмечают, что у исследования есть недостатки, прежде всего, касающиеся выбора пациентов. У людей с раком поджелудочной железы в большинстве случаев нет других альтернатив, кроме операции Уиппла, а пациенту с перитонеальным канцероматозом можно предложить несколько вариантов: паллиативную терапию, циторедуктивную операцию без HIPEC, — чтобы выбрать оптимальный в конкретном случае способ лечения.
Кроме того, не существует единых протоколов, регламентирующих такое лечение: во время HIPEC могут использоваться различные химиопрепараты, температура, время промывания брюшной полости.
Таким образом, окончательное решение о выборе стратегии лечения пациент и врач должны принять, взвесив все «за» и «против».
Проконсультировать по вопросам назначения циторедуктивной операции в сочетании с HIPEC смогут специалисты Онкоцентра «СМ-Клиника». Врачи Онкоцентра оказывают различные виды помощи пациентам с онкологическими заболеваниями, в том числе проводят циторедуктивные операции с последующей процедурой HIPEC.
Главное меню
Главное меню
Циторедуктивные технологии лечения рака предстательной железы
Настоящее лечение рака предстательной железы – это «ветер перемен». Как и в любой другой специальности в онкологическом лечении существует правило: местное заболевание – местная терапия; системное заболевание – системная терапия. Данный подход, например, использовался при лечении рака желудка, когда при местно-распространенном процессе удаляют часть брюшины.
Сегодня это правило не работает, при лечении большинства онкологических заболеваний оно ушло в прошлое. Необходимо постоянно помнить, что циторедуктивный подход не является стандартной процедурой, при его применении необходимы желание пациента и подписанное информированное согласие. Нужно быть готовым к тому, что если планируется циторедуктивная операция, то большинство пациентов будут искать второго мнения, или пожелают получить его уже после выполнения лечения.
При рассмотрении проблем циторедуктивного лечения очень важным является вопрос взаимоотношений «доктор-пациент». Самой распространенной моделью является «патриархальная». В этой модели врач думает: «Я знаю, что для вас лучше». Такая модель должна остаться в прошлом. Сегодня многим специалистам трудно принять решение пациента о получении второго мнения. Это вызывает негативные эмоции и негодование у докторов.
Современные права пациентов гласят: «Вы можете получить второе мнение:
Так, например, получение «второго мнения» European Consensus Group в 2006 г. при раке яичка дало неожиданные результаты, заключающиеся в том, что в 30% случаев не соблюдались рекомендации EAU по ведению и лечению таких пациентов. Результат применения системы «второго мнения»: в 40% случаев лечебная тактика была изменена (Schrader M., 2009).
Ситуация в государственной системе здравоохранения: каждый вид лечения оплачивается для каждого пациента. Но во многих медицинских областях, особенно в онкологии, пациенты, по крайней мере, частично оплачивают свое лечение после самостоятельного принятия решения о виде лечения совместно с лечащим врачом. Получение второго мнения стимулирует к заметным изменениям в лечении системного и местно-распространенного РПЖ.
Обычная ситуация при диагностированном РПЖ:
Что делать в такой ситуации? Перенимать подходы из других областей онкологии, например, лечения генитального рака у женщин или почечно-клеточного рака. Это обеспечивает лучшую выживаемость у пациентов после полной резекции опухоли даже при метастатическом заболевании, а также прогностическое преимущество пациентов после идеальной резекции отдаленных метастазов в легком, печени и мозге.
На основании данных G. Swanson и др. стало известно, что специфическая выживаемость при РПЖ с метастазами в лимфоузлах увеличивается до 70% после простатэктомии и гормональной абляции в сравнении с 30%-ой выживаемостью без циторедуктивной хирургии. Местно-распространенный РПЖ (≥ pT3) показал лучшие показатели выживаемости у больных после радикальной простатэктомии и андрогенной блокады.
В случае инвазии опухоли предстательной железы в шейку мочевого пузыря, радикальная цистопростатэктомия, сопровождаемая адъювантной гормональной терапией, может привести к хорошему местному онкологическому контролю, так же как и к лучшей РПЖ- специфической выживаемости: до 92% даже в случае метастазов в лимфатических узлах (Kumazawa T., 2009).
В случае РПЖ с метастазами в кости скелета экспериментальная циторедуктивная хирургия у определенной части пациентов (хорошее общее состояние, ПСА менее
100 нг/мл, небольшое число метастазов) могла бы привести к более длительному ответу при системном лечении (Swanson G., 2006).
Клинический случай
Мужчина, 63 лет, в отличной физической форме без боли и особого беспокойства по поводу своей болезни. В 2009 г. установлен диагноз распространенного РПЖ на основании:
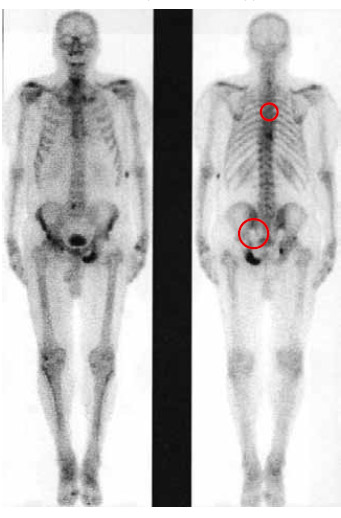
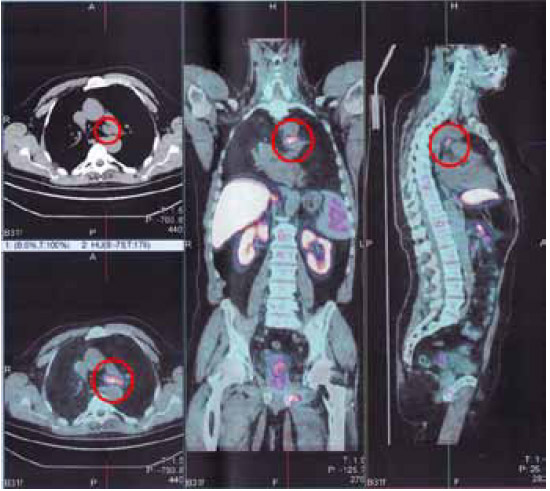
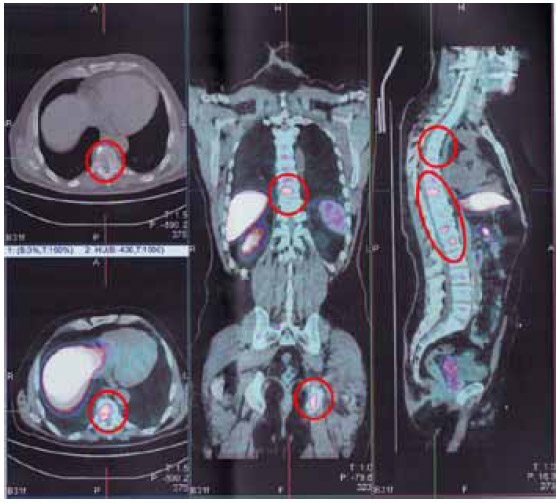
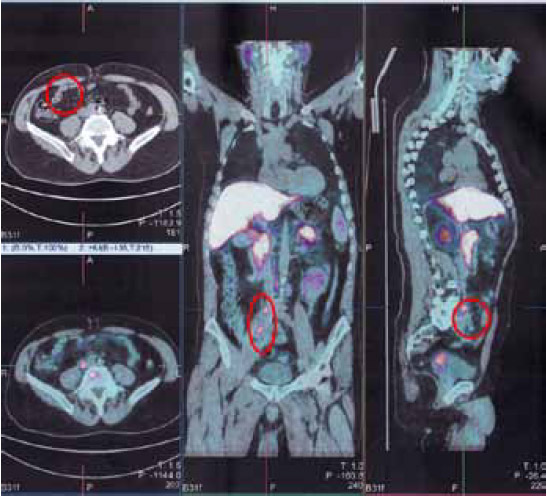
Рисунок 1. Сцинтиграфия скелета (метастазы в седалищную кость и позвоночник)
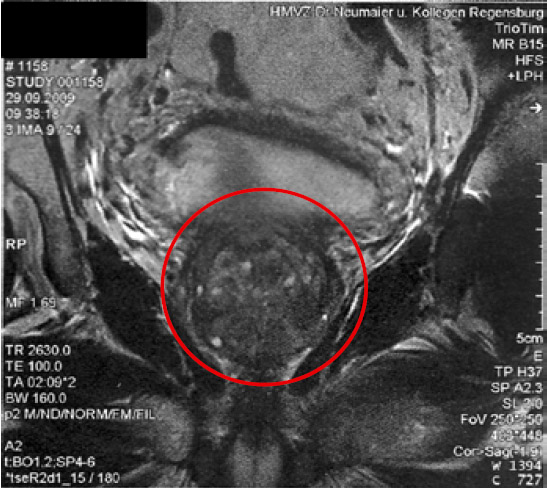
Рисунок 2. Местно-распространенный РПЖ на МРТ
Результаты были подтверждены с помощью ПЭТ-КТ с холином (рисунки 3, 4, 5): метастазы в Th8 и L1, L5 инфильтрация в семенные пузырьки, в левую седалищную кость, правую подвздошную кость, легкое и брюшную полость, лимфатические узлы средостения (2,3/2,6 см) и подвздошные лимфоузлы с двух сторон (1,4/1,6/1,1 см).
Был проведен международный консилиум в составе:
Рисунок 3. Метастазы в лимфоузлы средостения
Рисунок 4. Метастазы в позвоночник и кости таза
Рисунок 5. Метастазы в подвздошные лимфоузлы
После презентации рекомендаций EAU, предлагающих гормональную терапию с применением аналогов ЛГРГ и антиандрогенов, пациенту было рекомендовано соответствующее лечение. Однако пациент отказался от данной тактики
с просьбой проведения радикального лечения. Он хотел работать в следующем году с той же интенсивностью и мотивацией, и считал, что побочные эффекты гормонального лечения и местные симптомы распространения опухоли нарушат его
образ жизни. Следуя пожеланиям пациента, мы начали неоадъювантную системную терапию бикалутамидом 150 мг и доцетакселом 75 мг/м2 внутривенно (3 цикла) с перспективой проведения циторедуктивной операции после повторного стадирования вслед за окончанием 3-го цикла доцетаксела. Результаты повторного стадирования в феврале 2010 г. (профессор Barentsz, Nijmegen, NL):
• местно-распространенный РПЖ с инвазией в правый семенной пузырек и треугольник Льето;
• различная по степени инфильтрация лимфоузлов таза, некоторые из них с активными клетками на Т3-МРТ;
• несколько костных метастазов, 2 из них – с опасностью перелома (Th9, и правая тазовая кость).
После проведения повторного стадирования консилиум специалистов предложил следующий вариант лечения: сальважная радикальная простатвезикулэктомия с расширенной лимфодиссекцией и местной лучевой терапией метастазов позвоночника.
2 марта 2010 г. после снижения уровня ПСА до 0,57 нг/мл на фоне
проведения неоадъювантной терапии в университете Регенсбурга была проведена позадилонная радикальная простатвезикулэктомия с расширенной лимфодиссекцией. Во время операции были стентированы оба мочеточника, мочеточниковые катетеры удалены на 4-е сутки, уретральный катетер удален на 10-е
сутки после радиологического подтверждения состоятельности анастомоза. Длительность госпитализации составила 14 дней. Результаты гистологического исследования макропрепаратов: pT4, pN1 (4/22), L1, V1, R2 (скелетные), cM1.
Была сформулирована стратегия последующего лечения:
• продолжение лечения аналогами ЛГРГ;
• дополнительное назначение тамоксифена 20 мг/сут. для уменьшения побочных эффектов гормональной терапии;
• адъювантная лучевая терапия малого таза;
• поддерживающая терапия бисфосфонатами в/в каждые 4 недели.
• максимальная андрогенная блокада тренантоном (Leuprolide) каждые 3 месяца и бикалутамидом 150 мг per os ежедневно;
• хорошее клиническое состояние;
• ПСА (0,70 нг/мл, на февраль 2011).
Почему мы поддерживаем циторедуктивную хирургию в определенных случаях? Циторедуктивная хирургия позволяет нам избежать многих местных осложнений прогрессирования РПЖ, которые с высокой вероятностью могут произойти: обструктивное мочеиспускание с необходимостью паллиативной трансуретральной резекции, кровотечение из опухоли с необходимостью гемотрансфузии и регулярны-
ми госпитализациями, обструкции мочеточников.
Не стоит забывать и о финансовых затратах государственной системы здравоохранения. Стоимость 14-дневной госпитализации после радикальной простатэктомии с лимфодиссекцией составляет 8700 Евро. Стоимость же паллиативной резекции, двусторонней нефростомии с антеградным стентированием и заменой стентов каждые 6 месяцев (в течение 2 лет) достигает 22 000-44 000 Евро.
В отдельных, хорошо отобранных случаях, циторедуктивная хирургия, особенно при местно-распространенном РПЖ, может оказаться очень перспективной. Она позво-
ляет избежать известных местных осложнений данного заболевания и, возможно, даже продлить время до системного прогрессирования. При хорошем отборе пациентов (возраст, сопутствующие заболевания, локальные характеристики опухоли) это может обеспечить лучшее качество жизни, особенно у молодых пациентов. Имеет место также очевидное снижение затрат на лечение за счет уменьшения риска повторных паллиативных резекций предстательной железы, стентирования мочеточников, потребности в переливании крови, частых госпитализаций.
Ключевые слова: рак предстательной железы, циторедуктивные технологии.
Keywords: cancer prostate, cytoreductive technology.