Что такое цезий 133
Цезий. Свойства цезия. Применение цезия
Тает в руках, но не снег – загадка из раздела «химия». Отгадка – цезий. Температура плавления этого металла равна 24,5 градусам Цельсия. Вещество, буквально утекающее сквозь пальцы, открыто в 1860-ом году. Цезий стал первым элементом, обнаруженным с помощью спектрального анализа.
Для начала выделили его хлороплатинат. Ради 50 граммов переработали 300 тонн минеральной воды. С названием нового металла мудрить не стали. С латинского «цезий» переводится как «голубой».
Химические и физические свойства цезия
Из металлов элемент самый редкий и рассеянный в земной коре. В природе встречается лишь один изотоп – цезий 133. Он полностью устойчив, то есть не подвержен радиоактивному распаду.
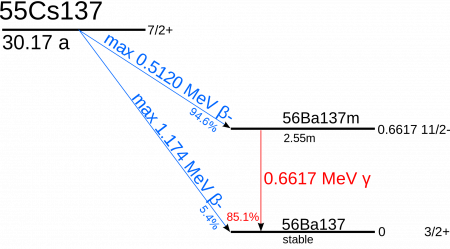
Радиоактивные изотопы металла получены искусственно. 135-ый цезий – долгожитель. Период его полураспада приближается к 3 000 000 лет. Цезий 137 наполовину распадается за 33,5 года. Изотоп признан одним из основных источников загрязнения биосферы.
В нее нуклид попадает из сбросов заводов, атомных станций. Период полураспада цезия позволяет ему проникать в воды, почву, растения, накапливаться в них. Особенно много 137-го изотопа в пресноводных водорослях и лишайниках.
Будучи самым редким из металлов, цезий является еще и самым активным. Элемент щелочной, расположен в главной подгруппе 1-ой группы периодической системы, что уже обязывает вещество легко вступать в химические реакции. Их течение усиливает присутствие воды. Так, на воздухе атом цезия взрывается из-за нахождения ее паров в атмосфере.
Взаимодействия легко запускаются по 2-м причинам. Первая – сильный отрицательный электрохимический потенциал. То есть, атом заряжен отрицательно, стремится притянуть к себе иные частицы.
Вторая причина – площадь поверхности цезия при реакциях с другими веществами. Тая в комнатных условиях, элемент растекается. Получается, что для взаимодействия открыто большее число атомов.
Применение цезия
Цезий, формула которого обеспечивает низкую работу выхода электрона, пригождается при изготовлении фотоэлементов. В приборах на основе 55-го вещества затраты на получение тока минимальны. Чувствительность же к излучению, напротив, максимальна.
Применяют 55-ый металл и в счетчиках заряженных частиц. Для них закупают йодит цезия. Активированный таллием, он регистрирует почти любые излучения. Цезиевые детекторы приобретают для атомных предприятий, геологической разведки, медицинских клиник.
Пользуются приборами и космической отрасли. В частности, «Марс-5» изучил элементарный состав поверхности красной планеты именно благодаря гамма-спектрометру на основе цезия.
Способность улавливать инфракрасные лучи – причина для применения в оптике. В нее добавляют бромид цезия и оксид цезия. Он есть в биноклях и очках ночного видения, оружейных прицелах. Последние, срабатывают даже из космоса.
Обрабатывать 137-ым изотопом можно и медицинские инструменты, лекарства. Нуклид нужен и в самом лечении, если дело касается опухолей. Метод называется радиотерапией. Препараты с цезием дают и при шизофрении, дифтерии, язвенных заболеваниях, некоторых видах шока.
Растет и прочность на разрыв, стойкость к коррозии. Правда, промышленники ищут альтернативу 55-му элементу. Слишком уж он дефицитен, не выгоден в цене.
Добыча цезия
Металл выделяют из поллуцита. Это водный алюмосиликат натрия и цезия. Минералов, содержащих 55-ый элемент единицы. В поллуците процентовка цезия делает добычу экономически обоснованной. Немало металла и в авогардите. Однако, этот камень сам столь же редок, как и цезий.
Промышленники вскрывают поллуцит хлоридами или сульфатами. Цезий из камня выделяют, погружая его в подогретую соляную кислоту. Туда же засыпают хлорид сурьмы. Образуется осадок.
Его промывают горячей водой. Итог операций – хлорид цезия. При работе с сульфатом, поллуцит погружают в серную кислоту. На выходе образуются алюмоцезиевые квасцы.
В лабораториях применяют другие методы получения 55-го элемента. Их 3, все трудоемки. Можно нагреть дихромат и хромат цезия с цирконием. Но, для этого требуется вакуум. Он нужен и для разложения азида цезия. Без вакуума обходятся лишь при нагреве специально подготовленного кальция и хлорида 55-го металла.
Цена цезия
В России добычей и переработкой поллуцита занимается Завод редких металлов в Новосибирске. Продукцию предлагает и Горно-обогатительный комбинат Ловозерска. Последний предлагает цезий в ампулах по 10 и 15 миллиграммов.
Они идут в пачках по 1000 штук. Минимальная цена – 6000 рублей. Севредмет тоже торгует ампулами, но готов осуществлять поставки меньших объемов, — от 250-ти граммов.
Цезий-133
C 1967 года явление перехода между двумя сверхтонкими уровнями основного состояния атома цезия-133 используется для определения одной из основных единиц измерения времени — секунды.
Образование изотопа
См. также
Примечания
Полезное
Смотреть что такое «Цезий-133» в других словарях:
Цезий — 55 Ксенон ← Цезий → Барий … Википедия
Цезий-134 — Схема распада цезия 1 … Википедия
Цезий — (хим. Caesium; Cs=133 при O=16, среднее из определений Бунзена,Джонсона с Алленом и Годефруа, 1861 1876) первый при содействииспектрального анализа открытый металл. Он получил это название отcaesius небесно синий, лазоревый за цвет двух резких… … Энциклопедия Брокгауза и Ефрона
Цезий — (хим. Caesium; Cs = 133 при O =16, среднее из определений Бунзена, Джонсона с Алленом и Годефруа, 1861 1876) первый при содействии спектрального анализа открытый металл. Он получил это название от caesius небесно синий, лазоревый за цвет двух… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
Ta — Тантал / Tantalum (Ta) Атомный номер 73 Внешний вид простого вещества тяжелый твёрдый металл серого цвета Свойства атома Атомная масса (молярная масса) 180,9479 а. е. м. (г/моль) Радиус атома … Википедия
Авария на АЭС Фукусима I — Тип Радиационная авария Причина Землетрясение, цунами … Википедия
Авария на АЭС Фукусима-1 — Авария на АЭС Фукусима I Тип Радиационная авария … Википедия
Схемы просвечивания сварных соединений. — 4.4.11 Схемы просвечивания сварных соединений. 4.4.11.1 Основные схемы просвечивания стыковых и угловых сварных соединений нефтепроводов, технологических и вспомогательных трубопроводов приведены на Рис. 6 Рис. 12. Примечание. На Рис. 6 Рис. 12… … Словарь-справочник терминов нормативно-технической документации
РД 08.00-60.30.00-КТН-046-1-05: Неразрушающий контроль сварных соединений при строительстве и ремонте магистральных нефтепроводов — Терминология РД 08.00 60.30.00 КТН 046 1 05: Неразрушающий контроль сварных соединений при строительстве и ремонте магистральных нефтепроводов: 1.4.15 Бригада сварщиков группа аттестованных в установленном порядке сварщиков, назначенных… … Словарь-справочник терминов нормативно-технической документации
Что такое цезий 133
Представьте себе огромный циферблат, где находится не 60, а 9192631770 делений, которые составляют всего 1 секунду. Именно с такой частотой атом Цезия 133 совершает переход с одного энергетического уровня на другой и именно на такие промежутки делят секунды атомные часы — самый точный измерительный прибор за всю историю времени. Неудивительно, ведь атомы не подвержены старению, не изнашиваются, а частота колебания будет всегда одинаковой для одного химического элемента, благодаря чему можно синхронно, не боясь погрешностей, сравнивать, например, показания атомных часов далеко в космосе и на Земле. Их изобретение стало пиком человеческого мастерства в истории точнейших часов.
Эта статья была опубликована в журнале OYLA №5(21). Оформить подписку на печатную и онлайн-версию можно здесь.
Самым совершенным прибором отсчёта времени в доэлектрическую эпоху были маятниковые часы Уильяма Шортта. Они «шли» даже точнее, чем сама Земля. Ведь нашу планету в каком-то смысле можно назвать огромными часами — мы измеряем время относительно оборота Земли вокруг своей оси (сутки). Но из-за влияния приливов океанов вращение Земли замедляется. Так, к 2100 году сутки станут длиннее на 0,00164 секунды. А скорость вращения Земли совершенно непредсказуемо может меняться даже в течение нескольких дней! Такое «неправильное» поведение Земли было установлено как раз при помощи часов Шортта.
Как работают часы Шортта
Уильям Шортт доработал часы работы мюнхенского мастера Клеменса Рифлера с маятником, изготовленным из инвара — сплава с чрезвычайно низким коэффициентом теплового расширения. Выбор материала обусловлен необходимостью сохранить стабильность длины маятника, от которой напрямую зависит период колебаний (при условии малой амплитуды и постоянства ускорения свободного падения).
В часах Шортта таких маятников было два: ведомый приводил в движение часовой механизм, а ведущий — свободно раскачивался в вакуумной камере. Синхронизация колебаний проводилась бесконтактно, электрическими датчиками и реле. Именно часы Шортта, убегавшие в сутки всего на три тысячных доли секунды, позволили зафиксировать неравномерность вращения Земли. Это обстоятельство заставило задуматься астрономов о корректности самого определения секунды как части звёздных суток.
Следующее решение для измерения времени пришло из радиотехники. Одной из главных проблем радиовещания долго оставалась стабильность несущей частоты. Если для обычных приёмников её «уход» особой проблемы не представлял (подкрутить ручку настройки несложно), то для нарождающихся радиолокации и телевидения эта трудность казалась непреодолимой.
Всё изменилось с появлением кварцевого резонатора ( Уолтер Кэди и Карл Ван Дайк, США, 1921) — устройства, которое способно расширяться или сжиматься в зависимости от подаваемого на него напряжения.
Один из первых образцов кварцевого резонатора
В 1927 году инженер Bell Telephone Laboratories Уоррен Моррисон сконструировал прототип кварцевых часов. Почти на 30 лет кварцевые резонаторы стали основой для эталона времени. Их эра не закончилась и поныне: не перечислить все отрасли, в которых они применяются — от компьютеров до мобильных телефонов и наручных часов. Кстати, сигналы точного времени (6 «бипов» перед началом часа) появились в 1944 году на BBC тоже благодаря кварцевым часам. Станция ретранслировала сигналы часов, установленных в Гринвичской обсерватории. Точность этих «ходиков» достигала 1 миллисекунды в сутки (то есть часы «врали» на секунду примерно за три года). До «атомного» времени оставался шаг.
Как работает кварцевый резонатор
Кварцевый резонатор имеет кварцевую пластинку определённого размера, на которую нанесены проводящие полоски-электроды. Если на резонатор подать напряжение, то благодаря пьезоэлектрическому эффекту пластинка деформируется, создавая во внешней цепи противо-ЭДС, подобно катушке индуктивности в колебательном контуре. Но самое интересное заключается в другом — кварцевая пластина обладает весьма стабильной собственной резонансной частотой! Если частота внешнего напряжения близка, то механические колебания резонатора можно поддерживать сколь угодно долго.
Но вначале советские физики Александр Прохоров и Николай Басов и независимо от них американец Чарлз Таунс работали не со светом, а с радиоволнами очень высокой частоты. Что произойдёт, если направить такой радиолуч на газ?
Атомы газа начнут взаимодействовать с фотонами радиолуча, рассеивая и поглощая его энергию. Если энергия внешнего фотона будет равна энергии перехода атома газа, то он будет полностью поглощён, и атом-«мишень» перейдёт в более высокое, возбуждённое, энергетическое состояние.
Затем атомы возвращаются в исходное состояние, излучая фотон точно такой же частоты. В итоге луч, проходя через газ (и не только газ), не ослабнет, а наоборот — усилится! Отсюда следует простая идея: если зафиксировано изменение интенсивности прошедшего луча, то его частота (или одна из частот) «попала» в резонанс с энергией перехода. Вспышки строго определённой частоты играли роль спускового крючка, который запускал резонансный генератор импульсов тока с кратной собственной частотой, питал кварц, игравший роль маятника.
На практике «простота» оказалась обманчивой. Дурно пахнущий аммиак, применённый в качестве рабочего тела в первом мазере, упорно не хотел давать чёткие спектральные линии, сильно сказывались влияние эффекта Доплера (смещения спектра в ту или иную сторону в зависимости от скорости) и взаимное столкновение частиц, искажающее «чистую» картинку переходов. Но даже при таких неблагоприятных условиях удалось создать часы, точность которых была выше на порядок, чем у кварцевых.
Почему атомные часы самые точные
Честь открытия «точного» металла — цезия — принадлежит немецким учёным Роберту Бунзену и Густаву Кирхгофу, обнаружившим его пары в водах Дюрхгеймского минерального источника в 1860 году. Металлический цезий впервые получил швед Карл Сеттерберг двадцатью годами позже. Природный изотоп — цезий-133 — отличается интересной особенностью: он плавится при температуре около 20°C, и это свойство сыграло важную роль.
«Тяжесть» и неторопливость атомов цезия, испаряющихся при столь невысокой температуре, в отличие от, например, цинка, плавящегося при 400°C, обеспечивали более чёткую картинку спектра с менее выраженным эффектом Доплера.
Цезий-133
Ещё один аргумент — сложность электронной оболочки. Атомы цезия могут находиться в 16‑ти возможных квантовомеханических состояниях, называемых «сверхтонкими магнитными подуровнями основного состояния». Такое богатство определяется разными магнитными моментами электронов оболочки с разным спином (от английского spin — вращаться, спин — одна из фундаментальных, наряду с массой и зарядом, характеристик элементарных частиц). Как следствие, атомы цезия легко возбуждаются для скачка между энергетическими уровнями. Даже слабый свет способен выбить из атомной структуры цезия поток электронов. Благодаря этому свойству цезий широко применяется в составе фотодетекторов. Льюис Эссен, сотрудник британской Национальной физической лаборатории, в 1953 году установил, что при переходе между сверхтонкими уровнями f3 и f4 излучаются фотоны с частотой 9192,631770±0,0000020 МГц.
Такое точное значение позволило Эссену вплотную заняться созданием эталона времени. Первая модель атомных часов (цезий-лучевая) представляла 5‑метровую «беговую дорожку», по которой атомы двигались со скоростью 250 м/с. Сортировка атомов с нужным энергетическим состоянием проводилась двумя магнитами, отклонявшими частицы в так называемую камеру Рэмси. В ней атомы «накачивались» микроволновым излучением до энергетического уровня f4. А дальше — ещё одна разделительная магнитная система и детектор, в котором «правильные» атомы цезия испускают фотоны.
Однако линии спектра излучения были слабыми и размытыми. Малая интенсивность линий определялась небольшим числом атомов в заданном состоянии, а «размытость» — влиянием всё того же эффекта Доплера (атомы двигались достаточно резво и имели значительный разброс скоростей). Со «слабостью» линий специалисты справились, применив остроумную схему обратной связи: частота излучения накачки подстраивалась к интенсивности излучения, и на требуемых 9,2 ГГц доля атомов с уровнем f4 достигала максимума. Проблема с размытием оказалась более крепким орешком, поддавшийся усилиям учёных гораздо позже.
Это единственные кварцевые часы, которые до сих пор работают в Гринвичской обсерватории. Они содержат линзообразный (AT-среза) кристалл и генерируют сигналы с частотой 2,5 МГц. Это один экземпляр из той пары часов, которые были закуплены в США в 1964 г., после того как они прошли испытания в Морской обсерватории США (Гринвичская обсерватория).
Роль часового механизма, переводящего абстрактные колебания (будь то маятник в часах или «беготня» электронов в атоме) в зримые цифры, играют уже знакомые нам кварцевые резонаторы. Сложные электронные схемы «обвязки» резонатора позволяют фиксировать совпадение (или кратность) частоты внешнего излучения с собственной частотой резонатора. В некотором смысле мы имеем дело с «радиоприёмником», который настраивается на определённую частоту, зная которую несложно «отсчитать» нужное количество тактов (частота и период колебаний обратно пропорциональны друг другу).
После калибровки, на которую ушло почти 4 года, устройство Луи Эссена получило наименование NBS-1 и достигло точности в 1 секунду за тысячу лет! Этот успех заставил Международный Комитет мер и весов в 1967 году перейти на определение секунды как промежутка равного 9192631770 периодам излучения 133‑го изотопа цезия, содержащего в ядре 55 протонов и 78 нейтронов, соответствующего переходу между сверхтонкими состояниями f4 и f3. Такой шаг означал окончательный отказ от астрономических методов определения секунды (согласно предыдущему стандарту 1954 года, она равна 1/31556925,9747‑й доле 1900‑го года).
Справиться с размытостью спектральных линий помог лазерный «фонтан», предложенный Джеролдом Закариосом. Цезиевое «облачко» удерживается в ловушке, образованной световым давлением лучей шести ортогональных лазеров. Оно может двигаться только по вертикали на манер поршня. Параллельно происходит и «накачка» атомов до нужного уровня, так что необходимость в магнитной сепарации отпадает. Вертикальные лазеры отвечают за медленный дрейф возбуждённых атомов вверх (вот он, фонтан), сквозь кольцевую детекторную камеру. Дальше атомы падают вниз, снова проходя через детектор.
Впервые цезиевый «фонтан» был продемонстрирован в Стэнфордском университете в 1989 году. Специалисты сразу увидели огромное преимущество: доплеровское «размытие» практически исчезло, скорость атомов была столь мала, что ею можно пренебречь — неопределённость частоты не превышала 10 Гц! Кроме того, одни и те же атомы выдавали 2 кванта, проходя через детекторную камеру два раза, то есть выросла стабильность измерения. Новые цезиевые часы вступили в строй в 1999 году, сходу на порядок превысив стандарт точности США (секундная ошибка за 2,7 миллиона лет).
«Фонтанная» технология стала на некоторое время доминирующей в создании суперхронометров. Но сегодня путь к абсолютной точности лежит в иной плоскости и связан он уже не с излучением, а с квантовыми эффектами.
В 2010 году физики NIST (National Institute of Standards and Technology — Национальный институт стандартов и технологий, США) разработали квантово-логические часы (Quantum Logic Clock), в которых рабочими телами служат не сгустки паров цезия или стронция, а дублеты ртути (в следующих версиях — алюминия и стронция), удерживаемые в электромагнитных ионных ловушках на расстоянии несколько микрон друг от друга. В них генератором колебаний является не излучение, а периодическое изменение квантовых состояний паров атомов, инициируемое лазерным светом ультрафиолетового диапазона. «Рабочая» частота таких часов на пять порядков превышает общепринятый цезиевый стандарт, а теоретическая точность может достигать 1 секунды за… 15 миллиардов лет! Если, конечно, это будет кому-то ещё надо.
Цезий
(молярная масса)
(первый электрон)
28,44 °C
Цезий (химический символ — Cs; лат. Caesium ) — элемент главной подгруппы первой группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер — 55. Простое вещество цезий — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
Содержание
История
Цезий открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Нахождение в природе. Добыча
Основным цезиевым минералом является поллуцит. В виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. Также содержится в редком минерале авогадрите. В качестве промышленного сырья используются поллуцит и лепидолит.
По добыче цезиевой руды (поллуцита) лидирует Канада — в месторождении Танко (юго-восточная Манитоба, северо-западный берег озера Берник-Лейк) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России месторождения поллуцита есть на Кольском полуострове, в Восточном Саяне и Забайкалье. Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о. Эльба), но они обладают малыми запасами и не имеют важного экономического значения.
Мировая добыча обогащённой руды цезия составляет около 20 тонн в год. Мировой объём производства металлического (чистого) цезия — около 9 тонн в год.
Некоторые источники утверждают, что потребности в цезии более чем в 8,5 раза превышают его добычу, что положение в металлургии цезия ещё более тревожное, чем, например, в металлургии тантала или рения, и производители не могут обеспечить постоянно растущий спрос на металлический цезий.
Геохимия и минералогия
Получение
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2·12H2O.
Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода, азота, кислорода и многократная ступенчатая кристаллизация.
Сложности получения цезия обусловливают постоянный поиск его минералов: извлечение этого металла из руд неполное, в процессе эксплуатации материала он рассеивается и потому безвозвратно теряется, Промышленность нуждается именно в очень чистом материале (на уровне 99,9—99,999 %), и это является одной из труднейших задач в металлургии редких элементов.
В России переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов».
Существует несколько лабораторных методов получения цезия. Он может быть получен:
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Изотопы
Известны изотопы цезия с массовыми числами от 112 до 151 (количество протонов 55, нейтронов от 57 до 96), и 22 ядерных изомеров. Природный цезий — моноизотопный элемент, состоящий из единственного стабильного изотопа 133 Cs.
Самым долгоживущим искусственным радиоактивным нуклидом цезия является 135 Cs с периодом полураспада T 1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137 Cs ( T 1/2 = 30,17 года ).
Физические свойства
Цезий — мягкий металл, из-за низкой температуры плавления ( T пл = 28,6 °C ) при комнатной температуре находится в полужидком состоянии. Твёрдость цезия по шкале Мооса составляет 0,2.
Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее. Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо отражает свет. Пары цезия окрашены в зеленовато-синий цвет.
Цезий растворяется в жидком аммиаке (тёмно-синие растворы) и расплавленном CsOH.
Цезий образует легкоплавкие сплавы с другими щелочными металлами. Его сплав с калием и натрием имеет температуру плавления −78 °С.
Химические свойства
Цезий является наиболее химически активным металлом, за исключением радиоактивного франция, практически отсутствующего в природе. Является сильнейшим восстановителем. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O. Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Реагирует с бензолом. Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции).
Многие образуемые цезием соли — нитраты, хлориды, бромиды, фториды, йодиды, хроматы, манганаты, азиды, цианиды, карбонаты и т. д. — чрезвычайно легко растворимы в воде и ряде органических растворителей; наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и некоторые его сплавы.
Цезий весьма активен и агрессивен по отношению к контейнерным материалам и требует хранения, например, в сосудах из специального стекла в атмосфере аргона или водорода (обычные марки лабораторного стекла цезий разрушает).
Цезий способен присоединяться к этилену с образованием дицезиоэтилена CsCH2CH2Cs.
Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной, до коротковолновой ультрафиолетовой области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых.
Детекторы ионизирующего излучения
Иодид цезия в виде монокристаллов (обычно активированный небольшой примесью таллия) является одним из наиболее распространённых сцинтилляторов — веществ, конвертирующих энергию ионизирующего излучения в свет. Это связано с высокой эффективностью поглощения гамма-квантов из-за большого атомного номера обоих основных составляющих йодида цезия, а также с высоким световыходом этого сцинтиллятора. Детекторы заряженных частиц и гамма-излучения на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так, например, измерения элементного состава поверхности Марса выполнялись с помощью гамма-спектрометра на основе CsI(Tl), установленного на космическом орбитальном аппарате «Марс-5». Недостатком этого сцинтиллятора является некоторая гигроскопичность, из-за которой он может длительно использоваться без герметичной оболочки лишь в достаточно сухом воздухе. Впрочем, его гигроскопичность на порядки ниже, чем у другого распространённого сцинтиллятора — йодида натрия.
Оптика
Иодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применение цезия как промотора при каталитическом получении аммиака, синтезе бутадиена. В ряде катализаторов оказалось эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга), в частности, используется рутений-цезий-углеродный катализатор. Цезий промотирует действие серебряного катализатора и повышает его селективность при эпоксидировании этилена.
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём (алюминат цезия).
Радиационная техника
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении. Его соли, подобно препаратам лития, способны проявлять нормотимический эффект.
Применение цезия в энергетике
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %.
Ввиду того, что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 % и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C среди сплавов.
Прочие области применения цезия
Фторид цезия применяют для пьезоэлектрической керамики, специальных стёкол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена. Атомные переходы в пара́х цезия используются как эталон частоты в атомных часах.
Биологическая роль
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.
Цезий в живых организмах
Цезий-137 — радиоактивный изотоп цезия, испускающий бета-излучение и гамма-кванты, и один из главных компонентов техногенного радиоактивного загрязнения биосферы. Продукт деления урана-235, урана-238, плутония-239 и других делящихся изотопов. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы атомных электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых (маслята, моховики, свинушка, горькушка, польский гриб) считается «аккумуляторами» радиоцезия.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Литий
Li
Атомный номер: 3
Атомная масса: 6,941
Темп. плавления: 453,85 К
Темп. кипения: 1615 К
Плотность: 0,534 г/см³
Электроотрицательность: 0,98
Натрий
Na
Атомный номер: 11
Атомная масса: 22,98976928
Темп. плавления: 371,15 К
Темп. кипения: 1156 К
Плотность: 0,97 г/см³
Электроотрицательность: 0,96
Калий
K
Атомный номер: 19
Атомная масса: 39,0983
Темп. плавления: 336,58 К
Темп. кипения: 1032 К
Плотность: 0,86 г/см³
Электроотрицательность: 0,82
Рубидий
Rb
Атомный номер: 37
Атомная масса: 85,4678
Темп. плавления: 312,79 К
Темп. кипения: 961 К
Плотность: 1,53 г/см³
Электроотрицательность: 0,82
Цезий
Cs
Атомный номер: 55
Атомная масса: 132,9054519
Темп. плавления: 301,59 К
Темп. кипения: 944 К
Плотность: 1,93 г/см³
Электроотрицательность: 0,79
Франций
Fr
Атомный номер: 87
Атомная масса: (223)
Темп. плавления:
950 К
Плотность: 1,87 г/см³
Электроотрицательность: 0,7