что такое слизистые тяжи в глазу
Синдром сухого глаза
За последние 20-30 лет частота выявления синдрома «сухого глаза» (ССГ) выросла в 4,5 раза.
Данным заболеванием страдает около 10-17% населения высокоразвитых стран. И этот показатель имеет тенденцию к постоянному росту, что обусловлено технологическим прогрессом и изменяющейся экологией окружающей среды, широким распространением компьютеров, кондиционеров, ношением контактных линз, увеличением числа кераторефракционных хирургических вмешательств, применением медикаментов.
Основными жалобами являются:
Что провоцирует развитие ССГ?
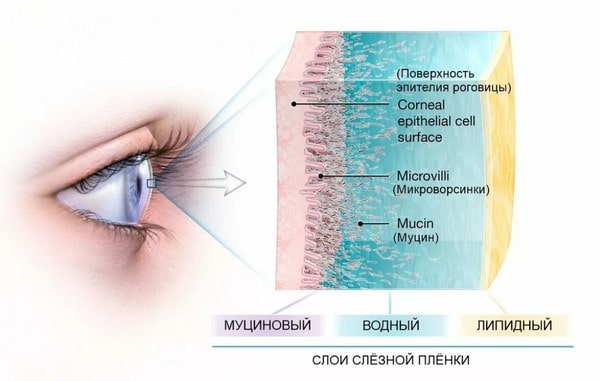
В основе развития синдрома «сухого глаза» лежит нарушение стабильности прероговичной слёзной плёнки. В норме слеза покрывает роговицу непрерывной плёнкой толщиной около 10 мкм. Состоящей из трех слоев: с роговицей контактирует муциновый слой, основную массу составляет водянистый слой, а снаружи располагается липидный слой, препятствующий испарению слезы.
Через каждые 10 секунд слёзная плёнка разрывается, стимулируя мигательное движение век и обновление жидкости в коньюнктивальной полости. При этом веки распределяют слезу по роговице и восстанавливают целостность слёзной плёнки. Нарушение стабильности прероговичной слёзной плёнки является следствием либо чрезмерно частых её разрывов, либо слишком редких мигательных движений.
Повышение частоты разрывов слёзной плёнки обусловлено: недостаточной продукцией её компонентов; повышенным её испарением, вследствие нарушения функции липидного слоя слёзной плёнки или патологии эпителиальной мембраны роговицы, нарушения функции век.
Снижение частоты мигательных движений век часто является следствием причин функционального характера (напряжённой зрительной работы за компьютером, за рулём автомобиля и т.п.; снижением чувствительности роговицы на почве длительного ношения КЛ и др.); органических причин (снижение чувствительности роговицы у пациентов с нейропаралитическим кератитом, с последствиями вирусных кератитов, у людей, перенесших кераторефракционные операции и т.д.).
Классификация проявлений синдрома
По степени тяжести синдром «сухого глаза» подразделяют на:
Основные причины ССГ
Причины возникновения синдром «сухого глаза» подразделяются на несколько групп:
Диагностика основывается на специализированном офтальмологическом обследовании с выполнением специальных функциональных проб (тест Ширмера, проба Норна).
Синдром сухого глаза в офтальмологической практике
Синдром сухого глаза (ССГ), или ксероз роговицы и конъюнктивы, представляет собой комплексное заболевание, которое распространено во всем мире и является одной из основных проблем современной офтальмологической патологии. По данным российских
Синдром сухого глаза (ССГ), или ксероз роговицы и конъюнктивы, представляет собой комплексное заболевание, которое распространено во всем мире и является одной из основных проблем современной офтальмологической патологии. По данным российских исследователей, этим заболеванием страдают до 12% больных офтальмологического профиля в возрасте до 40 лет и свыше 67% пациентов старше 50 лет [2]. Сам термин «сухой глаз» появился в отечественной литературе сравнительно недавно. Ранее его отождествляли исключительно с болезнью Сьегрена — тяжелым системным заболеванием, сопровождающимся понижением или полным отсутствием секреции всех эндокринных желез, в особенности слезных и слюнных. В настоящее время понятие «синдром сухого глаза» расширено и определяется как комплекс признаков поражения роговичного и конъюнктивального эпителия вследствие снижения качества и/или количества слезной жидкости [1]. Последняя формирует на поверхности глаза слезную пленку (СП), которая выполняет ряд важнейших функций, в том числе трофическую, защитную и оптическую. Таким образом, нарушение состава или продукции СП может привести к достаточно серьезным повреждениям переднего отрезка глаза.
Возникают ксероз роговицы и конъюнктивы вследствие ряда патологий. Важную роль в этом процессе играют выраженные анатомические нарушения глазной локализации, такие, как неполное смыкание или чрезмерное раскрытие глазной щели на почве рубцового или паралитического лагофтальма, эндокринной офтальмопатии, а также буфтальма. Роговично-конъюнктивальный ксероз может развиться также вследствие нарушения трофики роговицы или деформации ее поверхности, несостоятельности слезной железы, дополнительных слезных желез после перенесенных дакриоаденита и воспалительных заболеваний конъюнктивы. Также нарушение состава СП наблюдается при так называемом климактерическом синдроме [2]. Резкое снижение продукции слезы отмечается при нарушениях иннервации слезной железы, таких, как паралич лицевого нерва, рассеянный склероз. Хронический мейбомит, при котором нарушается состав СП, также ведет к развитию типичной картины ССГ. В последнее время особую значимость приобретают так называемые глазной офисный и глазной мониторный синдромы, возникающие у людей различного возраста в результате систематического воздействия на их глаза кондиционированного воздуха, электромагнитных излучений от офисной аппаратуры и других подобных источников [3]. Одной из распространенных причин нарушения стабильности СП, приобретающего в последние годы все большую актуальность, являются оперативные вмешательства, проводимые по поводу аномалий рефракции и катаракты [4]. Было отмечено, что ССГ может быть вызван приемом некоторых лекарственных средств, таких, как пероральные контрацептивы, трициклические антидепрессанты, гипотензивные средства, кортикостероиды, а также постоянными инстилляциями β-блокаторов, проводимыми при лечении глаукомы. По некоторым данным, развитие ксероза роговицы и конъюнктивы может вызывать прием цитостатиков и антимигренозных препаратов [2].
Типичным одним из начальных симптомов синдрома сухого глаза является ощущение инородного тела в конъюнктивальной полости, которое сочетается с сильным слезотечением, в дальнейшем сменяемым ощущением сухости. Характерны жалобы пациентов на жжение и резь в глазу, особенно при воздействии ветра, дыма, кондиционированного воздуха и других подобных раздражителей, при использовании тепловентиляторов. В дополнение к этому субъективными признаками заболевания являются светобоязнь, ухудшение зрительной работоспособности к вечеру, колебания остроты зрения в течение рабочего дня. К вышеперечисленным необходимо добавить и патогномоничные признаки. В частности, характерна негативная реакция больных на закапывание в конъюнктивальную полость даже вполне индифферентных капель, например раствора левомицетина 0,25% или раствора дексаметазона 0,1%. В таких случаях пациенты испытывают боль, жжение или резь в глазу [3].
Наиболее же частым объективным признаком заболевания является уменьшение или полное отсутствие у краев век слезных менисков. Их место обычно заполняет отекшая и потускневшая конъюнктива, «наползающая» на свободный край века. Несколько реже у таких больных можно обнаружить появление разнообразных «засоряющих» включений в слезной пленке. Обычно они представлены мельчайшими глыбками слизи, остатками отделившихся эпителиальных нитей, воздушными пузырьками и другими микрочастицами. Они плавают в толще слезной пленки, слезном мениске и нижнем конъюнктивальном своде, смещаются по эпителию роговицы и хорошо заметны в свете щелевой лампы. Еще одним объективным признаком синдрома сухого глаза служит характерное отделяемое из конъюнктивальной полости. При обработке век оно вследствие высокой вязкости вытягивается в тонкие слизистые нити, которые вызывают у больных дискомфорт. По совокупности вышеперечисленных признаков целесообразно выделять три степени тяжести течения синдрома сухого глаза [1].
Для I, легкой, степени характерны:
II, средняя, степень имеет:
III, тяжелая, степень отличается особыми формами.
Диагностика заболевания
Диагностический процесс в отношении пациентов с ССГ осуществляется в традиционной последовательности. Первичный офтальмологический осмотр пациентов на начальном этапе включает следующие элементы.
При обнаружении признаков ССГ производится уже уточняющее обследование, включающее три этапа.
Первичный офтальмологический осмотр пациентов производится по общепринятым правилам. Большее внимание следует уделять жалобам, которые в ряде случаев прямо или косвенно свидетельствуют о ксеротических изменениях со стороны тканей глаза. Необходим также целенаправленный сбор анамнестических данных, касающихся общего статуса, перенесенных заболеваний, травм и операций, получаемого лечения, профессиональной деятельности обследуемого.
При биомикроскопии роговицы и конъюнктивы следует иметь в виду, что признаки ССГ зачастую маскируются симптомами других глазных заболеваний, в частности дегенеративного или воспалительного характера. Для их дифференциации S.C.G.Tseng (1994) предложил достаточно простое правило: если подозрительные на ксероз изменения локализуются в так называемой экспонируемой зоне поверхности глазного яблока, то они связаны с ССГ; когда же участки патологии захватывают и неэкспонированную зону роговицы и конъюнктивы, природа их скорее не ксеротическая.
Существенно повышают возможности биомикроскопии витальные красители: флуоресцеин натрия 0,1%, бенгальский розовый 3% или лиссаминовый зеленый 1%, позволяющие получать различные взаимодополняющие сведения.
Наличие начальных, а тем более явных признаков ССГ является показанием для постановки функциональных проб, призванных оценить состояние слезопродукции и прочность прекорнеальной СП.
Обследование пациента с подозрением на ССГ следует начинать с оценки стабильности СП. Поскольку результаты используемой для этого пробы по Норну (1969) в значительной мере зависят от «инвазивности» предшествующих манипуляций в конъюнктивальной полости, то они должны быть полностью исключены. Вместе с тем исследованиями Л. С. Бира и др. (2001) установлено, что наиболее достоверные результаты оценки стабильности СП получают при использовании микрообъемов (6–7 мкл) флуоресцеина натрия 0,1%. При этом их влияние на стабильность СП становится минимальным, в отличие от целой капли (30–40 мкл) диагностикума, использующейся в методике Норна.
Следующий этап функционального исследования заключается в оценке состояния суммарной (основной и рефлекторной) слезопродукции в каждом глазу пациента. В связи с тем что недостаточность одного компонента секреции слезы часто компенсируется избытком другого (как правило, дефицит основной слезопродукции — рефлекторной гиперсекрецией), объем суммарной продукции слезы может и не снижаться, а иногда даже повышается. В силу указанных обстоятельств необходимо разграничить доли каждого компонента секреции слезы, а не завершать исследование, ограничившись измерением только суммарной слезопродукции, как это принято в практике большинства врачей. В указанных целях следует сначала измерить количество суммарной, а затем основной слезопродукции, а далее уже вычислить величину рефлекторной секреции слезы. Нужно отметить, что у пациентов с легкой формой ССГ, в клинической картине которого преобладают микропризнаки роговично-конъюнктивального ксероза на фоне гиперлакримии, проводить такие исследования нецелесообразно. Общепринятая и широко распространенная сейчас клиническая проба, характеризующая состояние суммарной слезопродукции, была предложена Ширмером. В целях исследования основной слезопродукции следует обратиться к пробе по Джонсу (1966), которая аналогична пробе Ширмера, но включает в себя предварительную инстилляционную анестезию.
Важную дополнительную информацию о состоянии слезопродукции позволяет дать исследование скорости секреции слезы. Разработанная В. В. Бржеским и соавторами методика основана на определении времени смачивания отрезка гидрофильной (поливиниловой, хлопчатобумажной и др.) нити, помещенной одним концом за нижнее веко обследуемого. Применение местных анестетиков или, наоборот, раздражающих веществ позволяет избирательно оценивать скорость основной или рефлекторной слезопродукции.
В целом арсенал диагностических методов, позволяющих получать разносторонние сведения о патогенезе, клиническом течении и особенностях функциональных расстройств у больных с ССГ в каждом конкретном случае, достаточно велик. Однако рациональный выбор этих методов в сочетании с правильным анализом их результатов неосуществим без соответствующего оснащения.
Лечение синдрома сухого глаза
Лечение больных с синдромом сухого глаза представляет весьма сложную и все еще достаточно далекую от оптимального решения задачу. Оно включает использование как консервативных, так и оперативных методов. Наиболее широкое употребление получили так называемые препараты искусственной слезы (слеза натуральная, видисик, корнерегель, лакривит, офтагель, солкосерил), включающие в качестве основы гидрофильные полимеры. Закапанная в конъюнктивальную полость искусственная слеза образует на поверхности глазного яблока достаточно стабильную пленку, включающую в себя и компоненты слезы больного, если ее продукция еще сохранена. Кроме того, повышенная вязкость препаратов препятствует быстрому оттоку жидкости из конъюнктивальной полости, что также является благоприятным фактором.
Препараты, применяемые для закапывания при лечении ССГ, должны соответствовать следующим характеристикам:
При выборе препарата нужно ориентироваться на исходные показатели стабильности СП и субъективные ощущения пациента при пробных четырехкратных инстилляциях сравниваемых лекарственных средств. В дальнейшем оптимальный для каждого конкретного больного препарат (или комбинацию препаратов) закапывают с частотой, определяющейся временем возобновления дискомфорта за веками глаза. Более подробно схемы проведения медикаментозной терапии лечения представлены в таблице.
В настоящее время среди препаратов, разрешенных к применению в России, наиболее эффективны офтагель, слеза натуральная, видисик и корнерегель [3].
С давних времен применяются капли искусственной слезы. Среди большого числа зарегистрированных в России глазных капель искусственной слезы наибольшее распространение и признание получила слеза натуральная. Действующей субстанцией этого препарата является оригинальная композиция — дуасорб, водорастворимая полимерная система, которая в сочетании с естественной слезной жидкостью глаза улучшает состояние слезной пленки. Схема применения подбирается в каждом случае индивидуально. Слеза натуральная закапывается от 3 до 8 раз в день. Больной может отдать предпочтение комбинации глазных капель, например слеза натуральная (2–3 раза) и какая-либо гелевая композиция (2 раза). Побочным эффектом данного препарата является снижение качества и количества собственной слезной жидкости, но только при длительном применении.
Большой интерес среди используемых в настоящее время фармакологических средств вызывают препараты, содержащие карбомер. На отечественном рынке таким средством является препарат офтагель. Данный препарат представляет собой глазной гель, содержащий в качестве основного компонента карбомер 974Р в количестве 2,5 мг/г. Вспомогательные компоненты: бензалкония хлорид, сорбитол, лизина моногидрат, натрия ацетат, поливиниловый спирт и вода. Карбомер, входящий в состав препарата, представляет собой высокомолекулярное соединение, с помощью которого обеспечиваются длительное и прочное соединение с роговицей, а также увеличение вязкости слезы, утолщение муцинового и водных слоев слезной пленки. Контакт карбомера с роговицей длится до 45 мин. К положительным свойствам препарата можно отнести его способность пролонгировать всасывание других глазных препаратов при одновременном их применении. Во время лечения не рекомендуется носить мягкие контактные линзы. Жесткие контактные линзы следует накладывать не ранее чем через 15 мин после закапывания офтагеля. Он хорошо переносится, из побочных эффектов было отмечено легкое затуманивание зрения в течение 1–5 мин после закапывания [6].
Также к наиболее широко использующимся препаратам искусственной слезы повышенной вязкости относится видисик — гидрогель, способный длительно удерживаться на поверхности роговицы и конъюнктивы за счет высокой вязкости. Положительный эффект после закапывания обеспечивается свойством геля благодаря миганию век переходить из гелеобразного состояния в жидкое. После периода покоя структура геля вновь приобретает исходное состояние (так называемое тиксотропное свойство, которым обладает именно видисик). После закапывания геля практически полностью исчезают неприятные ощущения в глазу, при кератопатии ускоряется эпителизация роговицы. Доказано, что видисик удерживается в прекорнеальной слезной пленке в 7 раз дольше, чем обычные заменители слезы, и не обладает аллергенными свойствами. Назначение видисика на ночь позволяет избегать закладывания мазей для защиты роговицы. Но при длительном и постоянном использовании препарата может наблюдаться снижение продукции собственной слезы [7].
Одним из препаратов выбора при сухих кератоконъюнктивитах и дистрофических изменениях роговицы является корнерегель — стерильный гель с повышенной вязкостью, что способствует его длительному контакту с роговицей и конъюнктивой. Гель хорошо переносится больными, не вызывает ухудшение зрения. Помимо слезозамещающего действия, корнерегель обладает и лечебным свойством, повышая способность роговицы к реэпителизации. Высокая вязкость корнерегеля позволяет ограничиваться одной, максимум двумя инстилляциями в день. Также к положительным свойствам данного препарата следует отнести экономическую эффективность, что является актуальным для пациентов с хронической формой заболевания. Расчеты, проведенные С. Ю. Голубевым и А. В. Куроедовым [8], показали, что при длительном применении слезозамещающих жидкостей более экономичным для больного является видисик. Среди стимуляторов репаративных процессов роговицы наибольших расходов потребовало использование солкосерила и актовегина, а корнерегель оказался значительно экономичнее.
Одно из новых и очень важных направлений в лечении больных с ССГ предусматривает создание временных или постоянных условий для сокращения оттока слезной жидкости из конъюнктивальной полости. Эта задача решается сейчас с помощью различных средств, в том числе чисто хирургических. Наибольшее распространение получила полимерная обтурация слезоотводящих путей. Эта процедура показана больным с выраженным снижением основной слезопродукции (результат пробы по Ширмеру — менее 5 мм, по Джонсу — 2 мм и ниже) или с тяжелыми изменениями роговицы (ее истончение или изъязвление, нитчатый кератит). В последнем случае окклюзия необходима даже при незначительном снижении основной секреции слезы (результат пробы по Джонсу — 8 мм и ниже).
Существует несколько моделей долгосрочных полимерных обтураторов слезоотводящих путей, среди которых наибольшее распространение получили две: пробочки-обтураторы слезных точек и обтураторы слезных канальцев.
С целью оценки эффективности планируемой долгосрочной обтурации слезоотводящих путей некоторые специалисты рекомендуют первоначально вводить в оба слезных канальца коллагеновые обтураторы, которые самостоятельно рассасываются через 4–7 дней. Если в течение этого срока отмечается заметный клинический эффект, в них вводят те же изделия, но уже из нерассасывающегося силикона (сначала в верхний слезный каналец, а при недостаточном эффекте — и в нижний).
Также весьма эффективной и относительно малотравматичной является операция покрытия слезной точки свободным конъюнктивальным лоскутом (Мурубу, 1996–2001). Последний заимствуют у бульбарной конъюнктивы или отсепаровывают от ресничного края века. Полученные результаты свидетельствуют о том, что достигаемый при этом эффект сравним с полимерной окклюзией слезных канальцев [9].
В заключение следует указать на то, что, несмотря на кажущееся многообразие методов лечения больных с синдромом сухого глаза, рассмотренная проблема все еще до конца не решена. Необходим дальнейший поиск новых, более действенных лечебных средств, ориентированных на компенсацию нарушений слезопродукции и стабильности слезной пленки.
Литература
Е. В. Полунина
О. А. Румянцева, доктор медицинских наук, доцент
А. А. Кожухов, кандидат медицинских наук
РГМУ, Международный центр офтальмохирургии и лазерной коррекции зрения, Москва
Что такое деструкция стекловидного тела? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сагоненко Д. А., офтальмолога-хирурга со стажем в 16 лет.
Определение болезни. Причины заболевания
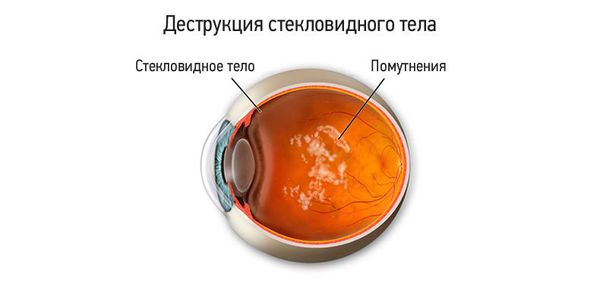
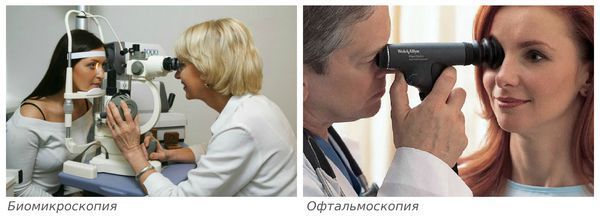
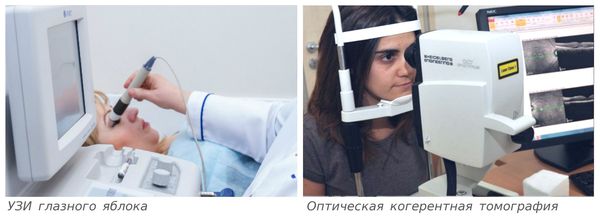
Данное состояние часто называют задней отслойкой стекловидного тела (ЗОСТ) и не делают различий между этими двумя диагнозами, так как причины и проявления сходны. При ЗОСТ ввиду склеротических процессов (уплотнения нормальной ткани и снижения её эластичности) в стекловидном теле происходит его сморщивание и отслаивание от прилежащей сетчатки. Патологию можно выявить при проведении инструментальных обследований: офтальмоскопии, ультразвуковом исследовании глазного яблока, оптической когерентной томографии.
Для пациентов деструкция стекловидного тела проявляется различными плавающими «мушками» и «червячками» при взгляде на однородную хорошо освещённую поверхность, например на светлый потолок, стену или небо в солнечную погоду.
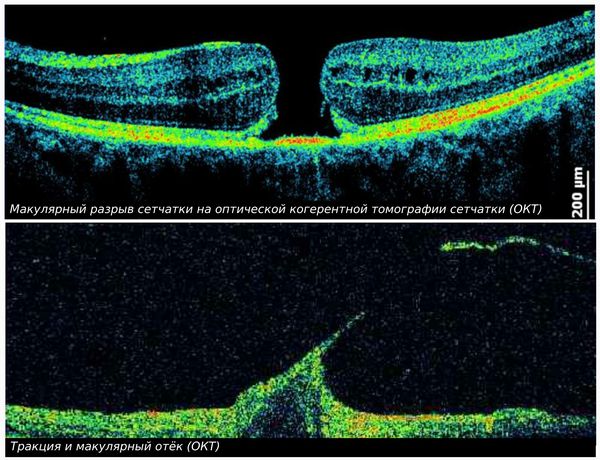
Если не убрать причину, которая привела к заболеванию, то его прогрессирование может привести к «тянущему» воздействию на сетчатку, её разрывам и отслоению от подлежащего слоя (пигментного эпителия). Такая ситуация грозит полной и безвозвратной потерей зрения.
Причинами нарушения структуры стекловидного тела бывают и развивающиеся серьёзные внутриглазные патологии — кровоизлияние (гемофтальм) или отслойка сетчатки глаза. Эти состояния могут привести к необратимой слепоте.
Симптомы деструкции стекловидного тела
Основная жалоба пациентов — появление в поле зрения на светлом фоне плавающих «мушек», «стеклянистых червячков», «паутинки», которые перемещаются при движении глаз.
При первом возникновении таких симптомов пациенту следует быть особенно настороженным, так как причиной «мушек» может быть разрыв сетчатки, приводящий к её отслоению, или лопнувший сосуд на глазном дне. При продолжении кровотечения глаз может полностью залить кровью и разовьётся опасное состояние, называемое «гемофтальмом».
Если деструкция сопровождается задней отслойкой стекловидного тела или разрывами сетчатки, то периодически могут возникать «искры», «молнии» или «вспышки». Это происходит из-за уменьшения стекловидного тела в объёме, что в свою очередь, ведёт к «оттягиванию» сетчатки и возбуждению светочувствительных клеток — палочек и колбочек.
Патогенез деструкции стекловидного тела
Для того, чтобы лучше понимать механизм развития деструкции стекловидного тела, обратимся к его строению и составу.
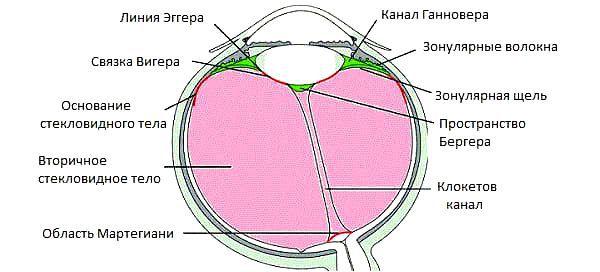
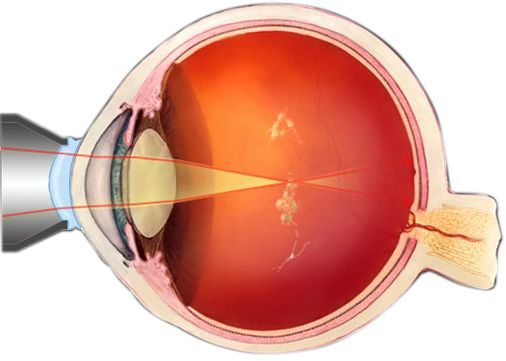
По своей структуре стекловидное тело представляет гелеобразную массу, которая заполняет глаз изнутри и занимает примерно 2/3 его объёма. Его фиксация к внутренним оболочкам осуществляется около хрусталика глаза и диска зрительного нерва. Стекловидное тело содержит до 99 % воды, небольшое количество клеток (гиалоцитов) и белковые коллагеновые волокна. Содержащаяся в нём гиалуроновая кислота обеспечивает вязкость. Кровеносных сосудов в стекловидном теле нет, обменные процессы происходят за счёт осмоса и диффузии — переноса веществ, благодаря разнице в концентрации.
По своей структуре стекловидное тело неоднородно, в нём выделяют следующие образования [4] :
К факторам, приводящим к деструкции стекловидного тела, относят возрастные изменения, сахарный диабет, близорукость, увеит, травмы и паразитарные заболевания.
Возрастные изменения. В основе патологических процессов лежит нарушение обмена веществ — снижение доставки кислорода и глюкозы к клеткам, синтезирующим коллаген и гиалуроновую кислоту. При этом в стекловидном теле уменьшается содержание воды, что приводит к его сморщиванию, уплотнению и нарушению первоначальной структуры и прозрачности.
Классификация и стадии развития деструкции стекловидного тела
В зависимости от вида деструкции выделяют следующие формы [20] :
Если патологический процесс захватывает только определённый участок стекловидного тела, то говорят о частичной деструкции, если всю структуру — о полной. Со временем частичная деструкция может перейти в полную.
Стадии заболевания:
Осложнения деструкции стекловидного тела
Осложнения заболевания связаны с воздействием на сетчатку, окружающую стекловидное тело. Уменьшение объёма стекловидного тела, отслоения его от сетчатки или появления в нём тяжей ведёт к разрыву или отслоению сетчатой оболочки.
При этом пациент ещё способен ориентироваться в пространстве, так как выпадает центральное поле зрение, а способность видеть по периферии остаётся. Если процесс распространяется и на периферию сетчатки, то зрение теряется полностью. Как правило, это происходит при изменениях на фоне сахарного диабета или как исход воспалительных заболеваний глаз.
Диагностика деструкции стекловидного тела
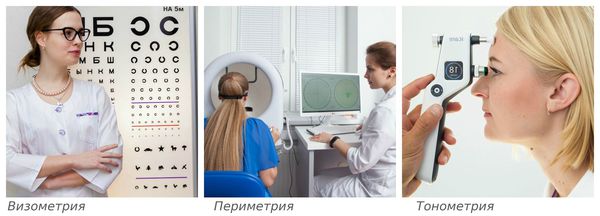
Зачастую постановка диагноза особых сложностей не представляет. Помимо характерных жалоб пациента на плавающие в поле зрения «мушки», «червячки» и «паутинки», выявить заболевание помогут инструментальные методы: визометрия, периметрия, тонометрия и другие исследования.
Визометрия — определение максимально высокой остроты зрения вдаль с коррекцией и без. Исследование проводится с помощью специальных таблиц с буквами или цифрами. Для диагностики детей используют изображения животных и предметов.
Периметрия — исследование полей зрения с помощью периметра. Периметр представляет собой полусферу, внутри которой загораются световые метки. Задача пациента состоит в том, чтобы не отрывая взгляд от центра этой полусферы, увидеть все «огоньки».
Тонометрия — измерение внутриглазного давления. Обследование проводят с помощью помещения на роговицу специальных грузиков (тонометрия по Маклакову) или бесконтактно (пневмотонометром). Суть процедуры cостоит в том, чтобы определить ответ роговицы на внешнее воздействие — чем выше внутриглазное давление, тем сильнее сопротивляемость оболочек глаза к внешнему давлению.
Три исследования, перечисленные выше, не являются специфическими и входят в стандартный осмотр врача-офтальмолога.
Биомикроскопия — осмотр глаза в щелевую лампу (микроскоп). Определяется изменение однородной структуры стекловидного тела, плавающие помутнения, нити и тяжи.
Лечение деструкции стекловидного тела
Целесообразность проведения терапии определяется индивидуально в зависимости от тяжести состояния пациента и выраженности симптомов.
Основное медикаментозное лечение направлено на устранение причин, вызвавших деструкцию стекловидного тела. К таким мерам относят нормализацию уровня сахара и холестерина, устранение воспалительных заболеваний. Терапия проводится смежными профильными специалистами, которые назначают витаминные препараты, средства для улучшения метаболизма и нормализации углеводного и холестеринового обмена.
При выраженных помутнениях и появлении тяжей возможно хирургическое лечение. Лазерная хирургическая операция, направленная на лечение деструкции стекловидного тела, называется витреолизисом.
Для проведения одного сеанса витреолизиса потребуется 300-400 вспышек. В зависимости от характера и выраженности деструкции понадобится от одной до пяти процедур.
Витреолизис проходит под местной капельной анестезией. После расширения зрачка и закапывания анестетика лазерный хирург-офтальмолог устанавливает на глаз специальную линзу, которая будет фокусировать луч лазера на фрагментах, которые требуется разрушить.
Противопоказания:
Осложнения:
Противопоказания к операции:
Осложнения витрэкомии:
При выявлении разрывов и дистрофий («решетчатой», «следа улитки» и других) требуется провести профилактическую ограничительную лазерную коагуляцию для снижения будущих рисков развития отслоения сетчатки. При наличии отслоения сетчатки может быть проведено лазерное лечение или операции эписклерального пломбирования или витрэктомии. Выбор процедуры зависит от расположения и объёма нарушений.
Прогноз. Профилактика
Как правило, прогноз при заболевании благоприятный. В большинстве случаев пациент быстро привыкает к появившимся «мушкам» и перестаёт их замечать. Особую категорию составляют больные с тревожно-мнительным типом личности и заболеваниями психики — для них плавающие «паутинки» могут стать неразрешимой проблемой. Такие пациенты настойчиво требуют назначения медикаментозного лечения и проведения хирургической операции, а также активно заниматься самолечением, в том числе с применением сомнительных методик нетрадиционной медицины. В этом случае проблема должна решаться с привлечением смежных специалистов.
Специфической профилактики, предотвращающей деструкцию стекловидного тела, не существует. Важно соблюдать здоровый образ жизни, следить за питанием и лечить сопутствующие заболевания, в первую очередь — атеросклероз, сахарный диабет и воспалительные заболевания глаз.