что такое скрининг у новорожденного ребенка
«Пяточный тест»: обычный и расширенный неонатальный скрининг
Неонатальный скрининг, известный как «пяточный тест» (или скрининг «пяточка», как называют его мамы) проводят всем новорожденным малышам без исключения. Анализ позволяет выявить наиболее распространенные генетические заболевания, которые представляют угрозу для жизни и здоровья ребенка.
Столь ранняя диагностика просто необходима, ведь дает возможность врачам своевременно начать лечение и избежать тяжелых осложнений. В России длительное время проводился неонатальный скрининг всего 5 наследственных заболеваний. Однако время не стоит на месте. С развитием новых технологий стало возможным расширить перечень болезней. Что сегодня включает «пяточный тест»?
Неонатальный скрининг: как проводится?
Обследование на генетические заболевания проводят детям в первые 10 дней после рождения. Забор капиллярной крови из пяточки выполняют медицинские сотрудники родильного дома или поликлиники доношенным детям на 4 сутки жизни, а недоношенным — на 7 сутки жизни.
Почему скрининг проводят так рано? Такие сроки обследования связаны с тем, что болезни, на которые проверяют малышей, дебютируют в первые месяцы жизни и угрожают развитием тяжелых необратимых осложнений.
Лечение, начатое до появления первых симптомов, увеличивает шансы на успех. Ребенок сможет полноценно расти и развиваться наравне со сверстниками.
Пребывая в хлопотах и заботах, родители порой забывают о том, что их малышу проводили скрининг. Действительно, ведь при отсутствии отклонений от нормы информировать их не принято. Зато при повышении того или иного показателя, у ребенка в кратчайшие сроки возьмут кровь на повторный анализ.
В дальнейшем, если диагноз будет подтвержден, то наблюдение и лечение будет осуществлять специалист в профильном учреждении.
Неонатальный скрининг: прошлое и настоящее
Неонатальный скрининг сейчас — это простой, доступный и перспективный метод обследования новорожденных для выявления тяжелых наследственных заболеваний.
Его история началась в 1960-х годах в США с проведения биохимического теста на выявление фенилкетонурии.
Затем технология распространилась во многих странах мира и стала основой для создания перечня генетических болезней, которые можно диагностировать у детей в первые дни после рождения.
Существуют определенные критерии, по которым заболевание включается в перечень для скрининга в стране:
Пожалуй, последний пункт особенно важен. Ведь основная цель неонатального скрининга — не столько выявить заболевание, сколько начать вовремя лечение, чтобы обеспечить полноценную жизнь ребенку.
На сегодняшний день неонатальный скрининг проводится более чем в 50 странах мира, а перечень насчитывает более 50-60 заболеваний.
При домашних родах или ранней выписке из родильного дома обследование тоже проводят. И пройти его нужно обязательно, это в интересах и родителей, и малыша.
Неонатальный скрининг: 5 основных заболеваний
В большинстве регионов России проводится неонатальный скрининг на 5 основных генетических заболеваний.
Характеризуется поражением центральной нервной системы. Единственный способ избежать тяжелых последствий — соблюдение диеты с низким содержанием фенилаланина уже с первой недели жизни ребенка.
Проявления заболевания разнообразны: от тяжелых нарушений водно-солевого обмена и полиорганной недостаточности до неправильного развития половых органов, маскулинизации и в дальнейшем бесплодия у девочек. В качестве лечения используется заместительная гормонотерапия.
При отсутствии должного лечения происходит задержка психомоторного и речевого развития, наступает отставание в физическом и половом развитии. Показана пожизненная заместительная терапия препаратами тиреоидных гормонов.
Основная роль в лечении отводится диете с пожизненным исключением продуктов, содержащих лактозу и галактозу.
Наиболее ярко болезнь проявляет себя со стороны органов дыхания — респираторная форма. Она дебютирует в раннем возрасте, проявляется частыми ОРВИ, бронхитами и пневмониями, сопровождается постоянным приступообразным кашлем с густой мокротой. В дальнейшем появляются и нарастают явления дыхательной и сердечной недостаточности.
Лечение муковисцидоза симптоматическое (единственное исключение из обязательной «пятерки» скрининга) направлено на снижение вязкости мокроты, восстановление проходимости бронхов и устранение инфекционного воспаления.
Скрининг новорожденных входит в программу ОМС и проводится бесплатно.
Расширенный неонатальный скрининг
Современная технология диагностики — тандемная масс-спектрометрия — позволила на порядок расширить перечень наследственных заболеваний, которые можно включить в программу скрининга новорожденных: болезни обмена веществ, гемоглобинопатии, спинальная мышечная атрофия, тяжелый комбинированный иммунодефицит и другие.
В Москве с 2018 года дополнительно включены 6 заболеваний, отвечающих критериям Всемирной организации здравоохранения:
Все эти заболевания со столь сложными названиями относят к врожденным болезням обмена веществ (ВБО) или врожденным аномалиям метаболизма.
Причина их появления — дефекты единичных генов, которые кодируют ферменты, способствующие превращению одних веществ в другие. В результате таких нарушений метаболизма происходит накопление токсических веществ, воздействующих на различные органы и ткани, и отмечается дефицит важных веществ.
25% всех врожденных болезней обмена веществ дебютирует уже в период новорожденности. При этом они протекают тяжело, часто скрываются под маской других заболеваний и могут привести к смерти ребенка без должного лечения.
Неонатальный скрининг позволяет предупредить дебют опасной болезни и вовремя начать терапию.
Все ВБО контролируются путем соблюдения соответствующей диеты, ограничивающей поступление в организм веществ, обмен которых нарушен. Или, наоборот, путем введения в организм недостающих метаболитов.
До внедрения технологии тандемной масс-спектрометрии в практику неонатального скрининга в Москве было проведено исследование в Свердловской области в 2012-2014 годах. Тестирование прошли более 150 тысяч новорожденных детей на 16 врожденных болезней обмена веществ. Всего было выявлено 9 больных детей, что составляет 1 случай на 1130 детей.
Результат близок к средней по стране распространенности этих заболеваний. Исследование доказало эффективность нового метода диагностики и возможность его внедрения в другие регионы страны.
Тяжелая комбинированная иммунная недостаточность — место в неонатальном скрининге
Первичные врожденные иммунодефициты характеризуются неспособностью организма противостоять микробам и вирусам. Это неизбежно приводит к частым инфекционным заболеваниям, протекающим тяжело, длительно, с осложнениями и необходимостью раз за разом принимать антибиотики.
Наиболее опасной формой первичного иммунодефицита является тяжелая комбинированная иммунная недостаточность (ТКИН), при которой у детей резко снижено число лимфоцитов.
Заподозрить врожденный иммунодефицит в первые месяцы жизни ребенка сложно, ведь какое-то время болезнь может ничем себя не проявлять или имитировать симптомы других более распространенных патологий. Однако именно время установления диагноза во многом определяет успех лечения.
Наиболее эффективный метод лечения детей с тяжелой комбинированной иммунной недостаточностью — это трансплантация гемопоэтических стволовых клеток. В случае ее проведения в возрасте до 3,5 месяцев и при отсутствии инфекционных процессов отмечается хороший результат.
Неонатальный скрининг на ТКИН уже проводится в США, Израиле, некоторых странах Европы, Ближнего Востока и Азии.
Внесение ТКИН в программу неонатального скрининга в нашей стране позволит на ранних сроках диагностировать тяжелый врожденный иммунодефицит, вовремя проводить соответствующее лечение и предупреждать инфекционные осложнения.
Решающая капля крови. Почему нельзя отказываться от неонатального скрининга?
Почему досрочное выписывание женщины из роддома после родов или домашние роды могут привести к умственной отсталости или преждевременной смерти ребенка?
Первый звонок
Светлана Каримова: «Я была в шоке, но мой папа, профессор, позвонил коллегам и выяснил, что анализы надо уточнять в медико-генетическом центре, при этом, если держать диету и принимать специализированные аминокислотные смеси, ребенок будет совершенно нормальным. Нам поставили диагноз «фенилкетонурия». При фенилкетонурии отсутствует один фермент, отвечающий за переработку аминокислоты — фенилаланина. В организме происходит накопление его токсичных производных: фенилпировиноградной и фениломолочной кислот (в норме они практически не образуются), которые в первую очередь отравляют головной мозг. Если диагноз устанавливается, например, к шести месяцам, эти процессы уже необратимы. Рацион больного составляет всего 6-9 граммов живого белка, который содержится в овощах и фруктах (для примера, в 100 граммах хлеба содержится 11 граммов белка), остальное — специализированные дорогие аминокислотные смеси. В 2002 году никакой особой помощи не было. Питание и аминокислоты мы получали с гуманитарной помощью. Потом принимали экспериментальное российское питание: получали баночки без наклейки и описывали побочные эффекты. Но других вариантов не было, иначе ребенку становилось бы хуже».
Генетический скрининг
В первые дни жизни всем новорожденным в России проводится обязательный неонатальный скрининг — по нескольким капелькам крови специалисты медико-генетического центра определяют, есть ли у малыша наследственные нарушения обмена веществ, которые впоследствии могут повлиять на его умственное и физическое развитие. Подобный скрининг проводится в 52 странах мира.
Фенилкетонурия (ФКУ) встречается у одного из 7 тысяч новорожденных. Уступая первое место врожденному гипотериозу, частота которого выше примерно в два раза, она является одним из наиболее распространенных наследственных нарушений обмена веществ, тест на которые в обязательном порядке проходят все российские детишки. С 2006 года Минздравом в список «подозреваемых» включены также муковисцидоз, адреногенитальный синдром и галактоземия. Все эти заболевания — редкие генетические изменения, большинство из которых передаются по наследству, хронически прогрессируют и при отсутствии лечения приводят к инвалидности и смерти.
Если лечение не начато вовремя, то уже спустя несколько месяцев после рождения у малыша появляются клинические проявления — симптомы и признаки, которые, в отличие от последствий обычных болезней, необратимы. Генетический тест в первые дни его жизни призван выявить болезнь на биохимическом уровне, пока она не успела внести свои коррективы в личность и физику ребенка.
Кровь для генетического анализа из пяточки младенца берут на четвертые сутки его жизни. Этот срок был признан оптимальным, так как на четвертый день можно выявить изменения анализов, характерные для всех перечисленных заболеваний. Ольга Медведева, врач-неонатолог, уточняет, что такой срок корректен, если ребенок развивался нормально.
У недоношенных же детишек забор крови происходит на седьмые сутки. Капелька крови наносится на специальный тест-бланк. На следующий день он отправляется в лабораторию, где из сухой пробы делают анализ. Результат теста появляется примерно через 10 дней, и если он отрицательный, мам не беспокоят. Если же обнаруживают отклонения, то родителей с ребенком через детскую поликлинику приглашают в медико-генетическую консультацию для повторного обследования. Если подтверждающая диагностика дает положительный результат, детей ставят на диспансерный учет и начинают терапию: при фенилкетонурии — в медико-генетической консультации, при врожденном гипотиреозе и адреногенитальном синдроме — у детского эндокринолога, при муковисцидозе и галактоземии — у педиатра (или в региональном центре муковисцидоза для этой болезни в ряде субъектов РФ).
Если анализ не был сделан в роддоме, его нужно пройти в поликлинике. Однако надо понимать, после выписки из роддома эти анализы на ответственности мамы и поликлиники, куда роддом передает все данные о малыше. В рамках полиса ДМС скрининг можно пройти дома. Если вы решили рожать в другой стране, то обязательный неонатальный скрининг делается по правилам этой страны и обычно покрывается страховкой.
В идеале скрининг должны проходить все новорожденные. Конечно, статистические 100 процентов недостижимы из-за показателей младенческой смертности и доли мертворожденных детей. Но и детки, которым повезло больше, иногда выпадают из программы неонатального скрининга, лишившись возможности на первых стадиях поймать нарушение, которое впоследствии сильно изменит их жизнь.
Что такое скрининг
Прямая речь:
Говорит замдиректора по научной работе Медико-генетического научного центра РАМН Вера Ижевская
— Впервые определение термина «просеивание», или «скрининг» (от английского screening — просеивание), дано J. Wilson, G. Jugner в 1968 году в официальном документе ВОЗ, согласно которому этот термин означает предположительное выявление недиагностированной ранее болезни или дефекта с помощью тестов, обследований или других процедур, дающих быстрый ответ. Это тестирование внешне здоровых людей с целью подразделения их на группы с высокой и низкой вероятностью заболевания. Скринирующие программы в медицине применяются достаточно широко (например, осмотр молочных желез у женщин по достижении определенного возраста и маммография для выявления рака молочной железы или туберкулиновые пробы — реакция Манту — детям для выявления туберкулеза). Применение скрининга новорожденных обусловлено рядом факторов: заболевания, на которые проводится скрининг, как правило, имеют тяжелые и во многих случаях фатальные проявления; без скрининга данные заболевания либо вообще не выявляются, либо обнаруживаются так поздно, что успевают произойти необратимые изменения и их лечение становится неэффективным; для них разработаны методы лечения, эффективные при ранней диагностике.
Существуют объективные причины, по которым младенцу не делается генетический тест. «Мы воздерживаемся от забора у детей с экстремально низкой массой тела (до 1 кг) в связи с тяжестью их состояния»,— отмечает Ольга Медведева. Тем более что раньше гражданами считались детки, родившиеся не ранее 28-й недели развития, но с 2012 года действует закон, по которому эта граница сдвинута на 22-ю неделю. В то же время дети, рожденные на 22-23-й неделе, зачастую не доживают до неонатального скрининга.
От любви до смерти
Неонатальный скрининг — обязательная процедура, к сожалению, женщины плохо или совсем не информированы о неонатальном скрининге, о заболеваниях, на которые проводится скрининг, его целях и последствиях отказа то этого анализа. Не все родители приходят на подтверждающую диагностику, когда их вызывают в МГК. Страшнее, что мамы стали отказываться от анализа сознательно. Роженицы стали взрослее (нормальным стало рожать в 27-28 лет), они обычно заинтересованы в своей беременности, часто лежат в платных палатах, начитаны. Но при возможности сделать скрининг заявляют, что не хотят причинять ребенку боль. Хотя забор крови для ребенка не является болезненным.
«Я бы не сказала, что женщины отказываются от скрининга сознательно, они явно не понимают серьезности такого решения до конца,— полагает заведующая отделением новорожденных Татьяна Горячева.— Многие после кропотливых бесед все же соглашаются делать анализ. Но некоторые замыкаются и стоят на своем, не понимая, что, следуя какой-то глупой моде, вредят своему ребенку»,— удивляется врач. Таким женщинам тяжело объяснить, что если проблема существует, ее можно и нужно будет решить сразу.
Если момент, в который можно было диагностировать заболевание, упущен, то через 2-3 месяца проявляются симптомы, и врачи, не знакомые с редким нарушением, затрудняются поставить правильный диагноз. В отсутствии лечения происходят необратимые изменения: при фенилкетонурии и врожденном гипотиреозе — умственная отсталость, при АГС без заместительной терапии ребенок может умереть. Кроме того, часть скринируемых заболеваний наследственные с высоким риском повторения в семье (фенилкетонурия, галактоземия, муковисцидоз, адреногенитальный синдром). После рождения больного ребенка родителям просто необходимо пройти медико-генетическое консультирование и обследование перед тем, как планировать следующую беременность.
Специалисты уверены, что о скрининге будущим мамам должны говорить заранее — это врачи, которые готовят их к родам, женские консультации, частные центры, где они ведут беременность. В предродовом же состоянии женщина находится в стрессе и не может принять логичное решение по биологическим причинам, а после уже занята проблемами с ребенком.
По словам Светланы Каримовой, нужно обязательное обучение и соответствующее указание Минздрава, чтобы медперсонал и сотрудники консультации говорили об этом анализе авторитетно, а роженицы к моменту забора крови уже хорошо понимали, что это такое.
В списке живых
В России массовое обследование новорожденных на фенилкетонурию стало проводиться с 1985 года, хотя в отдельных регионах в Советском Союзе он проводился и ранее. В 1993 году в рамках президентской программы «Дети России» стал внедряться скрининг на врожденный гипотиреоз. С 2006 года, согласно приказу Министерства здравоохранения и социального развития Российской Федерации от 22 марта 2006 года N 185 «О массовом обследовании новорожденных детей на наследственные заболевания» в России проводится неонатальный скрининг на пять наследственных заболеваний: фенилкетонурию, гипотиреоз, муковисцидоз, адреногенитальный синдром и галактоземию.
С начала применения неонатального скрининга в нашей стране почти все случаи фенилкетонурии и гипотериоза выявлялись благодаря ему. Диагнозы же на остальные болезни до 2006 года ставились поздно, при развернутой клинической картине. Нередко из-за того, что большинство врачей не наблюдают такие нарушения в ежедневной практике, диагнозы ставили неверно и людей лечили совсем от других болезней, позволяя развиваться настоящей катастрофе. Сейчас же, утверждает Ольга Медведева, персонал медико-генетической консультации действительно следит, чтобы больных детишек находили, и никого не бросает.
Хотя надо понимать, что пока речь идет только о пяти заболеваниях. Этого категорически мало. В США скрининг доходит до 45 наследственных болезней, в Германии — до 14. Упомянутая уже ассоциация «Генетика» бьется за то, чтобы в России список заболеваний, включенных в обязательный скрининг, расширили. Потому что это позволит сократить число больных с редкими или неизлечимыми заболеваниями или просто спасти от смерти.
Светлана Каримова, рассказывает: «Мы используем импортное питание, которое выдают в медико-генетическом центре. Поддержка препаратами взрослого человека при фенилкетонурии стоит 40-45 тысяч рублей в месяц плюс затраты на продукты питания с низким содержанием белка (пачка хорошей муки, например, стоит около 500 рублей). Вы не отличите мою дочку от других детей. Но уходить с диеты нельзя. Мы с мужем планируем рождение еще одного ребенка. Я носитель мутационного гена ФКУ, и даже если анализы мужа покажут, что он тоже носитель, мы готовы растить будущего малыша. Конечно, бывает страшно, но я знаю, что с патологиями можно столкнуться, и умею с ними бороться. Ведь каждый человек — носитель мутационных генов, и соответственно столкнуться с этим может каждый».
Дети в процентах
Статистика
В 2013 году, по данным Минздрава, из 1 887 574 новорожденных обследованы 1 880 125 (от 98,5 до 99,6%). У 1281 из них выявлены заболевания (фенилкетонурия — 285, врожденный гипотиреоз — 523, адреногенитальный синдром — 198, галактоземия — 83, муковисцидоз — 192). По данным ведомства, за 7 месяцев 2014 года (январь — июль) на территории России родились 1 014 725 детей (на 18 тысяч больше, чем за аналогичный период прошлого года). Из них практически все прошли неонатальный скрининг (от 95,7 до 99,1%), нарушения выявлены у 595 детей.
Неонатальный скрининг
Неонатальный скрининг, ласково именуемый в нашей стране «пяточка», является одним из первых важных исследований новорожденного. В России скрининг преимущественно направлен на выявление пяти наследственных болезней обмена: фенилкетонурии, врожденного гипотиреоза, врожденной дисфункции коры надпочечников (ВДКН), галактоземии и муковисцидоза. За рубежом этот список расширен до 50 различных заболеваний, в некоторых штатах Америки их свыше 60. Здоровый доношенный новорожденный допускается к скринингу на 4–5 сутки, недоношенный — на седьмой день после рождения. Заболевания, на выявление которых направлен скрининг, никак не проявляют себя в периоде новорожденности, но их ранняя диагностика и своевременно начатое патогенетическое лечение существенно влияют на прогноз и качество жизни ребенка. Помимо исследования крови проводится аудиометрия для оценки слуха и пульсоксиметрия для скрининга пороков сердца, но в данной статье мы преимущественно сосредоточимся на тестировании крови.
Разработка программы скрининга началась в шестидесятых годах прошлого века, когда Роберт Гатри создал технологию тестирования сухих отпечатков крови на фильтровальной бумаге. Первым заболеванием, которое стало кандидатом для массовой диагностики, была фенилкетонурия, так как ее раннее выявление и коррекция питания способны предотвратить развитие тяжелых неврологических нарушений. Затем к скринингу добавилось еще несколько заболеваний: врожденный гипотиреоз, ВДКН, галактоземия и муковисцидоз. Тандемная масс-спектрометрия (ТМС) позволила значительно расширить список заболеваний, добавив к болезням обмена веществ гемоглобинопатии, спинальную мышечную атрофию, тяжелый комбинированный иммунодефицит и др.
Таблица 1 | Рекомендуемая The American College of Obstetricians and Gynecologists (ACOG) скрининг-панель для врожденных заболеваний
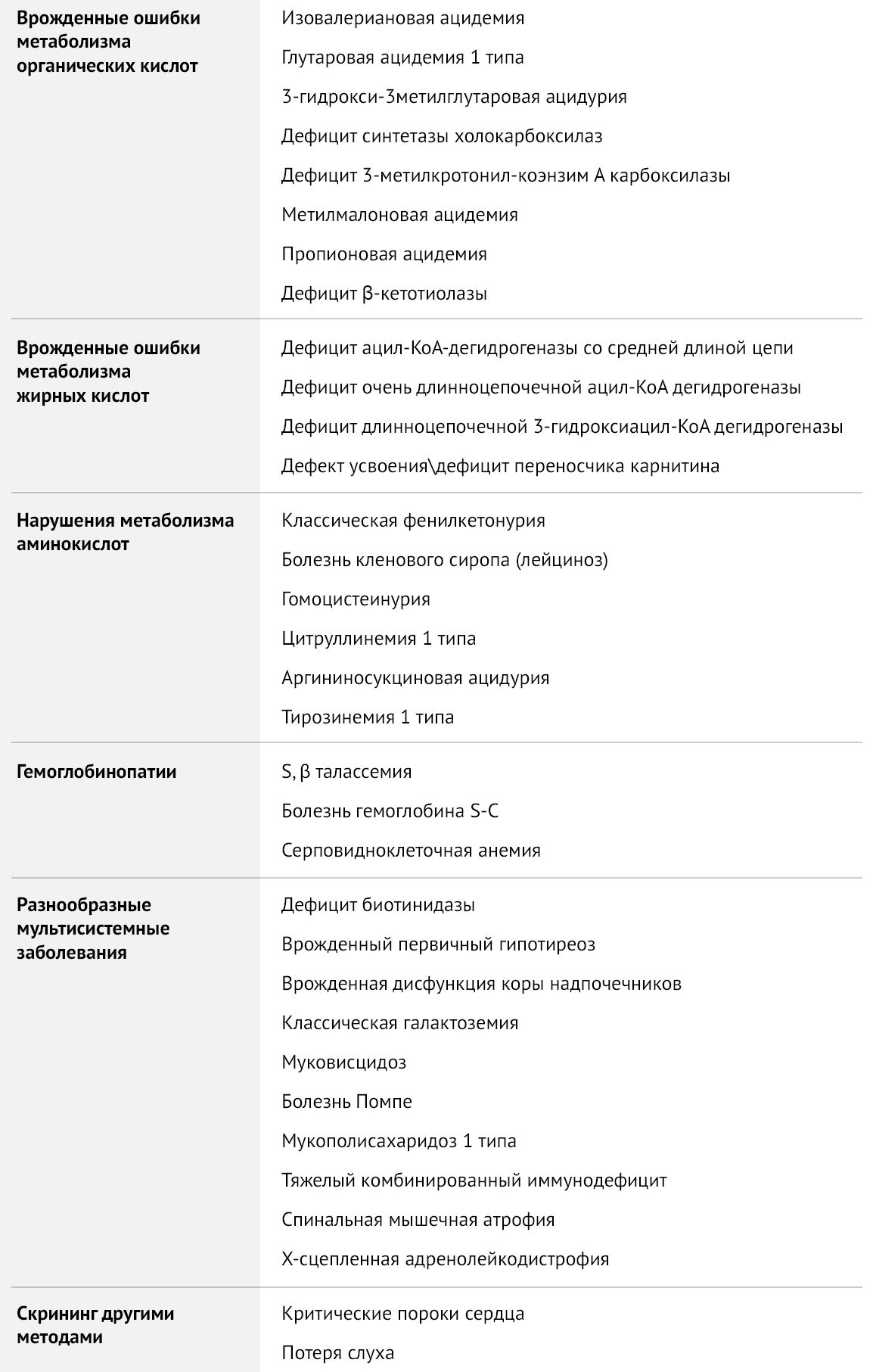
В данной статье будут рассмотрены два скрининга, доступные в нашей стране: обязательный, включающий тестирование на пять заболеваний (врожденный гипотиреоз, ВДКН, фенилкетонурия, галактоземия, муковисцидоз) и расширенный скрининг на наследственные нарушения метаболизма.
Обязательный скрининг
На 4–5 сутки после рождения здорового доношенного ребенка или на седьмые сутки жизни недоношенного ребенка проводится тестирование методом «сухого пятна».
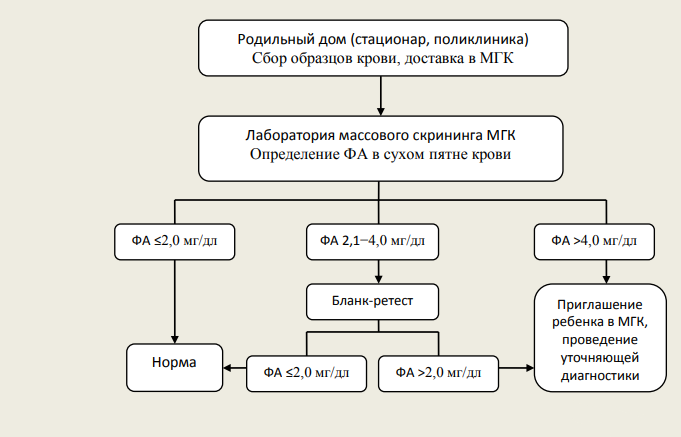
Фенилкетонурия (в современной классификации ― ФАГ-зависимая ФКУ) обусловлена мутацией гена фенилаланингидроксилазы и относится к числу аминокислотных аминоацидопатий. В норме фенилаланин (ФА) путем реакций гидроксилирования превращается в тирозин, однако в случае мутации вышеназванного гена активность превращающего фермента снижается, создается дефицит тирозина одновременно с избытком ФА, образующего токсичные метаболиты (фенилацетат, фенилпируват, фениллактат). Снижение образования тирозина влечет за собой нарушение синтеза гормонов щитовидной железы, нейротрансмиттеров и пигментов меланоцитов, а избыток ФА приводит к дисбалансу аминокислот в тканях мозга, обусловленному торможением их всасывания в желудочно-кишечном тракте или нарушением реабсорбции из почечных канальцев, нарушению образования или стабилизации полирибосом, снижению синтеза миелина, норадреналина и серотонина. Также за счет конкурентного ингибирования создается дефицит тирозиназы, что в совокупности с дефицитом тирозина приводит к снижению образования меланина и гипопигментации.
Основной проблемой пациентов с ФКУ являются нарушения функции ЦНС: от сонливости, вялости, отсутствия аппетита в период манифестации в 2–6 месяцев до тяжелых нарушений психомоторного развития в будущем; нередко развиваются атаксия, гиперкинезы, тремор рук, парезы по центральному типу. Единственный способ предотвратить развитие вышеназванных нарушений — назначение гипофенилаланиновой диеты с момента рождения с поддержанием низкого уровня фенилаланина в течение всей жизни.
Рисунок 1 | Интерпретация результатов исследования на наличие фенилкетонурии
ВДКН обусловлена дефицитом ферментов и транспортных белков, участвующих в биосинтезе кортизола. Наиболее часто встречается дефицит 21-гидроксилазы, что в свою очередь приводит к дефициту кортизола и альдостерона и ответному увеличению секреции АКТГ и гиперплазии коры надпочечников. В условиях дефицита фермента происходит значительное накопление предшественников гормонов, что приводит к увеличению синтеза тестостерона, не зависящего от 21-гидроксилазы. В итоге у пациента формируется надпочечниковая недостаточность и гиперандрогения. Гормональным маркером дефицита 21-гидроксилазы является уровень 17-гидроксипрогестерона (17-ОНП), определяемый в рамках неонатального скрининга. Результат трактуется как положительный, если при двукратном тестировании образца уровень 17-ОНП у доношенных новорожденных составляет ≥ 20 нг/мл. У недоношенных детей при заборе крови на 7–8 сутки после рождения скрининговый результат трактуется как положительный при следующих уровнях 17-ОНП: на сроке 23–32 недели гестации ― ≥ 65 нг/мл; на сроке 33–36 недель гестации ― ≥ 40 нг/мл.
Врожденный гипотиреоз в большинстве случаев вызван дефектами самой щитовидной железы (первичный гипотиреоз). Причины первичного врожденного гипотиреоза можно в широком смысле классифицировать как неспособность щитовидной железы нормально развиваться (дисгенезия) или неспособность структурно нормальной щитовидной железы производить нормальные количества гормона (дисгормоногенез). Дисгенезия щитовидной железы, охватывающая весь спектр агенеза, гипоплазии и эктопии, является наиболее частой причиной врожденного гипотиреоза. В то время как это заболевание остается наиболее частой причиной врожденного гипотиреоза, частота возникновения дисгормоногенеза за последние несколько десятилетий увеличилась. В то время как на дисгормоногенез приходится только 15 % врожденного гипотиреоза, диагностированного в первые дни скрининга новорожденных, у 30–40 % младенцев, прошедших скрининг по современным протоколам, имеется эктопическая щитовидная железа, соответствующая одной из форм дисгормоногенеза. В отличие от дисгенезии щитовидной железы, при которой моногенная причина присутствует только у небольшого количества пациентов, дисгормоногенез часто возникает из-за генетического дефекта на каком-либо этапе синтеза тиреоидных гормонов.
Учитывая разнообразие функций тиреоидных гормонов в организме человека, врожденный гипотиреоз характеризуется разнообразием клинических проявлений с поражением всех органов и систем. При отсутствии своевременного лечения на первый план выходит задержка психомоторного и речевого развития, затем наступают отставание в физическом развитии и задержка полового развития. Основной задачей скрининга является наиболее раннее выявление детей с подозрением на врожденный гипотиреоз.
Рисунок 2 | Интерпретация результатов исследования на наличие врожденного гипотиреоза
Галактоземия — аутосомно-рецессивное наследственное нарушение обмена углеводов, при котором в организме накапливается избыток галактозы и ее метаболитов. В норме галактоза образуется в результате гидролиза лактозы в кишечнике либо в процессе ферментных реакций, обмена гликопротеинов и гликолипидов. Галактоза является материалом для образования клеточных мембран, нервной ткани, нервных окончаний и т. д. В результате ферментных реакций она превращается в глюкозу, и именно дефицит галактозо-1-фосфатуридилтрансферазы лежит в основе патогенеза данного заболевания. Метаболиты галактозы обладают повреждающим действием. Так, галактитол проникает в хрусталик глаза, приводя к повышению осмотического давления, электролитным нарушениям и денатурации белка с формированием катаракты. Другие метаболиты обладают гепато-, нейро- и нефротоксическим действиями, а также вызывают гемолиз эритроцитов. Тормозящее влияние метаболитов галактозы на углеводный обмен приводит к гипогликемии.
Рисунок 3 | Интерпретация результатов исследования на наличие галактоземии
Муковисцидоз — аутосомно-рецессивное заболевание, связанное с мутацией гена МВТР (трансмембранного регулятора муковисцидоза). МВТР является хлорным каналом, мутации гена которого нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким. Поражаются все экзокринные железы организма: печень, поджелудочная железа, мочеполовая система, но наиболее ярко муковисцидоз проявляет себя со стороны органов дыхания, провоцируя бронхообструкцию, дыхательную и сердечную недостаточность, легочную гипертензию.
Рисунок 4 | Интерпретация результатов исследования на наличие муковисцидоза
Расширенный скрининг
Органические ацидемии — группа аутосомно-рецессивных наследственных заболеваний обмена, в основе патогенеза которых лежит дефицит ферментов, участвующих в метаболизме белков, что приводит к повышению уровня кетоновых тел, обладающих токсическим действием на различные органы и ткани, в частности, на ЦНС. Данные заболевания манифестируют уже в стадии декомпенсации, как правило, в период с первой недели до первого года жизни. Триггерами служат стресс, длительное голодание, инфекционные заболевания, иммунизация, реже — чрезмерное употребление белковой пищи. Проявляются преимущественно неврологической симптоматикой: нарушение сознания вплоть до комы, эпилептические приступы, нарушение мышечного тонуса, у детей старшего возраста — нарушения психоречевого развития, атаксия, очаговые неврологические симптомы, синдром Рейе (острая печеночная недостаточность, сочетающаяся с энцефалопатией), психические расстройства.
Нарушения окисления жирных кислот — врожденный дефект метаболизма из-за нарушения либо митохондриального β-окисления, либо транспорта жирных кислот с использованием карнитинового транспортного пути. Проявления зависят от нарушения метаболизма конкретной кислоты, но все они имеют общие черты и требуют схожей тактики лечения. В периоде новорожденности метаболические нарушения проявляются тяжелой кардиомиопатией, гипокетотической гипогликемией, дисфункцией печени в первые несколько дней или недель жизни, часто заканчиваясь летально. В младенческом и детском возрасте характерны эпизоды летаргии и рвоты, развивается дисфункция печени и гипокетотическая гипогликемия, энцефалопатия, что может привести к внезапной младенческой смерти. У подростков и во взрослом возрасте дебютируют эпизодическим рабдомиолизом, мышечной слабостью, миалгией. Лечение включает отказ от голодания, симптоматическую терапию развившихся осложнений и включение в рацион добавок, если это необходимо.
Аминоацидопатии
Болезнь кленового сиропа (она же лейциноз) — наследственное заболевание, обусловленное дефицитом дегидрогеназы кетокислот с разветвленной цепью и нарушением метаболизма лейцина, изолейцина, валина (аминокислоты с разветвленной цепью, АКЦР). Повышение уровня АКЦР и их метаболитов, в частности, кетокислот, приводит к кетоацидозу, атрофии ткани головного мозга, нарушению окислительного фосфорилирования в дыхательной цепи митохондрий. Избыток лейцина обладает нейротоксическим эффектом, вызывая дисфункцию астроцитов, апоптоз нейронов и блокируя транспорт через гематоэнцефалический барьер аминокислот, важных для синтеза нейротрансмиттеров.
Гомоцистеинурия — наследственное заболевание из группы аминоацидопатий, обусловленное нарушением метаболизма серосодержащих аминокислот, в частности, метионина. Дефицит цистатион-b-синтазы нарушает преобразование метионина в цистеин. Высокий уровень гомоцистеина связан с образованием некротически-дегенеративных участков в почках, селезенке, слизистой оболочке желудка и сосудах, активацией XII фактора свертывания, способствующего тромбообразованию.
Тирозинемия 1 типа — заболевание, обусловленное дефицитом фумарилацетоацетатгидролазы, в результате чего происходит накопление высокотоксичных фумарил- и малеилацетоацетата, обладающих гепатотоксическим и канцерогенным действием. Конечные метаболиты — сукцинилацетон и сукцинилацетоацетат — являются митохондриальными токсинами, тормозящими фосфорилирование и блокирующими цикл Кребса. Накопление токсинов приводит к прогрессирующему заболеванию печени с развитием печеночной недостаточности, цирроза, тубулопатии с формированием ренальной тубулопатии, гипофосфатемического рахита, синдрома Фанкони. Острая тирозинемия сопровождается развитием гипертрофической кардиомиопатии. Кроме того, нарушается путь синтеза порфирина, ингибируется синтез порфобилиногена, что приводит к кризам, проявление которых напоминает порфирию. Все пациенты подвержены высокому риску развития гепатоцеллюлярной карциномы, вторичной по отношению к циррозу. Без своевременного лечения дети погибают в возрасте 10 лет.