что такое синдром ваарденбурга
Ваарденбурга синдром
OMIM 193500
Наша команда профессионалов ответит на ваши вопросы
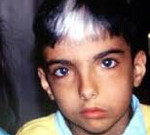
Синдром Ваарденбурга (Waardenburg syndrome) назван именем голландского офтальмолога P.J. Waardenburg, который в 1951г. описал комплекс главных симптомов заболевания: широкая переносица из-за латерального смещения внутреннего угла глаза (dystopia conthorum); пигментные аномалии кожи, волос (белая прядь, белые ресницы) и глаз (гетерохромия радужки); и сенсоневральная тугоухость. В настоящее время в зависимости от присутствия дополнительных симптомов выделяют 4 клинических типа WS (WS1, WS2, WS3, WS4), большинство из которых наследуется по аутосомно-доминантному типу с неполной пенетрантностью и варьирующей экспрессивностью.
WS1 (MIM 193500) включает основные симптомы WS, при этом согласно диагностическим критериям, принятым Консорциумом по синдрому Ваарденбурга, диагноз ставится при наличии двух главных симптомов либо одного главного и двух минорных (врожденная лейкодерма, широкая выступающая переносица и др.).
WS2 (MIM 193510) характеризуется исключительно сочетанием нарушений слуха и пигментации без каких-либо других признаков. Нередко оказывается сложным различить WS1 и WS2, поскольку единственным отличием WS2 от WS1 является отсутствие dystopia conthorum.
При более тяжелом WS3 (MIM 148820), или синдроме Клейна-Ваарденбурга (Klein-Waardenburg syndrome), помимо крайнего проявления симптомов WS1 наблюдается гипоплазия мышц верхних конечностей.
При WS4 (MIM 277580), также называемом синдромом Ваарденбурга-Шаха (Waardenburg-Shah syndrome) или болезнью Ваарденбурга-Гиршпрунга (Waardenburg-Hirschsprung disease), наблюдается сочетание нарушений слуха и пигментации и признаков болезни Гиршпрунга (MIM 600155, истинный врожденный мегаколон: стойкие запоры, динамическая кишечная непроходимость, агенезия ганглиев межмышечного и подслизистого нервных сплетений в различных участках кишечника). Описана также клиническая форма WS4 с различными признаками нарушения миелинизации периферической и центральной нервной системы, объединенные в синдром PCWH syndrome (peripheral demyelinating neuropathy, central dysmyelinating leukodystrophy, WS, and Hirschsprung disease)(MIM 609136).
Патогенетически WS представляет собой одно из заболеваний развития нервного гребня (нейрокристопатию): в эмбриогенезе плюрипотентные клетки нервного гребня мигрируют из нервной трубки и дают начало различным типам клеток эмбриона (в том числе, глие и нейронам периферической нервной системы, глие и нейронам кишечника, некоторым тканям черепно-лицевого скелета, меланоцитам кожи и сетчатки глаза), нарушение же пролиферации, миграции, дифференцировки или изменение жизнеспособности меланоцитов, производных нервного гребня, может приводить к характерному сочетанию нарушения слуха и пигментации при WS.
Преобладающее большинство, если не все, случаи WS1 и WS3 обусловлены гетерозиготными мутациями в гене РАХ3, кодирующем транскрипционный фактор. Описаны также семьи, в которых отдельная мутация в гене РАХ3 в гетерозиготном состоянии привела к развитию WS1, а в гомозиготном – к более тяжелому WS3.
15% случаев WS2 обнаружены гетерозиготные мутации в гене MITF, кодирующем транскрипционный фактор. У отдельных больных выявлены делеции в гомозиготном состоянии в гене SNAI2, кодирующем транскрипционный фактор. Для 70% случаев WS2 молекулярный дефект в настоящее время не установлен.
Большинство различных гетерозиготных мутаций в гене SOX10, кодирующем транскрипционный фактор SOX семейства, обуславливают развитие классической и неврологической (PCWH syndrome) форм WS4. Однако еще в 15% случаев WS2 выявлены протяженные делеции в данном гене или целого гена.
Гомозиготные и гетерозиготные мутации в гене рецептора эндотелина-В (EDNRB) и в гене его лигинда эндотелина-В (EDN3) могут также приводить к WS4, при этом для гена EDNRB наблюдается плейотропный эффект. Мутации в этих же генах с неполной пенетрантностью приводят и к изолированной болезни Гиршпрунга без признаков синдрома Ваарденбурга.
Известно, что РАХ3 и SOX10 напрямую регулируют экспрессию MITF. MITF, в свою очередь, трансактивирует ген тирозиназы, ключевой фермент в процессе синтеза меланина, и непосредственно участвует в дифференцировке меланоцитов. Отсутствие меланоцитов приводит к нарушению пигментации кожи, волос и глаз, функционирования клеток улиткового ганглия. Поэтому гипопигментация и нарушения слуха при WS, по-видимому, связаны с аномалиями в дифференцировке меланоцитов, вызванными мутациями в генах РАХ3, MITF и SOX10.
Для подтверждения диагноза WS1 и WS3 в Центре Молекулярной Генетики проводится анализ мутаций в гене PAX3, для диагностики WS4 и изолированной болезни Гиршпрунга возможен также анализ мутаций в гене EDNRB. Поиск мутаций в данных генах выполняется методом прямого секвенирования кодирующих областей и областей экзон-интронных соединений генов.
Что такое синдром ваарденбурга
Самой распространенной причиной синдромальной аутосомно-доминантной тугоухости является синдром Варденбурга, который имеет различную пенетрантность. Примерно 1-2% всех случаев крайне тяжелой тугоухости приходятся на синдром Варденбурга. Чаще всего встречается синдром Варденбурга 1 и II типов.
Тип I встречается чаще, он связан с мутацией гена РАХЗ, который кодирует транскрипционный фактор paired-бокс 3. Основным клиническим признаком синдрома Варденбурга, имеющим наибольшую пенетрантность, является телекант (более латеральное расположение латерального угла глаза), также характерно наличие одного или более следующих признаков: нейросенсорная тугоухость, в большинстве случаев (но не всегда) врожденная, двусторонняя, симметричная, непрогрессирующая (пенетрантность тугоухости составляет около 36-58%); высокая и широкая спинка носа; синофриз (сросшиеся брови); аномалии пигментации радужки, например, гетерохромия (разный цвет глаз), насыщенно-синий цвет глаз, двухцветные глаза; преждевременная потеря пигментации волос или наличие седой пряди; седые брови или ресницы; гиперпигментация и/или гипопигментация кожи (белые или светлые пятна на коже); вестибулярные симптомы (головокружение, шаткость); нарушения при прохождении различных вестибулярных проб.
Для синдрома Варденбурга II типа характерно отсутствие телеканта, более высокая пенетрантность тугоухости (менее тяжелая, чем при типе I, но чаще прогрессирующая), наличие гетерохромии радужки. Чаще всего с типом 11 связана мутация гена MITF (microphthalmia associated transcription factor, транскрипционный фактор микрофтальмии).
Синдром Варденбурга III и IV типов встречается редко. Тип III характеризуется теми же чертами, что и тип I, но при этом для него также характерно наличие контрактур верхних конечностей и гипоплазия мышц. Тип IV характеризуется теми же чертами, что и тип II, но при этом также сочетается с болезнью Гиршпрунга (нарушение вегетативной иннервации толстой кишки, проявляющееся ее расширением и обструкцией).
Синдром Варденбурга подробно описан в статье из раздела генетика.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Ваарденбурга
Синдром Ваарденбурга – генетически гетерогенное наследственное заболевание, характеризующееся комплексом аномалий и пороков развития, обусловленных нарушением формирования структур нервного гребня в эмбриональном периоде. Симптомами этого состояния являются смещение латерального угла обоих глаз, широкая переносица («греческий профиль»), пигментные аномалии кожи, волос и радужной оболочки, тугоухость. Диагностика синдрома Ваарденбурга производится на основании данных настоящего статуса пациента, аудиометрических и офтальмологических исследований, изучения наследственного анамнеза и молекулярно-генетических анализов. Специфического лечения этого состояния не существует, терапевтические мероприятия направлены на устранение и облегчение симптомов патологии.
Общие сведения
Синдром Ваарденбурга – наследственное заболевание из группы нейрокристопатий – патологий, обусловленных нарушением эмбрионального развития структур так называемого нервного гребня. Впервые симптомокомплекс, характерный для данного заболевания, был описан голландским офтальмологом П. Ваарденбургом в 1951 году. В последующие годы достижения в области генетики позволили определить причины синдрома Ваарденбурга и вариабельность клинического течения данной патологии.
Механизм наследования этого заболевания различный по причине генетической гетерогенности – чаще всего имеет место аутосомно-доминантный тип с неполной пенетрантностью, однако описаны и аутосомно-рецессивные разновидности. Встречаемость синдрома Ваарденбурга всех типов составляет примерно 1 случай на 40 000 новорожденных, в южных регионах Австралии частота несколько выше, что позволяет сделать предположение о возникновении патологии в этом регионе. Согласно данным медицинской статистики, этим заболеванием обусловлено от 2 до 5% всех случаев наследственной тугоухости и глухоты. Половое распределение синдрома Ваарденбурга не имеет особенностей, мальчики и девочки поражаются с одинаковой частотой.
Классификация и причины
В настоящий момент выделено четыре клинических типа синдрома Ваарденбурга, некоторые из них делятся на подклассы в зависимости от гена, мутации которого привели к развитию заболевания. Общей причиной всех форм патологии является нарушение формирования структур нервного гребня в эмбриональном периоде – это приводит к порокам развития лица, пигментным аномалиям, расстройствам слуха и иногда зрения. Дизэмбриогенез при синдроме Ваарденбурга обусловлен дефектами генов, в большинстве случаев кодирующих белки-факторы транскрипции, то есть, отвечающих за экспрессию других генов.
Синдром Ваарденбурга 1-го типа (WS1) является наиболее распространенным вариантом патологии с аутосомно-доминантным типом наследования, но различной экспрессивностью. Его причиной становятся мутации в гене PAX3, расположенном на 2-й хромосоме. Продуктом его экспрессии является транскрипционный фактор, предположительно контролирующий процессы миграции клеток в нервном гребне и влияющий на экспрессию гена MITF. Помимо синдрома Ваарденбурга 1-го типа, мутации в гене PAX3 приводят к 3-му типу аналогичного заболевания (WS3), также доказано его участие в развитии рабдосаркомы.
Синдром Ваарденбурга 2-го типа (WS2) обуславливает порядка 20-25% всех случаев данной патологии, имеет как минимум четыре подкласса (a, b, c, d), однако наиболее изученными являются WS2a и WS2d. Первый обусловлен дефектами гена MITF, локализованного на 3-й хромосоме, он кодирует транскрипционный фактор, активизирующий работу гена тирозиназы – ключевого фермента развития меланоцитов. Синдром Ваарденбурга WS2d вызван мутациями гена SNAI2, расположенного на 8-й хромосоме, он также кодирует один из факторов активизации транскрипции. Функции генов, обуславливающих WS2b и WS2c, на сегодняшний момент неясны, известно только, что они расположены на 1-й и 8-й хромосомах соответственно.
Синдром Ваарденбурга 3-го типа (WS3, синдром Клейна-Ваарденбурга, названный в честь швейцарского врача Д. Клейна) является наиболее тяжелым вариантом данного состояния. Он вызывается мутациями гена PAX3 (который является причиной WS1), однако при этом дефектные формы гена у больных находятся в гомозиготном состоянии или имеет место нонсенс-мутация.
Синдром Ваарденбурга 4-го типа (WS4, синдром Ваарденбурга-Шаха) – является, в отличие от других типов заболевания, патологией с аутосомно-рецессивным механизмом наследования. Имеет три разновидности (a, b, c), вызываемые мутациями различных генов. WS4a обусловлен мутацией гена EDNRB, который локализован на 13-й хромосоме и кодирует последовательность сложного белка В-эндотелина. Синдром Ваарденбурга WS4b по молекулярному патогенезу схож с предыдущим вариантом, поскольку вызывается дефектами гена EDN3 – он расположен на 20-й хромосоме и кодирует лиганд В-эндотелина. В отличие от них, WS4c обусловлен мутацией гена SOX10 – представителя обширной группы регуляторных генов. Он располагается на 22-й хромосоме.
Симптомы
Клиническая картина синдрома Ваарденбурга во многом зависит от типа заболевания, при этом имеются некоторые общие для всех типов проявления. Так, при патологии любого типа в 99% случаев у больных наблюдается латеральное смещение наружного угла глаза (телекант), в двух третях случаев регистрируется расширение переносицы. Примерно у половины всех лиц, страдающих синдромом Ваарденбурга, возникает белая прядь волос выше лба, гетерохромия радужки, врожденная очаговая лейкодермия, тугоухость различной степени выраженности вплоть до глухоты. Заболевание характеризуется высокой вариабельностью проявлений не только между типами, но и между носителями одного и того же патологического гена – в пределах одной семьи или даже у однояйцевых близнецов могут наблюдаться различные симптомы.
Синдром Ваарденбурга 1-го типа считается классическим и характеризуется наличием телеканта, пигментных нарушений кожи, волос и радужной оболочки и другими типичными для этого заболевания аномалиями лица. Особенностью WS2 любого подкласса является наличие только изолированных аномалий пигментации и нарушений слуха – от 1-го типа патологии его дифференцируют по отсутствию смещения латерального угла глаза. Синдром Ваарденбурга 3-го типа клинически протекает более тяжело, нарушения пигментации, тугоухость и пороки развития лица выражены достаточно сильно. Кроме того, для этого варианта заболевания также характерно развитие гипоплазии мышечной ткани, преимущественно на верхних конечностях.
Проявления синдрома Ваарденбурга 4-го типа (синдром Ваарденбурга-Шаха) включают в себя симптомы болезни Гиршпрунга – нарушения вегетативной иннервации некоторых отделов желудочно-кишечного тракта. Для этого варианта заболевания, помимо типичных нарушений пигментации, нейросенсорной тугоухости и глухоты также характерны боли в животе, запоры, метеоризм, врожденное расширение ободочной кишки – мегаколон. Выраженность этих проявлений зависит от длины участка толстой кишки, лишенной подслизистого нервного сплетения. Кроме этого, некоторые случаи синдрома Ваарденбурга 4-го типа сопровождаются нарушениями миелинизации нервных волокон, преимущественно периферических – исследователи иногда выделяют такие случаи в отдельную разновидность под названием PCWH-синдром.
Диагностика
Определение синдрома Ваарденбурга производится на основании данных осмотра больного, изучения его наследственного анамнеза, офтальмологических и аудиометрических исследований. Окончательное подтверждение диагноза дает молекулярно-генетический анализ. Кроме того, в отношении некоторых форм заболевания могут использоваться такие дополнительные методы диагностики, как электромиография (при WS3), биопсия стенки толстой кишки (при WS4). При осмотре больного синдромом Ваарденбурга, как правило, выявляется характерный внешний вид лица (смещение латеральных уголков глаз, широкая переносица), лейкодермия различной выраженности, очень часто виден белый пучок волос надо лбом. Радужные оболочки глаз могут иметь разный цвет (гетерохромия) или вставки другого оттенка в форме сектора.
Аудиометрические исследования при синдроме Ваарденбурга зачастую обнаруживают снижение слуха вплоть до полной глухоты. Обычно тугоухость при этом заболевании не имеет тенденции к прогрессированию. В редких случаях синдром Ваарденбурга может сопровождаться врожденными пороками сердца, расщелиной твердого нёба и другими тяжелыми нарушениями, при 3-м типе заболевания определяется гипоплазия мышц верхних конечностей. При подозрении на наличие WS4 производят контрастную рентгенографию толстого кишечника, при наличии расширенных участков осуществляют биопсию стенки кишки в их области – в случае синдрома Ваарденбурга 4-го типа там выявляется отсутствие нервных сплетений. Врачом-генетиком может быть выполнена молекулярно-генетическая диагностика практически любой формы этого заболевания методом секвенирования ассоциированных с ним генов. Также может производиться определение носительства дефектной формы гена в случае отягощенного наследственного анамнеза и пренатальная диагностика синдрома Ваарденбурга.
Лечение синдрома Ваарденбурга
Специфической терапии этого заболевания на сегодняшний день не существует, применяется только симптоматическое лечение, а также мероприятия, направленные на улучшение качества жизни больного. Тугоухость и глухоту при синдроме Ваарденбурга можно компенсировать имплантацией кохлеарного аппарата, причем это необходимо делать как можно раньше для нормального развития речи у ребенка. В случае развития тех или иных офтальмологических нарушений может потребоваться коррекция в виде ношения очков или контактных линз. Гипоплазия мышц, характерная для синдрома Ваарденбурга 3-го типа, может уменьшаться при регулярных занятиях лечебной гимнастикой и использовании физиотерапевтических процедур. Поражение желудочно-кишечного тракта при WS4 устраняется хирургическим путем – посредством удаления патологически измененных участков кишечника.
Прогноз и профилактика
В большинстве случаев прогноз синдрома Ваарденбурга благоприятный, так как пороки развития при этом заболевании зачастую не угрожают жизни больного и не имеют тенденции к прогрессированию. В редких случаях наличие дополнительных аномалий развития при этой патологии (пороки сердца, кишечника, расщепление нёба, гидроцефалия) может несколько ухудшить прогноз. Важнейшим фактором снижения качества жизни больных синдромом Ваарденбурга является тугоухость и глухота, которые при поздней диагностике могут привести к нарушению развития речи. Нередко из-за нарушения пигментации глаз и кожи, у лиц с этой патологией возникают солнечные ожоги и повышенная чувствительность к свету, что устраняется ношением солнцезащитных очков и использованием специальных кремов. Профилактика синдрома Ваарденбурга возможна только в рамках медико-генетического консультирования родителей перед зачатием ребенка и пренатальной диагностики.
Что такое синдром ваарденбурга
ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Минздрава России, Москва
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Диагностический центр №7» для взрослого и детского населения, ул. Моховая, 38, Санкт-Петербург, 191028, Российская Федерация
Офтальмологические проявления синдрома Ваарденбурга
Журнал: Вестник офтальмологии. 2019;135(6): 91-99
Астахов Ю. С., Тульцева С. Н., Лисочкина А. Б., Тахтаев Ю. В., Астахов С. Ю., Шахназарова А. А. Офтальмологические проявления синдрома Ваарденбурга. Вестник офтальмологии. 2019;135(6):91-99.
Astakhov Yu S, Tultseva S N, Lisochkina A B, Takhtaev Yu V, Astakhov S Yu, Shakhnazarova A A. Ophthalmologic manifestations of Waardenburg syndrome. Vestnik Oftalmologii. 2019;135(6):91-99.
https://doi.org/10.17116/oftalma201913506191
ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Минздрава России, Москва
Cиндром Ваарденбурга — это группа редких генетических заболеваний, основными признаками которых являются нейросенсорная тугоухость, нарушение пигментации пряди волос в лобной области, гетерохромия радужек, дистопия медиальной спайки век и наличие подобных изменений у родственников первой линии. В статье приведен клинический случай синдрома Ваарденбурга 1-го типа, развившегося в семье de novo. Уникальность случая заключается в сочетании полной двусторонней гипохромии радужек и нарушений пигментации хориоидеи. При этом собственно сосудистая оболочка имела не только зоны гипопигментации, но и обширные участки гипер- и депигментации. Подобные изменения хориоидеи при синдроме Ваарденбурга в литературе еще не описывались. Диагноз подтвержден результатами оптической когерентной томографии (ОКТ) переднего и заднего сегмента глаза, ОКТ-ангиографией, ангиографией глазного дна с флюоресцеином и индоцианином зеленым, оценкой аутофлюоресценции глазного дна и электрофизиологическими исследованиями. Основным офтальмологическим диагностическим критерием синдрома Ваарденбурга в данном случае, кроме гипохромии радужек, являлось выявление изменений толщины хориоидеи в зонах гипер- и гипопигментации при полной сохранности структурных и функциональных свойств сетчатой и сосудистой оболочек.
ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Минздрава России, Москва
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Российская Федерация
Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Диагностический центр №7» для взрослого и детского населения, ул. Моховая, 38, Санкт-Петербург, 191028, Российская Федерация
Впервые пациента со специфическим комплексом врожденных аномалий — нарушениями слуха и речи, изменениями в строении лицевого скелета и век, — а также с частичной атрофией радужных оболочек глаз описал голландский офтальмолог и генетик Петрус Йоханнес Ваарденбург (Petrus Johannes Waardenburg, 1886—1979). Он представил 72-летнего пациента для обсуждения на заседании голландского офтальмологического общества 14 декабря 1947 г. Это был единичный случай в клинической практике, и связь глухоты и нарушения пигментации радужки была воспринята как случайная.
Позже в клинике Франческетти в Женеве Ваарденбургом была осмотрена еще одна 10-летняя пациентка с гетерохромией радужек, снижением слуха и нарушением пигментации кожи, и тогда врач уже связал эти врожденные дефекты между собой.
После этого, целенаправленно осмотрев около тысячи детей и 150 взрослых, находившихся в учреждениях для слабослышащих в разных городах Нидерландов, он выявил 13 пациентов с латеральным смещением медиальной спайки век (телекант), аномально широкой переносицей, сращением бровей, гетерохромией радужек и различными нарушениями пигментации волос и кожи. Обследовав семьи пациентов, Ваарденбург расценил этот симптомокомплекс как генетическое заболевание, с разной выраженностью пенетрантности признаков. Среди обследованных пенетрантность дистопии медиальной спайки век и аномального строения спинки носа составила 99 и 78% соответственно. Пенетрантность сращения бровей, гетерохромии радужки, глухоты и альбинизма была значительно ниже. По мнению Ваарденбурга, заболевание имело аутосомно-доминантный тип наследования с распространенностью 1,43% среди всех глухих (что соответствует 1:212 000 населения в общей популяции). Однако, учитывая, что пенетрантность глухоты по сравнению с другими признаками была низкой и достигала лишь 20%, предполагаемая частота встречаемости нового синдрома составляет около 1:42 000 в популяции в целом. Эти данные были впервые опубликованы Ваарденбургом в 1951 г. в журнале American Journal of Human Genetics [1].
В дальнейшем выявленный синдром стали называть синдромом Ваарденбурга, подразделив его на четыре типа, при этом описанный автором симптомокомплекс получил название синдрома Ваарденбурга I (СВ 1). К выявляемым офтальмологическим проявлениям при СВ 1 относят изменение цвета радужки за счет ее дегенеративных изменений и реже встречающиеся нарушения пигментации хориоидеи.
Для диагностики дистопии медиальных спаек век Ваарденбург использовал результаты линейных измерений расстояний между медиальными углами глазной щели, латеральными углами и между центрами зрачков (в миллиметрах). Позже было введено понятие индекса Ваарденбурга (W), который рассчитывали более точно с помощью специальных формул:
где a — расстояние между медиальными углами глазной щели, b — межзрачковое расстояние и c — расстояние между латеральными углами глазной щели. В настоящее время можно рассчитать индекс Ваарденбурга в онлайн-режиме [2].
Значение индекса Ваарденбурга (W), превышающее 1,95, подтверждает у обследуемого дистопию медиальных спаек век и свидетельствует об СВ 1-го типа.
В 1971 г. S. Arias выделил подобный симптомокомплекс, но без дистопии медиальных спаек век, который назвал синдромом Ваарденбурга 2-го типа [3]. Позже признаки синдрома Ваарденбурга 1-го типа в сочетании со скелетно-мышечными нарушениями были названы синдромом Ваарденбурга 3-го типа (или синдромом Кляйна—Ваарденбурга) [4].
Затем K. Shah и соавт.(1981) описали сочетание признаков болезни Гиршпрунга и синдрома Ваарденбурга, получившее название синдрома Шаха—Ваарденбурга, или синдрома Ваарденбурга 4-го типа [5].
Согласно диагностическим критериям консорциума по синдрому Ваарденбурга, при диагностике этого синдрома используют деление на основные и дополнительные признаки. К основным относят нейросенсорную тугоухость, белую прядь волос надо лбом, аномалии пигментации радужки (полную или сегментарную гетерохромию, гипоплазию радужек), дистопию медиальных спаек век, наличие подобных изменений у родственника первой степени родства. Дополнительные признаки включают гипопигментацию кожи, сращение бровей, широкую переносицу, гипоплазию крыльев носа, раннее появление седины (у пациентов моложе 30 лет). Для установления диагноза достаточно наличия двух основных или одного основного и двух дополнительных признаков [6].
Пациенты с редкими заболеваниями часто проходят достаточно длительный и трудный путь перед окончательной установкой диагноза, в литературе его иногда называют «диагностической одисеей». Это связано с клинической и генетической гетерогенностью наследственного состояния, нетипичными проявлениями и отсутствием специфических клинико-генетических знаний у лечащих врачей. В таких случаях использование технологий секвенирования генов существенно облегчит диагностику.
Синдром Ваарденбурга является генетически гетерогенным заболеванием. Чаще всего отмечают аутосомно-доминантный тип наследования. При этом наблюдается значительная вариабельность клинических проявлений в пределах одной семьи, обусловленная различной экспрессией мутантного гена. Реже встречаются аутосомно-рецессивные разновидности наследования. СВ относят к так называемым наследственным гипомеланоцитозам, вызванным аномальным развитием, миграцией и пролиферацией меланобластов, а также аномальной жизнеспособностью и пролиферацией меланоцитов.
Для каждого из типов СВ определены характерные генетические дефекты, представленные в таблице. 
Выявление гетерозиготной мутации в гене РАХ3 чаще всего свидетельствует о синдроме Ваарденбурга 1-го — реже 3-го типа.
Мутации генов MITF, SNAI2 и SOX10 выявляются при синдроме Ваарденбурга 2-го типа. Однако во многих случаях при этом типе заболевания генетические дефекты выявить не удается.
У пациентов, имеющих синдром Ваарденбурга 3-го и 4-го типов, кроме описанных выше мутаций, могут с различной частотой выявляться мутации в генах EDN3, EDNRB, SOX10 [7—9].
В современных лабораториях при подозрении на синдром Ваарденбурга для уточнения диагноза в первую очередь следует провести прямое автоматическое секвенирование гена PAX3, входящего в состав пане-ли «Наследственная тугоухость», включающей еще 144 гена.
Спектр и выраженность клинических проявлений синдрома Ваарденбурга могут быть разными: от нарушений слуха, пигментации радужки, волос и кожи до аномалий строения скелета, деформаций черепа, грудной клетки, верхних конечностей и врожденных аномалий строения толстой кишки [10, 11]. Патогенетического лечения этого синдрома в настоящее время не существует, однако своевременное выявление заболевания на ранних этапах позволяет с помощью симптоматического лечения облегчить адаптацию, а в ряде случаев у пациентов с синдромом Ваарденбурга—Шаха, имеющих признаки болезни Гиршпрунга, — даже снизить летальность.
Среди работ, вошедших в базу данных MEDLINE, Кохрановскую библиотеку и eLIBRARY, нами было обнаружено 1038 работ, посвященных разным аспектам синдрома Ваарденбурга. Публикаций в офтальмологических изданиях крайне мало. В основном это описания клинических случаев из стран Азии (Индии, Филиппин, Турции, Сирии, Китая и т. д.). Представленные результаты офтальмологического обследования этих пациентов не стандартизированы, в связи с чем истинные структурные изменения радужки, сетчатки и хориоидеи по опубликованным данным полностью обобщить не представляется возможным.
Ваарденбург охарактеризовал офтальмологические изменения у своих пациентов как «heterochromia iridum totalis sive partialis», т. е. полное или частичное нарушение пигментации радужки, и указал на то, что собственно сосудистая оболочка, по-видимому, также может иметь изменения пигментации, но в незначительной степени. Поэтому описания пациентов с синдромом Ваарденбурга чаще всего ограничивались констатацией изменений век, переносицы и цвета радужки. Данные офтальмоскопии либо не приводились вообще, либо были минимальными [12—15]. Лишь в двух небольших ретроспективных исследованиях приведены результаты исследований радужки и хориоидеи пациентов с синдромом Ваарденбурга, включавших ОКТ переднего и заднего отрезка глаза, флюоресцентную ангиографию (ФАГ), исследование аутофлюоресценции и фоторегистрацию картины глазного дна с использованием широкоугольной линзы [16, 17].
Обобщая свои данные по 7 пациентам с гипопигментацией радужки, C. Shields и соавт. [16] в 9 глазах выявили секторные, а в 6 глазах диффузные нарушения пигментации хориоидеи. Авторами были выявлены участки гипопигментации, которые чаще всего локализовались на периферии, при этом поражения, как правило, были симметричными на обоих глазах. В зонах гипопигментации отмечались истончение сосудистой оболочки и умеренная гомогенная гипераутофлюоресценция. Результаты ОКТ участков гипопигментации радужек показали истончение ткани в сочетании с наличием более мелких, чем в неизмененной ткани, крипт. Интересно, что гипопигментация радужки имела слабую корреляцию с гипопигментацией хориоидеи. Во всех случаях сетчатка не имела каких-либо патологических изменений, что подтверждалось ФАГ.
Несмотря на то что при описании сосудистой оболочки глазного яблока у больных синдромом Ваарденбурга чаще всего используется термин «гипопигментация», встречаются отдельные описания и со случаями «гиперпигментации» хориоидеи [13] и единственное описание пациентки с «неравномерной пигментацией» хориоидеи, при котором наблюдается не истончение, а наоборот, ее утолщение [17]. Именно термин «неравномерная пигментация» хориоидеи может быть предложен в настоящее время для описания глазного дна пациентов с синдромом Ваарденбурга.
Важно заметить, что, по данным литературы, практически все пациенты с синдромом Ваарденбурга изначально имели другие диагнозы: глазной меланоз, хориоидальный невус, меланома хориоидеи или синдром Фогта—Коянаги—Харада.
В связи со сложностью постановки правильного диагноза данной, редко встречающейся генетической патологии уточнение алгоритма диагностики офтальмологических изменений при синдроме Ваарденбурга представляется актуальным. Описаний изменений органа зрения при синдроме Ваарденбурга в отечественной периодической литературе на сегодняшний день нет. В связи с этим обсуждение представленного ниже клинического случая данного заболевания представляет особый интерес.
Пациент К. 24 лет, коренной житель Узбекистана, обратился в клинику офтальмологии ПСПбГМУ им. И.П. Павлова с жалобами на плохое зрение обоих глаз и трудности при подборе очковой коррекции. При сборе анамнеза выяснено, что у пациента с детства низкое зрение и тугоухость, что затрудняло обучение и общение со сверстниками. Пациент общался с медицинским персоналом клиники через своего родного брата, речь которого он понимал по губам. Пациент родился в полной семье, является младшим, четвертым ребенком. В связи с удаленностью места проживания от диагностических центров ранее не обследовался и лечения не получал. Со слов брата пациента, все члены семьи здоровы, имеют хорошее зрение и слух. Отличительной чертой пациента являются голубые глаза, не характерные для памиро-ферганского типа европеоидной расы, к которой относится преобладающая часть жителей Узбекистана. У всех остальных членов семьи пациента глаза карие.
Кроме цвета глаз, при общем осмотре обратили на себя внимание особенности строения лица: уплощение спинки носа, широкое расстояние между медиальными углами глазных щелей, наличие небольшой седой пряди в области лба в столь раннем возрасте (рис. 1, а, б). Участков гипер- или гипопигментации кожи или слизистых оболочек у пациента не обнаружено. Жалобы со стороны других органов и систем отсутствовали.
Ниже приводятся данные объективного обследования.
Биомикроскопия переднего отрезка глазных яблок позволила выявить равномерную диффузную гипопигментацию радужных оболочек обоих глаз. Цвет радужных оболочек был ярко-голубым, количество крипт и лакун снижено, за счет чего рельеф радужных оболочек сглажен, особенно на левом глазу (диаметр зрачка на правом глазу 5,5 мм, а на левом — 4,6 мм). Определена явная анизокория (см. рис. 1, в) 

Охарактеризовать пигментацию глазного дна пациента нам удалось только после соответствующего осмотра его родного брата, у которого наблюдалась равномерно усиленная пигментация глазного дна, что характерно для коренных жителей Центральной Азии (рис. 3). 
С диагностической целью пациенту было выполнено расширенное офтальмологическое обследование, которое включало компьютерную статическую периметрию, тонометрию, гониоскопию, кератотопографию (рис. 4), 

У пациента диагностирован смешанный астигматизм со степенью 6 дптр на правом глазу и сложный миопический астигматизм со степенью 1,25 дптр на левом глазу. При этом толщина роговиц в центральной зоне составляла 537 и 529 мкм соответственно. ПЗО правого глаза — 22,84 мм, левого — 23,48 мм. Пациент никогда не пользовался очковой или какой-либо другой коррекцией зрения, в связи с чем считал себя «слабовидящим». При этом максимально-корригированная острота зрения достигала 0,6—0,7 на обоих глазах.
Vis OD 0,13 Sph +2,27 Cyl –6,0 ax 176°=0,6,
Vis OS 0,13 Sph –2,5 Cyl –1,25 ax 65°=0,7.
Результаты компьютерной периметрии, гониоскопии, ультразвукового В-сканирования, МРТ в пределах нормы.
Структурные изменения были выявлены только с помощью кератотопографии, ОКТ переднего и заднего отрезков глазных яблок и исследования аутофлюоресценции глазного дна.
По результатам ОКТ переднего сегмента — истончения радужных оболочек обоих глаз не обнаружено (в прикорневой зоне 0,367 мкм на правом и 0,389 мкм на левом глазу), однако отмечено некоторое уменьшение количества крипт (см. рис. 1). Результаты ОКТ и ОКТ-ангиографии показали отсутствие патологических изменений в структуре сетчатки, но толщина хориоидеи при этом была неравномерной. Максимальная толщина сосудистой оболочки в гиперпигментированных участках достигала 672 мкм на правом и 574 мкм на левом глазу. В зонах гипопигментации эти значения колебались в пределах 223—280 мкм, а в зоне депигментации составили около 171 мкм. Исследование аутофлюоресценции глазного дна выявило гипоаутофлюоресценцию в зоне депигментации (см. рис. 5, в).
По заключению сурдолога, у пациента отмече-но двустороннее сенсоневральное поражение с глухотой на левое ухо и значительной тугоухостью справа.
Учитывая выявленные изменения, сложилось впечатление о наличии у пациента синдрома Ваарденбурга. Для уточнения типа заболевания был определен индекс Ваарденбурга, который равнялся 1,96. Согласно консорциуму по СВ, показатели индекса, превышающие 1,95, свидетельствуют о наличии телеканта и относят заболевание к 1-му типу.
Таким образом, обследование пациента позволило нам выявить 4 основных признака (нейросенсорная тугоухость, седая прядь надо лбом, аномалия пигментации радужки, дистопия медиальной спайки век) и два дополнительных признака (широкая переносица и нарушение пигментации хориоидеи), что, согласно рекомендациям консорциума по СВ, позволяет поставить в данном случае диагноз синдрома Ваарденбурга 1-го типа. Максимально полное обследование при СВ предполагает выполнение генетического исследования. Однако наш пациент от него предпочел воздержаться. Исходя из данных семейного анамнеза (отсутствие среди родственников первой линии случаев с тугоухостью и гетерохромией радужек), мы столкнулись с редким случаем развития болезни de novo.
Учитывая отсутствие структурных и функциональных изменений со стороны органа зрения, связанных с СВ, пациенту была предложена коррекция астигматизма с помощью склеральных контактных линз, позволившая повысить остроту зрения обоих глаз до 0,8.
Пациенты с синдромом Ваарденбурга, как правило, не жалуются на снижение зрения, и заболевание чаще всего выявляют во время профилактических осмотров или при офтальмологическом осмотре, рекомендованном сурдологом.
Одним из наиболее постоянных признаков СВ является изменение пигментации радужной оболочки одного или обоих глаз. Однако следует помнить, что данное проявление может быть признаком и других состояний, например при альбинизме и витилиго. Гиперпигментация радужки может наблюдаться при наличии меланомы, невуса, врожденного глазного меланоцитоза, гетерохромного иридоциклита Фукса, синдроме Горнера и местном лечении препаратами, являющимися аналогами простагландинов. «Маскироваться» под хориоидальные признаки СВ могут меланома хориоидеи, врожденный глазной меланоцитоз, витилиго, синдром Фогта—Коянаги—Харада.
Наиболее часто СВ «имитирует» врожденный глазной меланоцитоз. Он также является врожденным состоянием, вызывает двустороннее поражение глаз, может иметь локальную, секторную или диффузную форму. Однако при этом чаще всего происходит отложение пигмента в эписклере, на коже и слизистых (небная пигментация). В отличие от СВ, врожденный меланоцитоз глаз сопровождается скоплением пигмента, а при СВ чаще отмечается секторная или диффузная гипопигментация или депигментация радужки и хориоидеи.
В любом случае пациент с гиперплазией пигментного эпителия (в том числе и с подозрением на СВ) должен быть полностью обследован для исключения новообразований органа зрения, в первую очередь следует провести ультразвуковое В-сканирование и ФАГ. В диагностически сложных случаях следует рекомендовать пациенту консультацию офтальмоонколога.
Благодарности
Авторы выражают признательность за оказанную помощь при обследовании пациента: ассистенту кафедры офтальмологии ПСПбГМУ им. акад. И.П. Павлова, к.м.н. П.А. Нечипоренко, врачу-офтальмологу клиники офтальмологии ПСПбГМУ им. акад. И.П. Павлова А.Г. Руховцу, врачу-офтальмологу ТДЦ № 1, к.м.н. Н.Н. Григорьевой.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.