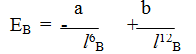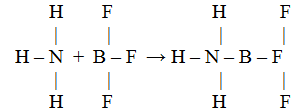что такое силы ван дер ваальса
Силы Ван-дер-Ваальса
Ван-дер-ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкость и твёрдые тела).
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Содержание
Классификация ван-дер-ваальсовых сил
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
До сих пор многие авторы исходят из предположения, что ван-дер-ваальсовые силы определяют межслоевое взаимодействие в слоистых кристаллах, что противоречит экспериментальным данным: масштабу анизотропии температуры Дебая и, соответственно, масштабу анизотропии решёточного отражения. Исходя из данного ошибочного [4] предположения построены многие двумерные модели, «описывающие» свойства, в частности графита и нитрида бора.
Проявления в природе
См. также
Примечания
Литература
 |
 Химическая связь Химическая связь | |||||||
|---|---|---|---|---|---|---|---|
| Внутримолекулярное взаимодействие |
| ||||||
| Межмолекулярное взаимодействие |
| ||||||
Полезное
Смотреть что такое «Силы Ван-дер-Ваальса» в других словарях:
силы Ван-дер-Ваальса — van der Valso jėgos statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrinės kilmės molekulių sąveikos jėgos. atitikmenys: angl. van der Waals forces vok. Van der Waalssche Kräfte, f rus. ван дер ваальсовые силы, f; силы Ван дер… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
силы Ван-дер-Ваальса — van der Valso jėgos statusas T sritis chemija apibrėžtis Elektrinės kilmės molekulių sąveikos jėgos. atitikmenys: angl. van der Waals forces rus. Ван дер Ваальсовые силы; силы Ван дер Ваальса … Chemijos terminų aiškinamasis žodynas
ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ — ВАН ДЕР ВААЛЬСА УРАВНЕНИЕ, уравнение состояния (см. УРАВНЕНИЕ СОСТОЯНИЯ), описывающее свойства реального газа (см. РЕАЛЬНЫЙ ГАЗ). Предложено Й. Д. Ван дер Ваальсом (см. ВАН ДЕР ВААЛЬС Йоханнес Дидерик) в 1873 г. Широко используется для… … Энциклопедический словарь
ВАН-ДЕР-ВААЛЬСА ЗАНОН — (Van der Wa als), уравнение состояния реальных газов (см. Аггрегатное состояние), не подчиняющихся закону Бойля и Гей Люссака (pv= = КТ), справедливого для газов идеальных. Если обозначить объем газа через v, давление через р, абсолютную темп,… … Большая медицинская энциклопедия
Ван дер Ваальса формула — В. формула, одинаково прилагаемая и к газообразному и к жидкому состоянию какого либо вещества, выражает зависимость между объемом, температурой и давлением, под которым находится рассматриваемое вещество, при посредстве лишь двух постоянных для… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ван-дер-Ваальса силы — силы межмолекулярного взаимодействия, возникающие из за аппроксимации молекул дипольными моментами, и далее соответствующие взаимодействию между ними, такими, что на малых расстояниях они оказываются отталкивающими, а на больших расстояниях… … Начала современного естествознания
Уравнение Ван-дер-Ваальса — Уравнение состояния Стат … Википедия
Ван-дер-Ваальс — Ван дер Ваальс, Ян Дидерик Ян Дидерик Ван дер Ваальс Johannes Diderik van der Waals Дата рождения … Википедия
Ван-дер-Ваальс, Ян Дидерик — Ян Дидерик Ван дер Ваальс нидерл. Johannes Diderik van der Waals … Википедия
Ван-Дер-Ваальс — Ян Дидерик Ван дер Ваальс Johannes Diderik van der Waals выдающийся учёный физик, лауреат Нобелевской премии по физике Дата рождения: 23 ноябр … Википедия
Взаимодействия между молекулами. Вандерваальсовы силы
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Взаимодействия между молекулами.
При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
4.8.1. Вандерваальсовы силы. В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционое и дисперсионное взаимодействия.
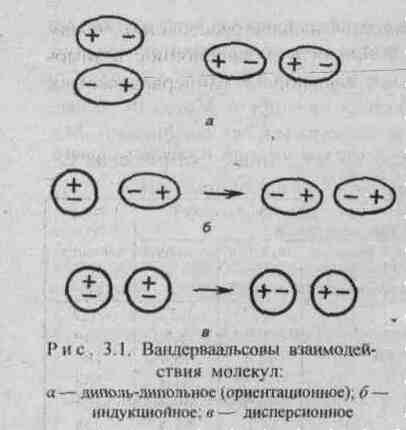
Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.3.1). Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
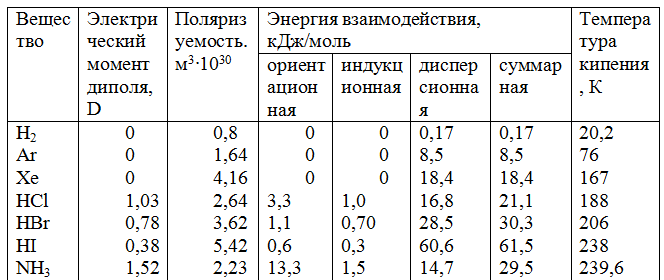
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рис.3.1). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул (табл. 14). Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия (табл. 14).
Дисперсионное притяжение. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рис.3.1). Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил (табл. 14).
Таблица 14. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
Энергия вандерваальсова взаимодействия. Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между центрами молекул в шестой степени.
При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорциональны расстоянию: между молекулами-в двенадцатой ступени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия Ев от расстояния между молекулами, Iв, выражается уравнением
где: а и b — постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4÷0,5 нм, т.е. существенно больше длины химической связи/
Как видно из табл. 14, с увеличением размера молекул в ряду Аr—Хе и НС1—HI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолекулярного взаимодействия возрастает температура кипения жидкостей, а также теплота их испарения.
Суммарная энергия вандерваальсового взаимодействия молекул на 1—2 порядка ниже энергии химических связей.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия, включающие дисперсионные силы, а для полярных молекул и диполь-дипольное притяжение и индукционные взаимодействия.
4.8.2. Донорно-акцепторное взаимодействие молекул. Комплексные соединения. Если одна из двух молекул имеет атом со свободными орбиталями, а другая – атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора – вакантная орбиталь.
При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора – вакантную орбиталь, в результате чего возникает ковалентная связь
В полученном соединении суммарные валентности бора и азота равны четырем.
Комплексы. Аналогичным образом образуется соединение КРF6 при взаимодействии KF и PF5, которое можно записать в виде К[РF6].
При взаимодействии сульфата меди и аммиака образуется сложное соединение
которое выражается формулой [Сu(NН3)4]SO4. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений.
Межмолекулярное взаимодействие
Глава 13. Cилы ван-дер-Ваальса
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей. Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение.
Для взаимодействия двух диполей энергия притяжения между ними (энергия Кеезома) выражается соотношением:
Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.
Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением:
Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
Энергия такого взаимодействия (энергия Лондона) дается соотношением:
Межмолекулярное отталкивание
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться. Энергия отталкивания дается выражением
Общее уравнение межмолекулярного взаимодействия при постоянной температуре (уравнение Леннарда-Джонсона) в большинстве случаев имеет вид
Ван-дер-Ваальсовы силы
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул. Существует три типа ван-дер-ваальсовых сил:
До сих пор многие авторы исходят из предположения, что ван-дер-ваальсовые силы определяют межслоевое взаимодействие в слоистых кристаллах, что противоречит экспериментальным данным: масштабу анизотропии температуры Дебая и, соответственно, масштабу анизотропии решёточного отражения. Исходя из данного ошибочного предположения построены многие двумерные модели, «описывающие» свойства, в частности графита и нитрида бора. Ошибочность таких представлений показана в работе: S.V. Ordin, [B.N. Sharupin and M. I. Fedorov], J. Semiconductors (FTP), 32(9), 924—932, 1998, Normal lattice vibrations and the crystal structure of anisotropic modifications of boron nitride.
См. также
Полезное
Смотреть что такое «Ван-дер-Ваальсовы силы» в других словарях:
Ван-дер-Ваальсовы силы — силы межмолекулярного взаимодействия. * * * ВАН ДЕР ВААЛЬСОВЫ СИЛЫ ВАН ДЕР ВААЛЬСОВЫ СИЛЫ, силы межмолекулярного взаимодействия (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ) … Энциклопедический словарь
ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ — силы межмолекулярного взаимодействия … Большой Энциклопедический словарь
ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ — распространённое назв. сил межмолекулярного взаимодействия. ВАР (вольт ампер реактивный, ВАр), единица СИ реактивной мощности переменного (синусоидального) электрич. тока. 1 ВАр равен реактивной мощности при действующих значениях электрич.… … Физическая энциклопедия
ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ — силы межмолекулярного взаимодействия … Естествознание. Энциклопедический словарь
ван-дер-ваальсовы силы — междумолекулярные силы … Cловарь химических синонимов I
Ван-дер-Ваальсовы силы — распространённое название сил межмолекулярного взаимодействия (См. Межмолекулярное взаимодействие) … Большая советская энциклопедия
ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ — распространённое назв. сил взаимного притяжения между электрически нейтральными атомами и молекулами; имеют электрич. природу. В. д. В. с. определяют существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и… … Большой энциклопедический политехнический словарь
Ван-дер-Ваальсовы взаимодействия — Ван дер ваальсовы силы силы межмолекулярного взаимодействия с энергией 0,8 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании… … Википедия
Силы Ван-дер-Ваальса — Ван дер ваальсовы силы силы межмолекулярного (и межатомного) взаимодействия с энергией 10 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычн … Википедия
Силы Ван-дер-Ваальса
Оглавление
Иллюстративный эффект сил Ван-дер-Ваальса
В дополнение к главным образом электростатическим силам гекконы также используют силы Ван-дер-Ваальса для прилипания к поверхностям без клея или присосок. Нижняя сторона ее ступней покрыта тончайшими волосками. Каждый волос может передавать только небольшое количество силы, но из-за большого количества, сумма сил достаточна, чтобы животное могло ходить вверх ногами по потолку. Это также возможно на гладких поверхностях, таких как стекло. Сумма контактных сил геккона составляет около 40 Н.
первопричина
Если две неполярные молекулы приближаются друг к другу достаточно долго (то есть с низкой относительной скоростью), то они вступают в электростатическое взаимодействие друг с другом.
Между первоначальным временным диполем и индуцированным диполем возникают силы Ван-дер-Ваальса. Отныне диполи влияют друг на друга, их электронные сдвиги синхронизированы.
Если два атома или молекулы подходят достаточно близко, может возникнуть одна из следующих ситуаций.
Энергия связи Ван-дер-Ваальса : 0,5–5 кДж / моль (соответствует 5–50 мэВ / молекула).
Квантово-механическое рассмотрение
Соответственно, распределение заряда было бы неизменным, и самопроизвольное появление временных диполей было бы невозможным. Так как он обычно осесимметричен относительно ядра атома, дипольный момент, например, атома благородного газа всегда будет равен нулю. | ψ ( р → ) | 2 <\ displaystyle | \ psi (<\ vec
При более внимательном рассмотрении квантовомеханического оператора плотности заряда
однако это не собственное значение оператора плотности заряда. Плотность заряда имеет некоторую размытость, что приводит к тому, что с определенной вероятностью центр тяжести распределения электронного заряда находится не в ядре атома и, таким образом, возникает дипольный момент. Таким образом, силы Ван-дер-Ваальса можно понять в картине квантовой механики.
Достопримечательность Ван-дер-Ваальса
Поскольку упомянутые дипольные моменты малы, результирующее электрическое притяжение является слабым и имеет очень малый радиус действия. Чтобы притяжение Ван-дер-Ваальса вообще произошло, два атома или молекулы должны сблизиться. Это приближение тем «сложнее» (статистически менее вероятно), чем больше кинетической энергии обладают молекулы, то есть чем выше температура. При повышении температуры тепловое движение перевешивает силы Ван-дер-Ваальса. Это часто представляет собой переход из жидкого состояния в газообразное.
Потенциал Ван-дер-Ваальса между макроскопическими телами
Для макроскопических тел ( например, коллоидов ), которые, как известно, намного больше, чем отдельные атомы или небольшие молекулы, потенциал для описания ван-дер-ваальсова взаимодействия имеет разные формы и зависит от геометрии исследуемой проблемы. В теории Гамакера все микроскопические потенциалы Ван-дер-Ваальса складываются с использованием предположения, что результирующий потенциал складывается аддитивно (что в действительности не так, поскольку индуцированные диполи влияют друг на друга). Чтобы избежать проблемы неаддитивности, потенциал можно также вычислить с помощью теории Лифшица (континуальной теории, названной в честь Евгения Михайловича Лифшица ).
Из постоянной Гамакера следует, что взаимодействие Ван-дер-Ваальса минимизируется, если показатели преломления жидкости и частиц сделать более похожими.