что такое сенсибилизации т клеточный
Клиническое значение выявления органоспецифической сенсибилизации у пациентов с продолжительным течением хронического посттравматического увеита
Полный текст:
Аннотация
Цель — оценка клинической информативности выявления органоспецифической сенсибилизации при хроническом посттравматическом увеите (ХПТУ) на основании сопоставительного анализа данных скринингового теста — реакции торможения миграции лейкоцитов (РТМЛ) и гистологического исследования.
Материал и методы. Обследовано 54 пациента в возрасте 17–82 лет с ХПТУ, которым было выполнено удаление глазного яблока методом энуклеации/эвисцерации. Для выявления органоспецифической сенсибилизации использовали скрининговый тест — РТМЛ в цельной крови с экстрактами антигенов роговицы, хрусталика и увеаретинальной ткани. Удаленные глаза подвергали гистологическому исследованию.
Результаты. Положительный ответ в РТМЛ был выявлен у 35,2 % больных (19 глаз). Патоморфологические признаки иммунного воспаления обнаружены в 55,5 % случаев (30 глаз). В 23 (42,6 %) глазах морфологическая картина характеризовалась атрофическими, фиброзными и дистрофическими изменениями тканей. На основании данных сопоставительного анализа результатов РТМЛ и гистологического исследования показано, что в 16 (53,3 %) случаях из 30 морфологически подтвержденное иммунное воспаление сопровождалось сенсибилизацией к антигенам оболочек глаза.
Заключение. В половине случаев продуктивное воспаление при ХПТУ, выявленное при гистологическом исследовании, ассоциировалось с развитием специфической сенсибилизации к антигенам тканей глаза. Этот результат представляется важным и должен приниматься во внимание при определении тактики ведения пациента (проведение целенаправленной диагностики и назначения иммунотропной терапии). Отсутствие ответа в скрининговом тесте РТМЛ у пациентов с ХПТУ и интраокулярным воспалением, подтвержденным патоморфологическими признаками, позволяет предположить участие дополнительных механизмов воспалительного процесса, что требует дальнейших исследований.
Ключевые слова
Об авторах
Наталья Владимировна Балацкая — кандидат биологических наук, руководитель отдела иммунологии и вирусологии.
Ул. Садовая-Черногрязская, д. 14/19, Москва, 105062
Ирина Анатольевна Филатова — доктор медицинских наук, руководитель отдела пластической хирургии и глазного протезирования.
Ул. Садовая-Черногрязская, д. 14/19, Москва, 105062
Галина Петровна Захарова — кандидат медицинских наук, заведующая клиникой, врач-патологоанатом отдела патологической анатомии и гистологии.
Ул. Садовая-Черногрязская, д. 14/19, Москва, 105062
Ирина Геннадьевна Куликова — cтарший научный сотрудник отдела иммунологии и вирусологии.
Ул. Садовая-Черногрязская, д. 14/19, Москва, 105062
Мохаммад Ихаб Мохаммад Джамиль — кандидат медицинских наук, младший научный сотрудник отдела пластической хирургии и глазного протезирования.
Ул. Садовая-Черногрязская, д. 14/19, Москва, 105062
Список литературы
1. Архипова Л.Т. Симпатическая офтальмия. Москва: Триада; 2006: 84–122.
2. Филатова И.А., Вериго Е.Н., Мохаммад И.М., Денисюк В.О. Глазопротезирование в реабилитации пациентов с исходом тяжелой травмы и субатрофией глазного яблока. Российская педиатрическая офтальмология. 2018; 13 (3): 129–34. doi: 10.18821/1993-1859-2018-13-3-129-134
3. Гундорова Р.А., Фридман Ф.Е., Вериго Е.Н., Беглярбекян В.Н. Патогенез, клиника, диагностика и лечение посттравматической субатрофии глаза. Показания к энуклеации при последствиях тяжелых травм органа зрения. Методические рекомендации. Москва; 1984.
4. Дикинов З.Х., Абидов М.Т. Динамика показателей клеточного иммунитета при посттравматическом увеите. Иммунопатология, аллергология, 0000инфектология. 2013; 4: 62–6.
5. Марачева Я.М. Иммунопатологические варианты течения посттравматического увеита при проникающем ранении глазного яблока. Вестник Уральской медицинской академической науки. 2012; 2 (39): 42–4.
6. Boitard C. Pathophysiology of autoimmune diseases. Klin. Wogchenschrift. 1990; 68 (suppl. 21): 1–9.
7. Архипова Л.Т., Слепова О.С., Юровская Н.Н., Быковская Г.Н. Характеристика иммунных нарушений у больных с симпатической офтальмией. Медицинская иммунология. 2002; 4 (2): 189–90.
8. Sisk R.A., Davis J.L., Dubovy S.R., Smiddy W.E. Sympathetic ophthalmia following vitrectomy for endophthalmitis after intravitreal bevacizumab. Ocul. Immunol. Inflamm. 2008 Sep-Oct; 16 (5): 236–8. doi: 10.1080/09273940802409951
9. Im J.C., Kang Y.K., Park T.I., Shin J.P., Kim H.K. Sympathetic ophthalmia after ocular wasp sting. Korean J. Ophthalmol. 2015 Dec; 29 (6): 435–6. doi: 10.3341/kjo.2015.29.6.435
10. Куликова И.Г., Слепова О.С., Илуридзе С.Л. Модификация тестов, направленных на выявление аутоиммунных реакций при заболеваниях глаз. Российский офтальмологический журнал. 2013; 6 (1): 69–72.
11. Суслов А.П., Головин В.П., Скворцов В.Т., Коронцвит Т.А. Скрининговый тест клеточной миграции (СТКМ) из микрокультур in vitro. Иммунология. 1989; 2: 73–6.
12. Хорошилова-Маслова И.П., Набиева М.М., Лепарская Н.Л. Морфогенез осложнений после длительного пребывания силиконового масла в полости глаза (клинико-гистопатологическое исследование). Вестник офтальмологии. 2012; 4: 57–61.
13. Fuente M.A., Alejandre N., Ferrer P., et al. Sympathetic ophthalmia in HIV infection. A clinicopathological case report. J. Ophthalmic. Inflamm. Infect. 2012 Sep; 2 (3): 161–4. doi: 10.1007/s12348-012-0065-y
14. Вусker M.D., Adamus G., Rosenbaum J.T. The role of T-cells in autoimmune uveitis. Ocul. Immunol. and inflam. 2000; 8 (2) 5: 93–100.
15. Chan C.C., Mochizuki M., Nussenblatt R.B., et al. T-lymphocyte subsets in experimental autoimmune uveitis. Clin. Immunol. Immunopathol. 1985; 35 (1): 103–10.
16. Chi-Chao Chan, Qian Li. Immunopathology of uveitis. Br. J. Ophthal. 1998; 91–6.
17. Davidson A., Diamond B. Autoimmune disease. Engl. J. Мed. 2001: 340–50.
18. Куликова И.Г., Балацкая Н.В., Ковалева Л.А., Макаров П.В. Частота сдвигов от нормы в субпопуляционном составе крови у пациентов с центральной язвой роговицы. Медицинская иммунология. 2018; 20 (2): 263–70. https://doi.org/10.15789/1563-0625-2018-2-263-270
19. Зурочка А.В., Марачева Н.М., Зурочка В.А., Панова И.Е., Хайдуков С.В. Оценка уровня аутореактивных субпопуляций В-лимфоцитов и регуляторных Т-клеток у пациентов с острым посттравматическим увеитом при проникающем ранении глазного яблока в динамике воспалительного процесса. Российский иммунологический журнал. 2012; 6 (15); 3: 296–303.
Для цитирования:
Балацкая Н.В., Филатова И.А., Захарова Г.П., Куликова И.Г., Денисюк В.О., Мохаммад И.М. Клиническое значение выявления органоспецифической сенсибилизации у пациентов с продолжительным течением хронического посттравматического увеита. Российский офтальмологический журнал. 2021;14(1):15-20. https://doi.org/10.21516/2072-0076-2021-14-1-15-20
For citation:
Balatskaya N.V., Filatova I.A., Zakharova G.P., Kulikova I.G., Denisyuk V.O., Mohammad I.M. Clinical significance of detecting organ-specificsensitization in patients with long-term chronic posttraumatic uveitis. Russian Ophthalmological Journal. 2021;14(1):15-20. (In Russ.) https://doi.org/10.21516/2072-0076-2021-14-1-15-20
Что такое сенсибилизации т клеточный
Гиперчувствительность клеточного типа лежит в основе развития ряда инфекционных заболеваний (туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, герпеса, кори, грибковой инфекции), трансплантационного иммунитета, противоопухолевого иммунитета, аутоиммунных заболеваний, контактного дерматита.
Взаимодействие антигенов-аллергенов с антигенпрезентирующими клетками обеспечивается при участии Tool-рецепторов (TLR4, TLR5, TLR6, TLR62), экспрессируемых на их мембранах.
В механизмах индукции гиперчувствительности IV типа важная роль отводится антигенпрезентирующим макрофагам, дендритным и другим клеткам, обеспечивающим фагоцитирование и комплексирование негидролизованной части антигена-аллергена с белками II класса молекул МНС, а также презентацию антигена комплементарному клону Тh0. Одновременно антигенпрезентирующие клетки продуцируют цитокины (IL-12, IL-23, IL-27), обеспечивающие пролиферацию и дифференцировку антигенчувствительных клонов Th1.
Полагают, что главным цитокином в реакциях IV типа является гамма-интерферон, продуцируемый Тh1, который вызывает активацию макрофагов, вовлечение их в иммунный ответ за счет их фагоцитарной активности и уничтожения клеток-мишеней в процессе фагоцитоза, а также за счет усиления продукции монокинов с полимодальной направленностью действия.
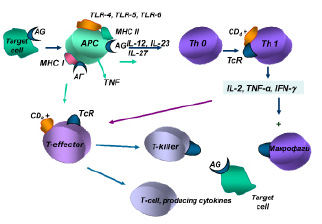
Интерлейкин-2, продуцируемый Тh1, обеспечивает аутокринную активацию этих клеток лимфоцитов и паракринную неспецифическую пролиферацию Т-эффекторов. Антигенстимулированные Т-лимфоциты-хелперы и Т-лимфоциты-эффекторы обеспечивают продукцию медиаторов аллергии клеточного или замедленного типа, получивших название лимфокинов (рисунок).
Индукция иммунного ответа при клеточно-опосредованных реакциях
В настоящее время выделено несколько десятков лимфокинов, которые в соответствии с особенностями их биологического действия могут быть разделены на следующие группы:
1. Факторы, влияющие на лимфоциты (фактор переноса Лоуренса, митогенный фактор, фактор, стимулирующий Т- и В-лимфоциты).
2. Факторы, влияющие на макрофаги (миграцию ингибирующий фактор; фактор, активирующий макрофаги; фактор, усиливающий пролиферацию макрофагов).
3. Цитотоксические факторы (лимфотоксин; фактор, тормозящий синтез ДНК; фактор, ингибирующий гемопоэтические стволовые клетки).
4. Факторы хемотаксиса макрофагов, нейтрофилов, лимфоцитов и эозинофилов.
5. Антивирусные и антимикробные факторы.
Многие лимфокины обладают дистантным биологическим эффектом.
Цитотоксические CD8-Т-лимфоциты оказывают прямое действие. CD8-Т-лимфоциты обеспечивают развитие цитолиза клетки-мишени, на мембране которой фиксирован антиген, в три стадии:
I стадия – двойного распознавания антигена в комплексе с белками МНС I класса, экспрессированными на клетке-мишени.
II стадия – летального удара возникает в процессе контакта Т-лимфоцита-эффектора с клеткой-мишенью при участии белка перфорина, лимфотоксина или индуктора апоптоза, получаемых клеткой мишенью при межклеточном контакте.
III стадия – стадия коллоидно-осмотического лизиса, возникающего вслед за перфорацией мембраны и пассивной диффузией ионов, а затем и высокомолекулярных соединений по осмотическому градиенту через поврежденную мембрану.
Описание отдельных форм аллергических реакций
Контактные дерматиты. Аллергия этого типа чаще возникает к низкомолекулярным веществам органического и неорганического происхождения: различным химическим веществам, краскам, лакам, косметическим препаратам, антибиотикам, пестицидам, соединениям мышьяка, кобальта, платины, воздействующим на кожу. Контактные дерматиты могут вызывать также вещества растительного происхождения – семена хлопка, цитрусовые. Аллергены, проникая в кожу, образуют стабильные ковалентные связи с SH- и NН2-группами протеинов кожи. Эти конъюгаты обладают сенсибилизирующими свойствами.
Сенсибилизация обычно возникает в результате длительного контакта с аллергеном. При контактных дерматитах патологические изменения наблюдаются в поверхностных слоях кожи. Отмечаются инфильтрация воспалительными клеточными элементами, дегенерация и отслойка эпидермиса, нарушение целостности базальной мембраны.
Морфологические изменения при контактных дерматитах обусловлены фазным характером инфильтрации. Через 2-3 часа после инъекции антигена-аллергена возникает инфильтрация тканей сегментоядерными нейтрофилами. Через 5-6 часов в периваскулярной области появляются моноциты. Через 8 часов инфильтрация моноцитами становится интенсивной. К 24–72 часам она уменьшается. Клеточные элементы, содержащиеся в очаге воспаления, представлены в основном лимфоцитами и макрофагами.
Инфекционная аллергия. ГЗТ развивается при хронических бактериальных, вызванных грибами и вирусами инфекциях (туберкулезе, бруцеллезе, туляремии, сифилисе, бронхиальной астме, стрептококковой, стафилококковой и пневмококковой инфекциях, аспергиллезе, бластомикозе), а также при заболеваниях, вызываемых простейшими (токсоплазмоз), при глистных инвазиях.
Сенсибилизация к микробным антигенам обычно развивается при воспалении. Не исключена возможность сенсибилизации организма некоторыми представителями нормальной микрофлоры (нейссерии, кишечная палочка) или патогенными микробами при их носительстве.
Сенсибилизация к микробным антигенам в определенных условиях благоприятствует ликвидации патологического процесса. Одним из механизмов повышения устойчивости при ГЗТ может служить повышение неспецифической резистентности (усиление метаболической активности и фагоцитарной способности макрофагов, повышение активности лизоцима).
Отторжение трансплантата. При трансплантации организм реципиента распознает чужеродные трансплантационные антигены (антигены гистосовместимости) и осуществляет иммунные реакции, ведущие к отторжению трансплантата. Антигены главного комплекса гистосовместимости I класса локусов А, В и С есть на всех ядросодержащих клетках, а локуса G – лишь на трофобласте. Эти антигены распознаются CD8-лимфоцитами.
Антигены ГКГС II класса локусов DR, DP, DQ экспрессированы на лимфоидных, макрофагальных и эндотелиальных клетках. Они распознаются CD4-лимфоцитами.
Кроме того, на эритроцитах имеются антигены системы АВО и Rh, в почках – системы АВО. Названные антигены тоже играют определенную роль в индукции отторжения трансплантата.
Виды трансплантатов. Различают сингенные, аллогенные и ксеногенные трансплантаты.
Аллогенные и ксеногенные трансплантаты без применения иммуносупрессивной терапии отторгаются. Несмотря на появление новых, более селективных в отношении трансплантационного иммунитета иммуносупрессоров – грибковых макролидных антибиотиков (циклоспорины, FK506, рапамицин) проблема иммунологического конфликта трансплантата и реципиента еще не решена.
Механизмы отторжения трансплантата. При отторжении трансплантата наблюдается как гуморальный, так и клеточный иммунный ответ, в частности, механизмы ГЗТ, цитотоксические и иммунокомплексные реакции.
В зависимости от сроков отторжение трансплантата может быть сверхострым, острым и хроническим. Сверхострое отторжение возможно при наличии предсуществующих антител, то есть при повторной пересадке тканей от одного и того же донора, и происходит в течение первых 5 дней, а иногда в первые минуты и часы.
При остром отторжении предсуществующих антител нет. Острое отторжение – это классический вариант отторжения, в основе которого лежат как гуморальные, так и клеточные механизмы. Такой вариант отторжения наблюдается при отсутствии или прекращении иммуносупрессирующей терапии. Начало острого отторжения может быть отложено на несколько недель или даже месяцы, но начавшись, процесс заканчивается за несколько дней.
Отторжение считается хроническим, если в случае погрешностей в проведении иммуносупрессирующей терапии наблюдаются повторные эпизоды начинающегося отторжения трансплантата. В основе такого отторжения также лежат реакции гуморального и клеточного иммунитета. Острое и хроническое отторжение отличаются исходом – степенью облитерации сосудов.
Наиболее активны, как стимуляторы отторжения, ФНО и γ-ИФН, которые не только угнетают жизнедеятельность клеток трансплантата и активируют эффекторы цитотоксичности, но и усиливают экспрессию трансплантационных антигенов на клетках, вовлекая цитотоксические эффекторы. При отторжении активны цитотоксические CD4-положительные лимфоциты, их роль даже более значительна, чем CD8-киллеров.
При аллотрансплантации кожи, костного мозга, почки образуются гемагглютинины, гемолизины, лейкотоксины и антитела к лейкоцитам и тромбоцитам. При реакции антиген-антитело образуются биологически активные вещества, повышающие проницаемость сосудов, что облегчает миграцию Т-киллеров в пересаженную ткань. Лизис эндотелиальных клеток в сосудах трансплантата приводит к активации процессов свертывания крови. Кроме того, происходит активация различных фракций комплемента:
• хемотаксические фракции – привлекают полиморфноядерные лейкоциты, которые разрушают трансплантат с помощью лизосомальных ферментов;
• С6 компонент комплемента – активирует свертывающую систему крови;
• С3b фракция – вызывает агрегацию тромбоцитов.
Активация гуморального ответа в виде иммунокомплексных реакций приводит к возникновению васкулита, тромбоза и ишемического некроза.
γ-ИФН привлекает макрофаги, которые также выделяют цитотоксические факторы.
При отторжении по первичному типу участвуют в основном мононуклеары и лишь немного полиморфноядерных гранулоцитов, при отторжении по вторичному типу в качестве эффекторов выступают и мононуклеары, и полиморфноядерные гранулоциты.
Аутоиммунные заболевания. Развитие аутоиммунных заболеваний обусловлено сложным взаимодействием аллергических реакций клеточного и гуморального типа с преобладанием той или иной реакции в зависимости от характера аутоиммунного заболевания.
Аутоиммунные болезни представляют собой гетерогенную группу заболеваний, развитие которых связано или с доминирующей ролью цитолитических антител в механизмах деструкции клеток, или сочетанное патогенное воздействие на клетки-мишени CD8+-Т-лимфоцитов-киллеров, продуцентов лимфокинов с цитолитическими органоспецифическими или неспецифическими антителами.
Преимущественный цитотоксический эффект комплементсвязующих органоспецифических антител имеет место при аутоиммунных гемолитических анемиях, лейкопениях, тромбоцитопениях, тиреоидите Хашимото, пернициозной анемии, болезни Аддисона и других.
Между тем, в патогенезе системной и дискоидной красной волчанки, ревматоидного артрита, дерматомиозита, склеродермии, синдрома Шегрена и других форм патологии, ранее именуемых коллагенозами, ведущая роль в развитии воспалительно-деструктивных процессов в тканях отводится клеточному иммунитету. При этом антителозависимый и комплементзависимый цитолиз, патогенное действие токсических иммунных комплексов на различные органы и ткани потенцируют клеточно-опосредованные реакции.
В индукции аутоиммунных заболеваний выделяют несколько возможных механизмов:
1. Аутоиммунные поражения могут возникать в результате срыва иммунологической толерантности к собственным неизмененным тканям. Срыв иммунологической толерантности может быть обусловлен соматическими мутациями лимфоидных клеток, что приводит либо к появлению мутантных запретных клонов Т-хелперов, обеспечивающих развитие иммунного ответа на собственные неизменные антигены. В ряде случаев возможно образование костимулирующих молекул, модифицирующих структуру МНС антигенов, воспринимаемых лимфоидной системой как генетически чужеродное образование.
2. В последние годы важная роль в развитии аутоиммунных реакций отводится Тh17, синтезирующим ряд про- и противовоспалительных цитокинов, в частности, IL-17, GCSF, TNFα, IL-6, IL-10, IL-12 и др..
3. Образование аутоантител против естественных, первичных, антигенов-аллергенов иммунологически забарьерных тканей (нервной, хрусталика, щитовидной железы, яичек, спермы). В эмбриональный период забарьерные антигены отделены от крови гистогематическими барьерами, препятствующими их контакту с иммунокомпетентными клетками. В результате к забарьерным антигенам не формируется иммунологическая толерантность. При появлении в крови забарьерных антигенов против них начинают вырабатываться аутоантитела и возникает аутоиммунное поражение.
4. Образование аутоантител против приобретенных, вторичных, антигенов, образующихся под влиянием повреждающего воздействия на органы и ткани патогенных факторов неинфекционной (тепло, холод, ионизирующее излучение) и инфекционной (микробных токсинов, вирусов, бактерий) природы.
5. Образование аутоантител против перекрестно-реагирующих или гетерогенных антигенов. Мембраны некоторых разновидностей стрептококка имеют антигенное сходство с сердечными тканевыми антигенами и антигенами базальной мембраны почечных клубочков. В связи с этим антитела к названным микроорганизмам при стрептококковых инфекциях реагируют с тканевыми антигенами сердца и почек, приводя к развитию аутоиммунного поражения.
Разделение аллергических реакций на несколько основных типов в определенной степени условно, поскольку многие антигены-аллергены, воздействующие на организм, являются комплексными и одномоментно вовлекают в иммунный ответ и В-систему лимфоцитов, и Т-лимфоциты-эффекторы.
Преобладание того или иного типа аллергических реакций в патогенезе аллергического заболевания позволяет отнести его к реакциям гуморального или клеточного типов.
Некоторые виды аутоиммунных заболеваний являются классическим примером одномоментного взаимодействия или последовательного развития аллергических реакций гуморального и клеточного типов, лежащих в основе системного или локального воспалительно-деструктивного повреждения тканей.
Возможности проведения аллерген-специфической иммунотерапии у полисенсибилизированных пациентов

В настоящее время проблема полисенсибилизации является актуальной как в педиатрической аллергологической практике, так и у взрослого населения. Именно поэтому ранняя грамотная аллергодиагностика и проведение профилактических и лечебных мероприятий являютс
Currently, the problem of poly-sensitization is relevant to both the pediatric and adult population. That’s why early allergic diagnosis and preventive and therapeutic measures are essential for prevention of atopic disease progression, and improve the quality of life.
Число пациентов, страдающих аллергическими заболеваниями, ежегодно увеличивается. По официальным данным, аллергическим ринитом в мире страдают более 500 млн человек, однако реальные данные о заболеваемости могут существенно отличаться в большую сторону [1, 2]. Респираторная аллергия не является статичным, неизменным состоянием. Сенсибилизация к аэроаллергенам имеет тенденцию к естественному развитию, выражающемуся в расширении спектра сенсибилизации и утяжелении симптоматики [3, 4].
Рекомендации Европейского консорциума по изучению аллергических заболеваний и бронхиальной астмы (The Global Allergy and Asthma European Network, GA 2 LEN)/Европейской академии аллергологии и клинической иммунологии (European Academy of Allergy and Clinical Immunology, EAACI) указывают на то, что число аллергенов, к которым сенсибилизирован пациент, менее важно, чем клинические проявления, вызванные сенсибилизацией к тому или иному аллергену. Среди пациентов, обращающихся за помощью к аллергологу, значительная часть является полисенсибилизированными. В Европе их доля составляет 12,8–25,3%, в США — 38,8%, в России в разных географических регионах колеблется от 29,6% до 72% [1, 5, 6]. Пациенты с респираторной аллергией средней и тяжелой степени в 50–80% оказываются полисенсибилизированными [7]. Расширение спектра сенсибилизации прослеживается при анализе пациентов разных возрастных групп: так, во Франции среди детей младше 11 лет доля полисенсибилизированных составляет 54%, среди подростков — 61,7%, среди взрослых — 64,8% [8].
По данным Arbes с соавт., при проведении кожного прик-тестирования 165 детей с бронхиальной астмой в возрасте 1,5–8 лет сенсибилизированными к одному из аллергенов (клещу домашней пыли, пыльцевым, эпидермальным, грибковым) оказались все обследованные. Повторное тестирование тех же пациентов в промежутке времени от 2 до 10 лет выявило полисенсибилизацию в 43,6% случаев: в группе детей младше 5 лет их доля составила 47,9%, у более старших детей — 37,3%. При этом дети с моносенсибилизацией к клещу домашней пыли в 45,4% приобрели полисенсибилизацию, тогда как у моносенсибилизированных к пыльцевым аллергенам расширение спектра произошло в 32,1% [9].
Основным патогенетическим методом лечения атопических заболеваний признана аллерген-специфическая иммунотерапия (АСИТ), которая воздействует практически на все значимые звенья патогенеза аллергической реакции. Целью АСИТ является как уменьшение клинической выраженности симптомов аллергического заболевания, так и снижение или полное отсутствие потребности в приеме фармакологических препаратов.
Определение спектра сенсибилизации
Учитывая, что АСИТ является дорогостоящим методом лечения, проводимым в течение длительного периода времени (от 3 до 5 лет), для его планирования необходимо определение ведущего в развитии заболевания аллергена. У некоторых пациентов достаточно подробного сбора анамнеза и проведения традиционного аллергообследования (кожные пробы и/или определение специфических IgE (sIgE)), например, как в случае аллергии на пыльцу растений с четко определенными сроками пыления. Однако сложность диагностики увеличивается, когда пациент демонстрирует поливалентную сенсибилизацию при проведении диагностических тестов на основе аллергенных экстрактов, что встречается достаточно часто. Согласно определениям Всемирной организации по изучению аллергии (World Allergy Organisation, WAO), полисенсибилизацией принято считать сенсибилизацию к двум и более аллергенам, подтвержденную sIgE или положительными кожными пробами. При этом полисенсибилизированный пациент не обязательно имеет полиаллергию, тогда как полиаллергичный пациент обязательно окажется полисенсибилизированным. Понятие полисенсибилизации включает в себя перекрестную реактивность, когда один и тот же sIgE связывается с различными аллергенами, имеющими сходную структуру, и ко-сенсибилизацию — одновременное присутствие различных sIgE, реагирующих с аллергенами, не имеющими сходной структуры [10].
Задача аллерголога заключается в установлении причинно-значимого аллергена, определяющего клиническую симптоматику у данного пациента. Правильно выполненные кожные пробы являются высокоспецифичными и высокочувствительными при диагностике сенсибилизации к аэроаллергенам. Однако положительные результаты кожных проб не всегда коррелируют с наличием и выраженностью клинических симптомов заболевания. Не стоит забывать и о том, что сенсибилизация к одним аллергенам лучше выявляется путем проведения кожных проб, а к другим — с помощью определения sIgE [11]. При оценке результатов кожных проб и уровней sIgE важно помнить о существовании сенсибилизации к паналлергенам, одним из важнейших представителей является белок nsLTP (белок-переносчик липидов). Аллергены этой группы широко распространены в природе, ответственны за IgE-опосредованные перекрестные реакции между пыльцевыми и пищевыми растительными аллергенами, поэтому могут приводить к ошибочному заключению о полисенсибилизации у пациентов с пыльцевой сенсибилизацией. Биологическая функция протеинов группы nsLTP состоит в осуществлении транспорта фосфолипидов и галактолипидов через клеточные мембраны и играет важную роль в защите растений от грибков и бактерий [12]. Паналлергены группы nsLTP содержатся как в пыльце, так и в растительных пищевых продуктах; описаны белки со свойствами nsLTP, выделенные из абрикоса, сливы, яблока, лесного ореха, пыльцы полыни, обладающие способностью перекрестно реагировать с IgE-антителами, специфичными к другим аллергенам своей группы. Аллергены группы nsLTP имеют небольшой молекулярный вес (9–10 кДа), демонстрируют чрезвычайную стабильность как при нагревании, так и под воздействием пепсина и соляной кислоты. Примером такого белка может служить аллерген Pru p 3, выделенный из персика. Клинически сенсибилизация к Pru p 3 проявляется серьезными угрожаемыми жизни системными реакциями.
В случае кожных проб, указывающих на полисенсибилизацию, реальный статус пациента может быть действительной полисенсибилизацией, но может быть и замаскированной моносенсибилизацией. В этом случае на помощь приходит недавно внедренная в клиническую практику компонентная (молекулярная) аллергодиагностика. Она заключается в определении in vitro главных (мажорных), второстепенных (минорных) аллергокомпонентов, а также паналлергенов [10, 13].
Мажорными компонентами считаются аллергенные молекулы с распространенностью более 50%, содержащиеся в данном аллергенном источнике в большем количестве, антитела к которым встречаются более чем у половины сенсибилизированных пациентов в популяции, устойчивые к нагреванию, более иммуногенные, крупные по размеру.
Минорными считаются аллергенные компоненты с распространенностью менее 10% и в составе аллергенного источника обычно содержащиеся в меньшем количестве, более мелкие по размеру, менее иммуногенные, присутствующие во многих аллергенах, иногда не близкородственных, обеспечивая тем самым перекрестную аллергию.
Данные компонентной аллергодиагностики показывают, что у значительного числа полисенсибилизированных пациентов имеются IgE против перекрестно реагирующих паналлергенов в количестве от 10% до 40% [14, 15]. Применение компонентной аллергодиагностики позволяет измерять уровни sIgE, связывающихся с единственным белковым компонентом аллергена, полученным путем выделения и очистки из естественного источника или посредством рекомбинантных технологий. Компонентная аллергодиагностика позволяет идентифицировать клинически важные sIgE, дифференцировать перекрестную реактивность от ко-сенсибилизации и назначить оптимальную аллерген-специфическую терапию [16, 17].
Показания для проведения компонентной аллергодиагностики [10]:
Проведение АСИТ полисенсибилизированным пациентам
Единственным патогенетическим методом лечения атопических заболеваний до настоящего момента остается АСИТ. Результаты многочисленных клинических испытаний с высокой степенью доказательности свидетельствуют об эффективности АСИТ, которая при правильном выборе пациентов и при соблюдении рекомендованных схем и длительности терапии может достигать 70–90% по данным разных авторов. Однако среди пациентов, получающих АСИТ, есть группы, демонстрирующие как высокий, так и средний терапевтический эффект, а иногда и его отсутствие. В связи с этим эффективность АСИТ продолжает обсуждаться, несмотря на убедительные доказательства эффективности метода. До сих пор не разработаны объективные критерии, позволяющие прогнозировать конечный результат аллерген-специфической иммунотерапии. Подходы к назначению АСИТ в группе полиаллергичных пациентов различны в разных странах и сообществах, поскольку в силу тех или иных причин сформировались свои взгляды на оптимальные подходы к аллерген-специфическому лечению таких пациентов: в США предпочтение отдается лечению смесями аллергенов, тогда как в Европе — индивидуальными аллергенами; в России практикуются оба подхода [18].
В настоящее времени не существует унифицированных национальных или международных рекомендаций по проведению АСИТ в группе полисенсибилизированных пациентов, однако имеются опубликованные мнения международных экспертных групп, на которые могут ориентироваться практикующие врачи.
Европейским медицинским агентством (European Medicines Agency, ЕМА) опубликованы единственные на данный момент рекомендации для производителей по приготовлению экстрактов аллергенов и составлению смесей экстрактов аллергенов, где за основу взят принцип гомологичных групп. Аллергены из гомологичных групп, как правило, принадлежат к одному или близким таксономическим семействам. Экстракты аллергенов одной гомологичной группы схожи по составу, физико-химическим и биологическим свойствам сырья, производственному процессу обработки и получения окончательного продукта, а также имеют структурное сходство, лежащее в основе перекрестных реакций. Смешивание аллергенов отражается на фармакологической стабильности и точности дозировки, что может приводить к проблемам безопасности при клиническом использовании такого препарата. Рекомендации ЕМА указывают на то, что аллергологам не следует смешивать неродственные аллергены и однозначно не советуют смешивать друг с другом сезонные и круглогодичные аллергены, а также аллергены, обладающие протеолитической активностью — такие как экстракты клещей домашней пыли, плесеней и насекомых без достаточных на то оснований [19].
Персонализированный подход к пациенту должен учитывать тип и степень тяжести симптомов, влияние на качество жизни пациента, выявление аллергена, вызывающего наиболее длительную по времени симптоматику в течение года и возможность осуществления элиминационных мероприятий. Хорошо собранный анамнез приводит к диагностике аллергического ринита в 82–85% при сезонном и 77% при круглогодичном варианте этого заболевания [20]. Применение кожного аллерготестирования или определение sIgE увеличивает точность диагноза до 97–99%. Для диагностики может быть использован провокационный назальный или конъюнктивальный тест, однако выполняется он далеко не везде. При выявлении полисенсибилизации по результатам кожных проб стоит рассмотреть вопрос о проведении компонентной аллергодиагностики для выявления истинной сенсибилизации, выделения причинно-значимого аллергена и решения вопроса о проведении АСИТ.
По мнению экспертов, для проведения АСИТ лучше всего выбрать два аллергена, наиболее клинически значимых у данного пациента. Лечение может проводиться как параллельно индивидуальными аллергенами, так и путем введения их смеси. По возможности, предпочтение следует отдавать назначению двух индивидуальных аллергенов параллельными курсами. Следует помнить о том, что не существует научного обоснования для определения доли каждого аллергена в смеси, ориентируясь на результаты выраженности кожных проб или уровни sIgE. Врач-аллерголог также должен иметь в виду, что смешивание нескольких экстрактов аллергенов связано с риском их протеолитического разрушения и возможностью возникновения конкуренции аллергенов из-за сатурации их процессинга в месте введения [21–23].
Проведение курса АСИТ двумя индивидуальными аллергенами предпочтительно в случае использования аллергенов из не гомологичных групп, например, аллергенов клещей домашней пыли и пыльцы злаков. При этом подкожные инъекции проводятся в разные конечности, желательно с 30-минутным интервалом. Таким образом, соблюдаются рекомендации по проведению АСИТ и при возникновении нежелательной реакции будет известен аллерген, вызвавший ее, что позволит скорректировать схему лечения [24].
Для сублингвальной иммунотерапии (СЛИТ) эксперты рекомендуют применение двух индивидуальных лечебных аллергенов утром с интервалом 30 минут между применением первого и второго препарата или применение первого аллергена утром, а второго — позже в этот же день [23]. Возможный эффект сатурации в слизистой полости рта, с точки зрения рекомендующих такую тактику СЛИТ, может быть преодолен соблюдением 30-минутного интервала между введениями аллергенов.
В случае решения вопроса о назначении АСИТ последовательно двумя аллергенами, стоит начинать терапию аллергеном, наиболее важным с клинической точки зрения. Окончив 3-летний курс лечения первым аллергеном, необходимо сделать перерыв в терапии длительностью 1 год, после чего начать АСИТ вторым по клинической важности аллергеном. При соблюдении рекомендуемых схем лечения речь идет о 6–7-летнем периоде, а вследствие этого встает вопрос о комплаентности пациента.
Имеющиеся на фармацевтическом рынке инъекционные и подъязычные формы аллергенов дают возможность комбинирования курсов АСИТ и СЛИТ. Например, сочетание АСИТ круглогодичным аллергеном и предсезонно-сезонный курс СЛИТ пыльцевым аллергеном позволят избежать сатурации процессинга аллергенов в месте ведения и уменьшить общее число введений аллергенов, сохраняя эффективность и надежность при правильном выборе и проведении терапии.
При решении вопроса о проведении АСИТ аллергенами из трех и более аллергенных источников нужно понимать, что подобная терапия может проводиться только в тех случаях, когда все они вызывают яркую клиническую симптоматику и компонентная диагностика подтвердила вовлеченность каждого аллергена в патогенез заболевания. Тем не менее перед назначением АСИТ в таких случаях стоит решить вопрос о том, принесет ли лечение несколькими аллергенами, даже в сочетании с медикаментозной терапией, уменьшение симптоматики заболевания и облегчение состояния пациента. Если все же АСИТ тремя аллергенами будет назначена, проводить ее нужно по общим правилам, принимая во внимание указания, данные для АСИТ двумя аллергенами, т. е. введение в разные места и в разное время.
Выводы
В настоящее время проблема полисенсибилизации является актуальной в повседневной аллергологической практике. С возрастом происходит расширение спектра сенсибилизации, поэтому ранняя диагностика, проведение комплексного обследования, профилактики и лечения, включая АСИТ, являются необходимым условием для предотвращения прогрессирования атопического заболевания и улучшения качества жизни пациентов с аллергопатологией. Использование при проведении кожного тестирования цельных аллергенных экстрактов из натуральных источников не дает возможности точной диагностики различных клинических состояний, обусловленных одним и тем же сенсибилизирующим аллергенным источником. В подобных случаях для определения причинно-значимого аллергена, а в дальнейшем для решения вопроса о проведении АСИТ у полисенсибилизированных пациентов возможно использование компонентной аллергодиагностики. Комбинированные схемы АСИТ с использованием инъекционных и/или подъязычных форм аллергенов должны проводиться строго по показаниям, с учетом рекомендаций экспертов.
Литература
* ФГБНУ НИИ ВС им. И. И. Мечникова, Москва
** ФГБОУ ВО ЯГМУ, Ярославль