что такое рибосомы в биологии
Рибосомы: строение и функции
Рибосомы – это как крошечные фабрики в клетке. Они производят белки, которые выполняют различные функции для работы клетки.
Рибосомы или находятся в жидкости внутри клетки, что называется цитоплазмой, или присоединены к мембране. Их можно найти как у прокариотах (бактерий), так и у эукариотах (животные и растения). Больше о химическом составе и структуре клетки читайте в учебнике по биологии за 9 класс Л.И. Остапченко.
Рибосома имеет два основных компонента, которые называются большой и малой субъединицами. Эти две единицы объединяются, когда рибосома готова выработать новый белок. Они состоят из цепей РНК и различных белков.
В большой субъединицы содержатся сайты, где создаются новые связи при создании белков. Малая субъединица на самом деле не так уж и мала, только немного меньше, чем большая. Она отвечает за поток информации при синтезе белка.
Согласно величине константы седиментации, которая зависит от размера частиц, их формы и плотности, рибосомы разделяют на 70S (S является единицей измерения Сведберга) – прокариотические и 80S – эукариотические. Рибосомы хлоропластов высших растений относятся к 70S типа. Митохондриальные рибосомы грибов имеют коэффициент седиментации 75S, а митохондрии млекопитающих содержат мини-рибосомы – 55S, хотя функциями они похожи на 70S рибосом прокариот.
Основная работа рибосомы – это изготовление белков для клетки. Клетке необходимо изготовить сотни белков, поэтому рибосома требует конкретных инструкций, как изготовить каждый. Эти инструкции поступают из ядра в виде месенджерних РНК. В м-РНК содержатся конкретные коды, которые действуют как рецепт, чтобы рассказать рибосоме, как сделать белок.
В выработке белков есть два основных этапа: транскрипция и трансляция. Рибосома делает этап трансляции. Узнать больше о белках можно в учебнике по биологии за 9 класс В.И. Соболя.
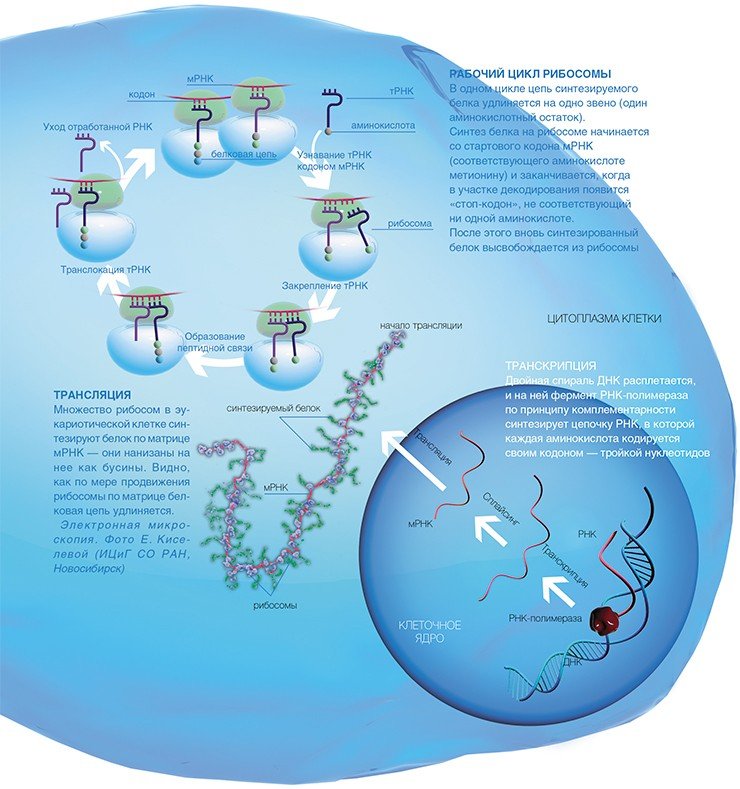
Трансляция – это процесс получения инструкций от м-РНК и превращения ее в белок. Основной задачей функционирования живой клетки считается биосинтез белка. Для воспроизведения этой операции абсолютно во всех клеточных организмах находятся рибосомы. Рибосома делает следующие шаги, чтобы сделать белок:
Две субъединицы объединяются вместе с РНК для обмена сообщениями.
Рибосома распознает тритонуклеотидные кодоны м-РНК.
Рибосома движется вниз по РНК, читая инструкции о том, какие аминокислоты присоединить к белку. Для отличия аминокислот в клетке существуют особые «адаптеры» – молекулы т-РНК. Они напоминают форму листа клевера, имеющий область (антикодон), соответствующую кодону м-РНК, и еще один участок для присоединения аминокислоты, которая комплиментарная этому кодону.
Рибосома присоединяет аминокислоты, образующие белок. Прикрепление аминокислот к т-РНК происходит в энергозависимой реакции с помощью ферментов аминоацил-т-РНК-синтетазы.
Рибосома прекращает строить белок, когда он достигает кода «стоп» в РНК, который сообщает ему, что белок готов.
Интересные факты о рибосоме:
Название рибосомы происходит от рибонуклеиновой кислоты (РНК), которая дает указания по изготовлению белков.
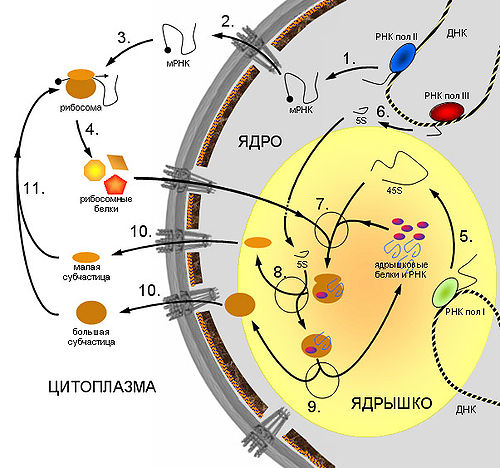
Рибосомы изготавливаются внутри ядра. После того, как они готовы, они направляются за его пределы через поры в мембране ядра.
Рибосомы отличаются от большинства органелл тем, что они не окружены защитной мембраной.
Рибосому было открыто в 1974 году Альбертом Клодом, Кристианом де Дюве и Джорджем Эмилем Палладом. Они получили Нобелевскую премию за свое открытие.
Рибосома
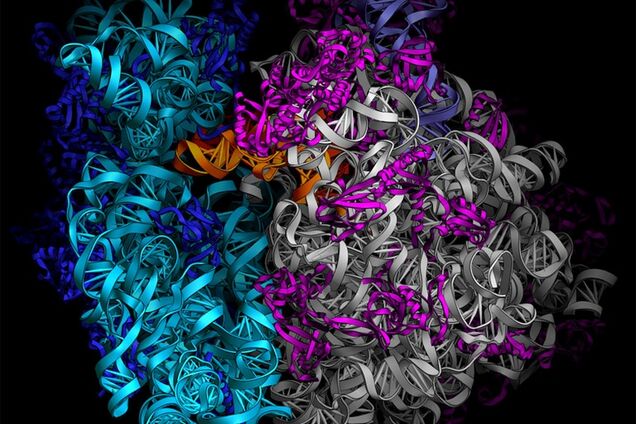
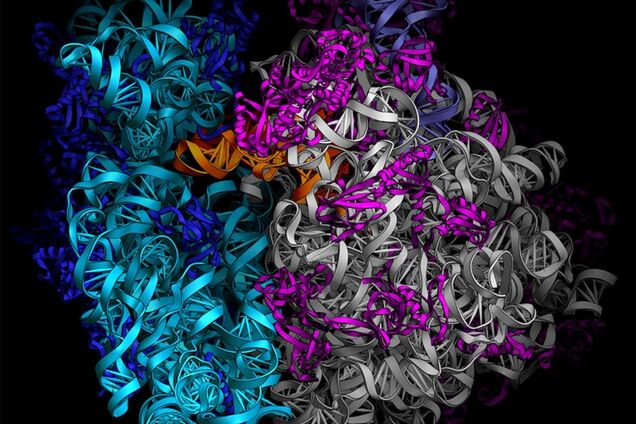
Рибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Содержание
История исследований рибосомы
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы. [4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Строение функция рибосома
Строение функция рибосома
Строение функция рибосома
Рибосомы — это важнейшие компоненты клеток как прокариот, так и эукариот. Строение и функции рибосом связаны с синтезом белка|белка в клетке, т. е. процессом трансляции.
По химическому составу рибосомы представляют собой рибонуклеопротеиды, т. е. состоят из РНК и белков. В рибосомы входит только один тип РНК – рРНК (рибосомальная РНК). Однако существует 4 разновидности её молекул.
По строению рибосомы — это мелкие, округлой формы, немембранные органоиды клетки. Их количество в разных клетках варьирует от тысяч до нескольких миллионов. Рибосома — это не монолитная структура, она состоит из двух частиц, которые называют большой и малой субъединицами.
В клетках эукариот большинство рибосом прикреплено к ЭПС, в результате чего последняя становится шероховатой.
Большая|Большая часть рРНК, составляющая рибосомы, синтезируется в ядрышке. Ядрышко образуют определённые участки разных хромосом, содержащие множество копий генов, на которых синтезируется предшественник молекул рРНК. После синтеза предшественника он видоизменяется и распадается на три части — разные молекулы рРНК.
Одна из четырёх типов молекул рРНК синтезируется не в ядрышке, а в ядре на других участках хромосом.
В ядре происходит сборка отдельных субъединиц рибосом, которые затем выходят в цитоплазму, где при синтезе белка|белка объединяются.
По строению обе субъединицы рибосом представляют собой молекулы рРНК, которые принимают определённые третичные структуры (сворачиваются) и инкрустируются десятками различных белков. При этом в состав большой субъединицы рибосом входит три молекулы рРНК (у прокариот — две), а в состав малой — только одна.
Единственная функция рибосом — это обеспечение возможности протекания химических реакций при биосинтезе белка|белка в клетке. Матричная РНК, транспортные РНК, множество белковых факторов в рибосоме занимают определённые положения, что даёт возможность эффективно протекать химическим реакциям.
При объединении субъединиц в рибосоме образуются «места|места» – сайты. Рибосома движется по мРНК и «считывает» кодон за кодоном. В один сайт поступает тРНК с присоединённой к ней аминокислотой, в другом – находится ранее прибывшая тРНК, к которой прикреплена ранее синтезированная полипептидная цепочка. В рибосоме между аминокислотой и полипептидом образуется пептидная связь. В результате полипептид оказывается на «новой» тРНК, а «старая» покидает рибосому. На её место смещается оставшаяся тРНК вместе со своим «хвостом» (полипептидом). Рибосома сдвигается по мРНК вперёд на один триплет, и к нему присоединяется комплементарная тРНК и т. д.
По одной цепи мРНК могут двигаться друг за другом|другом несколько рибосом, образуя полисому.
Видео по теме : Строение функция рибосома
Строение функция рибосома
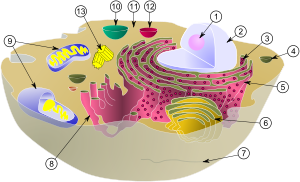
Каждая клетка любого организма имеет сложную структуру, включающую в себя множество компонентов.
Вкратце о строении клетки
Она состоит из мембраны, цитоплазмы, органоидов, которые в них расположены, а также ядра|ядра (кроме прокариотов), в котором находятся молекулы ДНК. Кроме того, над мембраной имеется дополнительная защитная структура. В животных клетках это гликокаликс, во всех остальных — клеточная стенка. У растений она состоит из целлюлозы, у грибов — из хитина, у бактерий — из муреина. Мембрана состоит из трёх слоёв: двух фосфолипидных и белкового между ними. В ней есть поры|поры, благодаря которым осуществляется перенос веществ внутрь и наружу. Возле каждой поры|поры расположены специальные транспортные белки|белки, которые пропускают в клетку только определённые вещества. Органоидами животной клетки являются:
Рибосома — это что?
Раз уж мы говорим о ней в данной статье, то вполне логично задать такой вопрос. Рибосома — это органоид, который может быть расположен на внешней стороне стенок комплекса Гольджи. Нужно уточнить ещё, что рибосома — это органоид, который содержится в клетке в очень больших|больших количествах. В одной может находиться до десяти тысяч.
Где находятся данные органоиды?
Итак, как уже говорилось, рибосома — это структура, которая находится на стенках комплекса Гольджи. Также она может свободно передвигаться|передвигаться по цитоплазме. Третий вариант, где может располагаться рибосома — мембрана клетки. И те органоиды, которые находятся в этом месте, практически не покидают его и являются стационарными.
Рибосома — строение
Как же выглядит данная органелла? Она похожа на телефон с трубкой. Рибосома эукариот и прокариот состоит из двух частей, одна из которых больше, другая — меньше. Но эти две её составляющие не соединяются вместе, когда она находится в спокойном состоянии. Это происходит только тогда, когда рибосома клетки непосредственно начинает выполнять свои функции. О функциях мы поговорим позже. Рибосома, строение которой описывается в статье, также имеет в своём составе информационную РНК и транспортную РНК. Данные вещества необходимы для того, чтобы записывать на них информацию о нужных клетке белках|белках. Рибосома, строение которой мы рассматриваем, не имеет собственной мембраны. Её субъединицы (так называются две её половины) ничем не защищены.
Какие функции выполняет в клетке данный органоид?
То, за что отвечает рибосома, — синтез белка|белка. Он происходит на основе информации, которая записана на так называемой матричной РНК (рибонуклеиновой кислоте). Рибосома, строение которой мы рассмотрели выше, объединяет свои две субъединицы только на время синтеза белка|белка — процесса под названием трансляция. Во время данной процедуры синтезируемая полипептидная цепь находится между двумя субъединицами рибосомы.
Где они формируются?
Рибосома — органоид, который создаётся ядрышком. Данная процедура происходит в десять этапов, на протяжении которых постепенно формируются белки|белки малой и большой субъединиц.
Каким образом происходит формирование белков?
Биосинтез белков происходит в несколько этапов. Первый из них — это активация аминокислот. Всего их существует двадцать, при комбинировании их разными методами можно получить миллиарды различных белков. На протяжении данного этапа из аминокислот формируется аминоалиц-т-РНК. Данная процедура невозможна без участия АТФ (аденозинтрифосфорной кислоты|кислоты). Также для осуществления этого процесса необходимы катионы магния. Второй этап — это инициация полипептидной цепи, или процесс объединения двух субъединиц рибосомы и поставка к ней необходимых аминокислот. В данном процессе также принимают участие ионы магния и ГТФ (гуанозинтрифосфат). Третий этап называется элонгацией. Это непосредственно синтез полипептидной цепи. Происходит методом трансляции. Терминация — следующий этап — это процесс распада рибосомы на отдельные субъединицы и постепенное прекращение синтеза полипептидной цепочки. Далее идёт последний этап — пятый — это процессинг. На этой стадии из простой цепи аминокислот формируются сложные структуры, которые уже и представляют собой готовые белки|белки. В данном процессе участвуют специфические ферменты, а также кофакторы.
Структура белка|белка
Так как рибосома, строение и функции которой мы разобрали в этой статье, отвечает за синтез белков, то давайте рассмотрим подробнее их структуру. Она бывает первичной, вторичной, третичной и четвертичной. Первичная структура белка|белка — это определённая последовательность, в которой располагаются аминокислоты|аминокислоты, формирующие данное органическое соединение. Вторичная структура белка|белка представляет собой сформированные из полипептидных цепочек альфа-спирали и бета-складки. Третичная структура белка|белка предусматривает определённую комбинацию альфа-спиралей и бета-складок. Четвертичная же структура заключается в формировании единого макромолекулярного образования. То есть комбинации альфа-спиралей и бета-структур формируют глобулы либо фибриллы. По этому принципу можно выделить два типа белков — фибриллярные и глобулярные. К первым относятся такие, как актин и миозин, из которых сформированы мышцы. Примерами вторых могут служить гемоглобин, иммуноглобулин и другие. Фибриллярные белки|белки напоминают собой нить, волокно. Глобулярные больше похожи на клубок сплетённых между собой альфа-спиралей и бета-складок.
Что такое денатурация?
Каждый наверняка слышал это слово. Денатурация — это процесс разрушения структуры белка|белка — сначала четвертичной, затем третичной, а после — и вторичной. В некоторых случаях происходит и ликвидация первичной структуры белка|белка. Данный процесс может происходить вследствие воздействия на данное органическое вещество высокой температуры. Так, денатурацию белка|белка можно наблюдать при варке куриных яиц. В большинстве случаев этот процесс необратим. Так, при температуре выше сорока|сорока двух градусов начинается денатурация гемоглобина, поэтому сильная гипертермия опасна для жизни. Денатурацию белков до отдельных нуклеиновых кислот можно наблюдать в процессе пищеварения, когда с помощью ферментов организм расщепляет сложные органические соединения на более простые.
Вывод
Роль рибосом очень сложно переоценить. Именно они являются основой существования клетки. Благодаря данным органоидам она может создавать белки|белки, которые ей необходимы для самых разнообразных функций. Органические соединения, формирующиеся рибосомами, могут играть защитную роль, транспортную, роль катализатора, строительного материала для клетки, ферментативную, регуляторную (многие гормоны имеют белковую структуру). Поэтому можно сделать вывод, что рибосомы выполняют одну из самых важных функций в клетке. Поэтому их и так много — клетке всегда нужны продукты, синтезируемые данными органоидами.
Рибосома – минифабрика по производству белков
Одним из наиболее сложных процессов, осуществляемых живыми существами, является, пожалуй, синтез белков — важнейших структурных и функциональных «кирпичиков» любого организма. Подлинное понимание молекулярных процессов, лежащих в его основе, могло бы пролить свет на неимоверно давние события, связанные с тайной зарождения самой Жизни.
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
Рибосома синтезирует белок со средней скоростью 10—20 аминокислот в секунду. Точность трансляции исключительно высока — ошибочное включение «неправильного» аминокислотного остатка в цепь белка составляет в среднем одну аминокислоту на 3 тыс. звеньев (при средней длине белковой цепи у человека в 500 аминокислотных остатков), т. е. всего одна ошибка на шесть белков.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
Одна клетка может содержать до 10 тыс. рибосом — белковых минифабрик, составляющих до 30% сухой клеточной массы
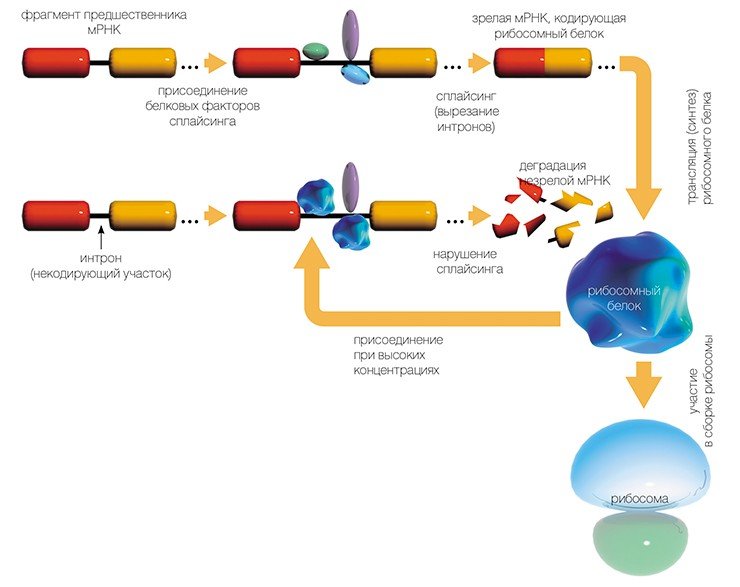
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
Но РНК, полученная таким образом, еще не является матрицей для синтеза белка: из нее, вырезаются определенные «некодирующие» куски нуклеотидной последовательности (процесс сплайсинга).
Точность белкового синтеза рибосомой исключительно высока — у человека ошибка составляет один на три тысячи «неправильный» аминокислотный остаток
В результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.
Как поступают в рибосому аминокислоты, являющиеся строительными кирпичиками для синтеза белка? Еще в 50-х годах прошлого столетия были открыты особые «перевозчики», доставляющие аминокислоты в рибосому, — короткие (длиной менее 80 нуклеотидов) транспортные РНК (тРНК). Специальный фермент присоединяет аминокислоту к одному из концов тРНК, причем каждой аминокислоте соответствует строго определенная тРНК. Синтез белка на рибосоме включает три основные стадии: начало, удлинение полипептидной цепи и окончание.
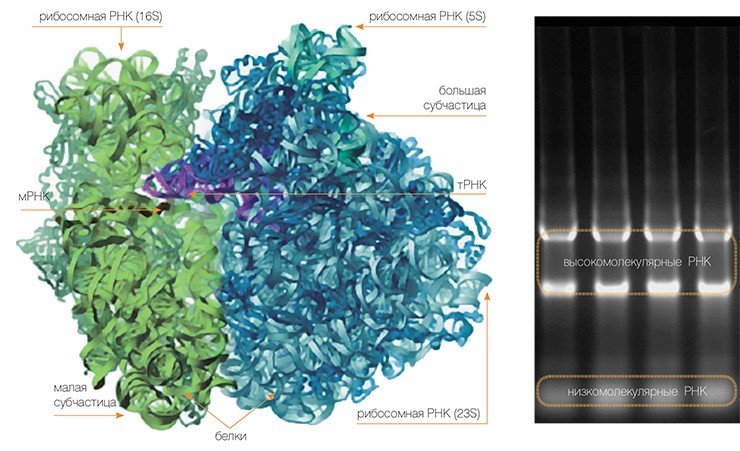
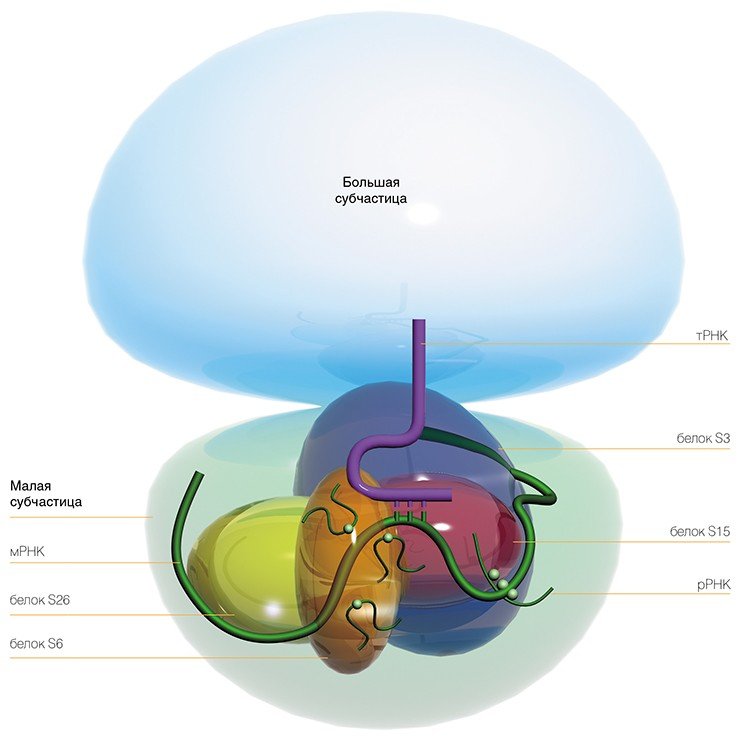
Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производства
Большая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Нужно отметить, что рибосомные белки наделены множеством других, дополнительных функций, которые могут проявляться на разных этапах жизнедеятельности клетки. Например, рибосомный белок S3 человека — один из ключевых белков центра связывания мРНК на рибосоме — принимает также участие в «ремонте» повреждений в ДНК (Kim et al., 1995), участвует в апоптозе (запрограммированной гибели клетки) (Jung et al., 2004), а также защищает от разрушения белок теплового шока (Kim et al., 2006).
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
От низших — к высшим
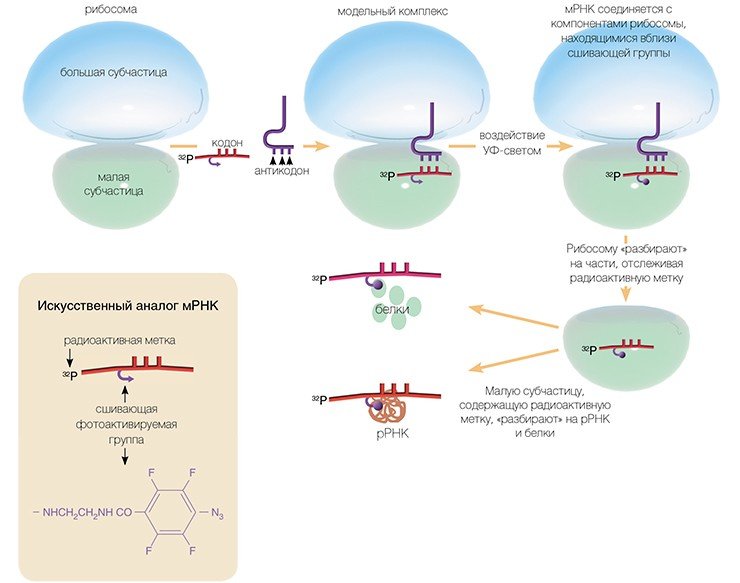
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод основан на использовании коротких синтетических мРНК, несущих в выбранном положении химически активные («сшивающие») группы, которые в нужный момент можно активировать (например, облучая мягким ультрафиолетовым светом).
Метод аффинного химического сшивания был разработан 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.До появления рентгеноструктурного анализа рибосом он использовался во всем мире для изучения рибосом у прокариот.
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Впервые экспериментально удалось показать, что все нуклеотиды рРНК малой рибосомной частицы человека, соседствующие с кодонами мРНК, расположены в консервативных районах вторичной структуры молекулы рРНК. Более того, их расположение совпадает с положением соответствующих нуклеотидов во вторичной структуре рРНК рибосом низших организмов. Это позволило сделать вывод, что эта часть рибосомной РНК малой субчастицы составляет эволюционно консервативный «кор» (сердцевину) рибосомы, структурно идентичный у всех организмов.
С другой стороны, в устройстве мРНК-связывающего канала рибосом у человека и низших организмов обнаружен ряд принципиальных различий. Оказалось, что у высших организмов рибосомные белки играют намного большую роль в формировании этого канала, чем у прокариот, кроме того, в этом участвуют также белки, не имеющие «двойников» (гомологов) у низших организмов.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.