что такое ремиссия при ревматоидном артрите
Что такое ремиссия при ревматоидном артрите
Могут. Это так называемый серонегативный ревматоидный артрит.
Зачем и как часто надо делать общий и биохимический анализ крови?
Анализы крови выполняются для оценки активности ревматоидного артрита, а также позволяют выявить побочные эффекты проводимого лечения при их развитии. Если лечение базисными препаратами (метотрексатом, лефлуномидом, сульфасалазином, гидроксихлорохином) назначено впервые, анализы крови надо сделать в течение 2-3 недель, а далее ежемесячно в течение первых трех месяцев, затем 1 раз в 2 месяца в течение полугода и далее 1 раз в 3 месяца еще в течение 6-9 месяцев. Если терапия не меняется и нет признаков обострения болезни можно делать анализы крови 1 раз в 6 месяцев.
Лечение ревматоидного артрита Когда нужно начинать лечение ревматоидного артрита?
Лечение ревматоидного артрита необходимо начинать сразу же после установления диагноза, оптимально в первые 3 месяца от появления первых симптомов.
Кто назначает лечение ревматоидного артрита?
Лечение ревматоидного артрита назначается и контролируется ревматологом, который владеет полной информацией о болезни и ее рисках, методах оценки заболевания, терапевтической цели и возможных средствах ее достижения, разработке плана лечения и соотношении польза/риск для индивидуальной терапии.
Какова цель лечения ревматоидного артрита?
Лечение ревматоидного артрита направлено на достижение и поддержание ремиссии или низкой активности заболевания у каждого пациента.
Как часто нужно ходить к ревматологу, чтобы оценить эффективность лечения?
В первый год лечения требуется частый мониторинг (каждые 1-3 месяца). Ревматологом будет проведена коррекция лечения, если нет улучшения в течение 3 месяцев или цель лечения не достигнута через б месяцев после его начала.
Что такое базисная терапия?
Базисная терапия — основа медикаментозного лечения ревматоидного артрита. Она влияет на саму суть болезни, предотвращает прогрессирование заболевания и инвалидизацию. В настоящее время без применения базисных лекарственных средств лечение ревматоидного артрита невозможно.
Какие лекарственные средства используются для базисной терапии?
Золотым стандартом базисной терапии при ревматоидном артрите является метотрексат. При его непереносимости назначают лефлуномид, сульфасалазин, гидроксихлорохин. Это так называемые средства синтетической базисной терапии. Базисную терапию назначает и контролирует ревматолог.
На что надо обратить внимание при лечении базисными лекарственными средствами?
При назначении базисных лекарственных средств необходимо проводить клинический и лабораторный мониторинг каждого пациента для раннего выявления признаков реализации побочных эффектов проводимого лечения. Женщинам репродуктивного возраста на фоне приема базисных препаратов необходима контрацепция.
Что такое биологическая терапия?
Биологические лекарственные средства способны действовать избирательно на определенные компоненты воспалительного процесса. В большинстве случаев эти лекарственные средства представляют собой моноклональные антитела к провоспалительным цитокинам (веществам, вызывающим воспаление), таким какФНОа, интерлейкин-6.
Когда назначается биологическая терапия?
Показания к назначению биологической терапии определяет ревматолог, например, биологическая терапия назначается при недостаточной эффективности синтетической базисной терапии.
Какие лекарственные средства биологической терапии у нас есть? Как давно они применяются?
Биологические лекарственные средства начали применяться в ревматологии в 1998 году. С тех пор накоплен значительный опыт лечения данными препаратами. В настоящее время у нас зарегистрированы для лечения ревматоидного артрита: инфликсимаб, адали- мумаб, этанерцепт, ритуксимаб и тоцилизумаб. Эти лекарственные средства назначаются ревматологом и вводятся в специализированных отделениях, где врачи имеют соответствующий опыт.
Является ли биологическая терапия эффективной?
Биологическая терапия высоко эффективна. Большинство пациентов отмечают значительное улучшение самочувствия. Кроме сим- птом-модифицирующего действия, биологическая терапия обладает патогенетическим (базисным) действием, существенно улучшает прогноз заболевания.
Надо ли принимать метотрексат, если про-водится лечение биологическими лекар-ственными средствами?
Обычно синтетическая базисная терапия сохраняется. Чаще всего нет необходимости в приеме нестероидных противовоспалительных средств. Также на фоне биологической терапии вероятно снижение дозы глюкокортикоидов или их полная отмена.
При использовании тоцилизумаба допускается отказ от синтетических базисных препаратов (метотрексата, сульфасалазина и др.).
Какое значение имеют нестероидные про-тивовоспалительные средства в лечении ревматоидного артрита?
НПВС являются симптом-модифицирующими препаратами, они не влияют на процессы формирования и прогрессирования костно-хрящевой деструкции (разрушения кости и хряща). Их основное назначение — устранение субъективных болезненных ощущений, связанных с воспалением.
Как часто надо принимать нестероидные противовоспалительные средства и можно ли их вообще не использовать?
При ревматоидном артрите нестероидные противовоспалительные препараты (НПВС) принимают «по требованию», это значит, при болях. Чем реже пациент принимает эти лекарственные средства, тем меньше активность заболевания и, вероятно, базисная терапия подобрана верно. В случае постоянного болевого синдрома и необходимости принимать нестероидные противовоспалительные средства практически ежедневно необходимо обратиться к ревматологу для коррекции базисной терапии.
Как и для чего назначаются глюкокортикоиды?
Можно ли отменять гормоны самостоятельно при улучшении самочувствия?
Самостоятельно изменять дозировки глюкокортикоидов и режим приема препаратов нельзя. Действительно, при достижении эффекта, обычно начинают снижать дозу глюкокортикоидов, иногда до полной отмены. Но схему снижения должен предложить врач. Следует знать, что чем меньше доза и чем длительнее время приема глюкокортикоидов, тем медленнее необходимо снижать дозировку. Нельзя пропускать прием препарата.
Для чего вводить глюкокортикоиды в сустав?
Глюкокортикоиды могут вводиться внутрисуставно или периартикулярно (в ткани, окружающие сустав). Преимущество этой терапии состоит во введении препаратов непосредственно в очаг воспаления. Показанием для локальной терапии является необходимость быстро подавить активный воспалительный процесс в суставах в начале заболевания или при выраженном обострении.
Однако вводить глюкокортикоиды в один и тот же сустав можно не чаще 3 раз в год. Также не вводят препараты в сустав, в котором нет воспаления (отсутствует повышение температуры над суставом, припухлость). Если возникает потребность в более частых введениях глко- кортикоидов в сустав, необходимо пересмотреть базисную терапию. Необходимо помнить, что локальная терапия ни в коем случае не является эквивалентом базисного лечения, а назначается и проводится ревматологом в качестве дополнения к системной базисной и противовоспалительной терапии по строгим показаниям.
Какой диеты следует придерживаться при ревматоидном артрите?
Необходимо придерживаться сбалансированной диеты с включением в пищу полинена- сыщенных жирных кислот, фруктов и овощей, а также достаточного количества белка и кальция (мясо, рыба, молочные продукты). При ожирении надо придерживаться гипокалорий- ной диеты. Целесообразно отказаться от приема алкоголя и курения.
Полезно ли движение при ревматоидном артрите?
Движение в рамках повседневной жизни, лечебной физкультуры и активного досуга является залогом хорошего функционального прогноза, предотвращает анкилоз суставов, а также потерю мышечной и костной ткани.
Полезна ли физиотерапия при ревматоидном артрите?
Физиотерапевтические процедуры не влияют на прогрессирование болезни, а являются лишь дополнением к медикаментозному лечению. В период обострения заболевания физиотерапия не рекомендуется, а тепловые процедуры (озокерит, парафинолечение и др.) могут вызвать обострение ревматоидного артрита.
Совместима ли синтетическая базисная терапия с беременностью?
Планирование беременности при ревматоидном артрите должно согласовываться с ревматологом и гинекологом. Оптимально планировать беременность при достижении ремиссии или низкой активности заболевания. Зачатие возможно через 12 месяцев после отмены метотрексата, через 24 месяца после отмены лефлуномида. Допускается прием сульфасалазина до и во время беременности.
Совместима ли беременность с лечением биологическими препаратами?
Во время лечения и мужчинам, и женщинам необходимо соблюдать контрацепцию. Зачатие возможно через б месяцев после отмены биологической терапии.
Ревматоидный артрит: обратимость изменений
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у бо
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у большинства больных образованием особого вида аутоантител (ревматоидный фактор). Женщины болеют в 3–4 раза чаще мужчин, причем заболевание у них начинается обычно в возрасте 35–45 лет.
Болезненные, тугоподвижные суставы не только мешают выполнять самые простые повседневные движения, но и значительно нарушают ритм нормальной жизни.
Ревматоидный полиартрит — тяжелое системное заболевание, которое проявляется прогрессирующим воспалительным синовитом, симметрично поражающим периферические суставы конечностей.
В соответствии с рекомендациями Американской ревматологической ассоциации (1987) при диагностике ревматоидного артрита целесообразно придерживаться следующих критериев:
При длительно текущем заболевании деформируются пораженные суставы. Помимо суставов, при ревматоидном полиартрите нарушаются околосуставные структуры (связки, сухожилия и др.), развиваются ревматоидный васкулит (поражение мелких сосудов), остеопороз, происходит поражение внутренних органов.
В пользу иммунопатологического/аутоиммунного характера воспалительного процесса при ревматоидном артрите свидетельствует обнаружение у большинства больных в сыворотке крови и синовиальном выпоте из пораженных суставов аутоантител — ревматоидного фактора.
Большое значение в развитии ревматоидного артрита имеет генетическая предрасположенность. Это подтверждается выраженной семейной агрегацией заболевания, наличием у части больных ревматоидным артритом антигенов II класса главного комплекса гистосовместимости HLA DR4 и Dw4 (с носительством которых связывают тяжелое течение артрита и быстрое прогрессирование эрозивных изменений суставов). Рассматривается роль наследственных или приобретенных нарушений Т-супрессорной регуляции иммунных реакций, недостаточной функции моноцитарно-макрофагальной системы. Пусковую роль в развитии ревматоидного артрита могут играть: хронические очаги инфекции, гормональная перестройка организма, пищевая аллергия, предшествующие травмы суставов, длительное воздействие влажного холода и физическое перенапряжение.
При хроническом воспалении у края суставного хряща в месте прикрепления к эпифизам суставной капсулы происходит разрушение и замещение паннусом участков субхондральной костной ткани с образованием эрозий. Иногда разрастающиеся грануляции проникают через субхондральную замыкательную пластинку в костную ткань. Продукты костно-хрящевой деструкции, в свою очередь, оказывают раздражающее воздействие на синовиальную оболочку, что способствует поддержанию в ней воспалительного процесса. Одновременно возникают воспалительные изменения в капсуле сустава, связках, синовиальной выстилке сухожилий и синовиальных сумках с последующим их склерозированием, приводящему к стойкому ограничению подвижности пораженных суставов, подвывихам и контрактурам. Иногда наблюдается некроз и разрыв сухожилий, синовиальных сумок. Нередко отмечается развитие вторичного остеоартроза.
Воспалительный процесс при ревматоидном артрите характеризуется неуклонным прогрессированием, темпы которого зависят от активности воспалительного процесса. Даже в периоды клинической ремиссии в синовиальной оболочке сохраняются признаки воспаления. Постепенно паннус разрушает хрящ на значительной поверхности эпифиза, а замещающая его грануляционная ткань соединяет между собой противоположные суставные поверхности и в последующем трансформируется вначале в фиброзную, а затем в костную ткань, что приводит к образованию соответственно фиброзного и костного анкилоза, обусловливающего полную неподвижность пораженных суставов.
При рентгенологическом исследовании суставов отмечается асимметричность эрозивных изменений с частым и ранним анкилозированием суставов запястий.
Течение серонегативного ревматоидного артрита менее тяжелое, в прогностическом плане более благоприятное, чем при серопозитивной форме заболевания: слабее выражены деструктивные (эрозивные) изменения и функциональные нарушения суставов, реже наблюдаются ульнарная девиация пальцев кистей, контрактуры и анкилоз (за исключением анкилоза суставов запястья). Вместе с тем серонегативный ревматоидный артрит хуже, чем серопозитивный, поддается терапии базисными и иммуносупрессивными препаратами. Чаще развивается вторичный амилоидоз.
При лечении ревматоидного артрита используются НПВП, в тяжелых случаях применяются глюкокортикостероиды, иммуносупрессоры, с целью профилактики остеопороза обычно назначают комбинацию препаратов кальция и витамина D.
Несмотря на все успехи фармакологии, ревматоидный артрит до настоящего времени остается тяжелым заболеванием с неблагоприятным прогнозом.
Приведем пример из личного опыта ведения больной с ревматоидным артритом, представляющим, по мнению автора, научный интерес.
Больная В., возраст — 71 год, обратилась к неврологу в августе 2006 г. с жалобами на боли в суставах кистей, коленных суставах, в пояснице. Боль в суставах беспокоила днем и ночью, обычно была выраженной, нередко мигрирующей, обусловливала ограничение всех активных и пассивных движений в пораженных суставах. Артралгия зачастую сочеталась с выраженной миалгией, оссалгией, болями в сухожилиях. Из анамнеза: проявления полиостеоартроза в течение 15 лет, дебют суставного синдрома воспалительного характера в июне 2002 г. (отек и воспаление в области суставов, фебрильная лихорадка, подтвержденная лабораторно активность воспалительного процесса). Амбулаторно (сначала периодически, в последние 3 года постоянно) получала НПВП (ибупрофен, индометацин, диклофенак, ацеклофенак). С 2004 г. регулярно принимала кальций D3 (1 г кальция в сутки).
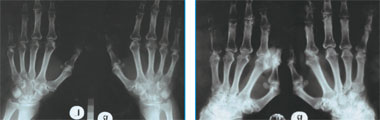 |
| Рис. 1. Рентгенограмма кистей больной В. 2003 г.: проявления полиостеоартроза, явных эрозий нет. Рис. 2. Рентгенограмма кистей больной В. 2006 г.: множественные кисты и эрозии, отрицательная динамика с 2003 г. |
Стационарно проходила лечение в городском ревматологическом центре г. Санкт-Петербурга (апрель 2003 г., июнь–июль 2006 г.) с диагнозом: ревматоидный артрит, серопозитивный, с системными проявлениями (субфебрилитет, амиотрофия, миалгии), активность 2-й степени, функциональная недостаточность суставов 1–2-й степени. Сопутствующая патология: ишемическая болезнь сердца, стенокардия II ФК. Гипертоническая болезнь 3-й степени, ОНМК (декабрь 2002 г.). Хронический бронхит вне обострения. Диффузный зоб второй стадии. Эутиреоз. Полиостеоартроз. Желчно-каменная болезнь.
С 2003 г. постоянно получает метотрексат в дозировке 2,5 мг 2 раза в неделю. Несмотря на проводимое лечение, суставной болевой синдром нарастал, учащались обострения, ухудшалось состояние костей (остеопороз, эрозии). Показательна рентгенография кистей (рис. 1–2).
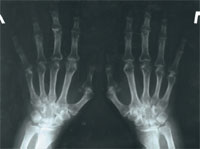 |
| Рис. 3. Рентгенограмма кистей больной В. 2007 г.: проявления полиостеоартроза, положительная динамика с 2006 г. |
С августа 2006 г. на фоне лечения метотрексатом неврологом был дополнительно назначен Структум в дозировке 500 мг 2 раза в день. Больная ориентирована врачом на длительный, до полугода, прием препарата. Некоторое уменьшение интенсивности (непрекращающегося в течение 2 последних месяцев) болевого синдрома наступило через 3 нед. Эпизоды обострений ревматоидного артрита были в течение 4 мес. К концу 5-го месяца комбинированной терапии (метотрексат + Структум) болевой синдром значительно снизился, уменьшилась утренняя скованность, спала отечность лучезапястных и коленных суставов.
В феврале 2007 г. была сделана рентгенография кистей (рис. 3). Результат сравнения с предыдущими рентгенографиями оказался более чем положительным (уменьшились эрозии костей). Прием структума продлен на 3 мес. По состоянию на май 2007 г. обострений суставного синдрома не наблюдалось в течение 4 мес, сохранялась небольшая отечность на лучезапястных (больше слева) и коленных суставах. С целью коррекции противоревматической терапии (снижение дозы метотрексата) больной рекомендована консультация в городском ревмоцентре.
И. Н. Бабурин
СПбНИПНИ им. В. М. Бехтерева, Санкт-Петербург
Современная медикаментозная терапия ревматоидного артрита
Ревматоидный артрит — это заболевание, находящееся в фокусе внимания ревматологов всего мира в течение десятилетий. Это связано с большим медицинским и социальным значением этой болезни. Ее распространенность достигает
Ревматоидный артрит — это заболевание, находящееся в фокусе внимания ревматологов всего мира в течение десятилетий. Это связано с большим медицинским и социальным значением этой болезни. Ее распространенность достигает 0,5–2% от общей численности населения в промышленно развитых странах [1, 2]. У больных ревматоидным артритом наблюдается уменьшение продолжительности жизни по сравнению с общей популяцией на 3–7 лет [3]. Трудно переоценить колоссальный ущерб, наносимый этим заболеванием обществу за счет ранней инвалидизации пациентов, которая при отсутствии своевременно начатой активной терапии может наступать в первые 5 лет от дебюта болезни.
Ревматоидный артрит — хроническое воспалительное заболевание неясной этиологии, для которого характерно поражение периферических синовиальных суставов и периартикулярных тканей, сопровождающееся аутоиммунными нарушениями и способное приводить к деструкции суставного хряща и кости, а также к системным воспалительным изменениям.
Патогенез заболевания весьма сложен и во многом недостаточно изучен. Несмотря на это, к настоящему времени хорошо известны некоторые ключевые моменты в развитии ревматоидного воспаления, которые определяют основные методы лечебного воздействия на него (рис. 1). Развитие хронического воспаления в данном случае связано с активацией и пролиферацией иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов), что сопровождается выделением клеточных медиаторов — цитокинов, факторов роста, молекул адгезии, а также синтезом аутоантител (например, антицитруллиновых антител) и формированием иммунных комплексов (ревматоидные факторы). Эти процессы ведут к формированию новых капиллярных сосудов (ангиогенез) и разрастанию соединительной ткани в синовиальной оболочке, к активации циклооксигеназы-2 (ЦОГ-2) с повышением синтеза простагландинов и развитием воспалительной реакции, к выделению протеолитических ферментов, активации остеокластов, а в результате — к деструкции нормальных тканей суставов и возникновению деформаций.
Лечение ревматоидного артрита
Исходя из патогенеза заболевания, становится очевидным, что эффективно воздействовать на развитие заболевания можно на двух уровнях:
Поскольку, помимо собственно воспаления, активация иммунной системы сопровождается многими другими патологическими процессами, воздействие на первом уровне является существенно более глубоким и эффективным, нежели на втором. Медикаментозная иммуносупрессия представляет собой основу лечения ревматоидного артрита. К иммуносупрессорам, применяющимся для лечения данного заболевания, относятся базисные противовоспалительные препараты (БПВП), биологические препараты и глюкокортикостероиды. На втором уровне действуют нестероидные противовоспалительные препараты (НПВП) и глюкокортикостероиды.
В целом иммуносупрессивная терапия сопровождается более медленным развитием клинического эффекта (в широких рамках — от нескольких дней в случае биологической терапии до нескольких месяцев в случае применения некоторых БПВП), который в то же время бывает очень выраженным (вплоть до развития клинической ремиссии) и стойким, а также характеризуется торможением деструкции суставов.
Собственно противовоспалительная терапия (НПВП) может давать клинический эффект (обезболивание, уменьшение скованности) очень быстро — в течение 1–2 ч, однако при помощи такого лечения практически невозможно полностью купировать симптоматику при активном ревматоидном артрите и, по-видимому, оно совсем не влияет на развитие деструктивных процессов в тканях.
Глюкокортикостероиды обладают как иммуносупрессивным, так и непосредственным противовоспалительным эффектом, поэтому клиническое улучшение может развиваться быстро (в течение нескольких часов при внутривенном или внутрисуставном введении). Имеются данные о подавлении прогрессирования эрозивного процесса в суставах при длительной терапии низкими дозами глюкокортикостероидов и о положительном их влиянии на функциональный статус больного. В то же время из практики хорошо известно, что назначение только глюкокортикостероидов, без других иммуносупрессивных средств (БПВП), редко дает возможность достаточно эффективно контролировать течение болезни.
Немедикаментозные способы терапии ревматоидного артрита (физиотерапия, бальнеотерапия, диетотерапия, акупунктура и др.) представляют собой дополнительные методики, с помощью которых можно несколько улучшить самочувствие и функциональный статус пациента, но не купировать симптоматику и достоверно повлиять на деструкцию суставов.
Ортопедическое лечение, включающее ортезирование и хирургическую коррекцию деформаций суставов, а также реабилитационные мероприятия (лечебная физкультура и др.) имеют особое значение преимущественно на поздних стадиях заболевания для поддержания функциональной способности и улучшения качества жизни больного.
Основными целями лечения при РА являются [2, 6]:
Надо иметь в виду, что цели лечения могут существенно изменяться в зависимости от длительности болезни. На ранней стадии болезни, т. е. при длительности болезни 6–12 мес, достижение клинической ремиссии — вполне реальная задача, так же как и торможение развития эрозий в суставах. С помощью современных методов активной медикаментозной терапии удается добиться ремиссии у 40–50% пациентов [4, 5], показано также отсутствие появления новых эрозий по данным рентгенографии [7] и магнитно-резонансной томографии [8] у значительного количества больных при длительности наблюдения 1–2 года.
При длительно текущем ревматоидном артрите, особенно при недостаточно активной терапии в первые годы заболевания, достижение полной ремиссии теоретически тоже возможно, однако вероятность этого значительно ниже. То же самое можно сказать и о возможности остановить прогрессирование деструкции в суставах, уже существенно разрушенных за несколько лет болезни. Поэтому при далеко зашедшем ревматоидном артрите возрастает роль реабилитационных мероприятий, ортопедической хирургии. Кроме того, на поздних стадиях заболевания длительная поддерживающая базисная терапия может использоваться для вторичной профилактики осложнений болезни, таких как системные проявления (васкулит и др.), вторичный амилоидоз.
Базисная терапия ревматоидного артрита. БПВП (синонимы: базисные препараты, болезнь-модифицирующие антиревматические препараты, медленно действующие препараты) являются главным компонентом лечения ревматоидного артрита и при отсутствии противопоказаний должны быть назначены каждому пациенту с этим диагнозом [9]. Особенно важно максимально быстрое назначение БПВП (сразу после установления диагноза) на ранней стадии, когда имеется ограниченный период времени (несколько месяцев от появления симптоматики) для достижения наилучших отдаленных результатов — так называемое «терапевтическое окно» [10].
Классические БПВП обладают следующими свойствами.
БПВП существенно различаются между собой по механизму действия и особенностям применения. Основные параметры, характеризующие БПВП, представлены в таблице 1.
БПВП условно могут быть подразделены на препараты первого и второго ряда. Препараты первого ряда обладают наилучшим соотношением эффективности (достоверно подавляют как клиническую симптоматику, так и прогрессирование эрозивного процесса в суставах) и переносимости, в связи с чем назначаются большинству пациентов.
К БПВП первого ряда относятся следующие.
БПВП второго ряда применяются значительно реже в связи с меньшей клинической эффективностью и/или большей токсичностью. Они назначаются, как правило, при неэффективности или непереносимости БПВП первого ряда.
БПВП способны вызвать значительное улучшение (хороший клинический ответ) приблизительно у 60% пациентов. В связи с медленным развитием клинического эффекта назначение БПВП на сроки менее 6 мес не рекомендуется. Длительность лечения определяется индивидуально, типичная продолжительность «курса» лечения одним препаратом (в случае удовлетворительного ответа на терапию) составляет 2–3 года и более. Большинство клинических рекомендаций подразумевают неопределенно долгое применение поддерживающих дозировок БПВП для сохранения достигнутого улучшения.
При недостаточной эффективности монотерапии каким-либо базисным препаратом может быть избрана схема комбинированной базисной терапии, т. е. сочетания двух-трех БПВП. Наиболее хорошо зарекомендовали себя следующие сочетания:
В комбинированных схемах препараты обычно применяются в средних дозировках. В ряде клинических исследований было продемонстрировано превосходство комбинированной базисной терапии над монотерапией, однако более высокая эффективность комбинированных схем не считается строго доказанной. Комбинация БПВП ассоциирована с умеренным повышением частоты побочных эффектов.
Биологические препараты в лечении ревматоидного артрита. Термин биологические препараты (от англ. biologics) применяется по отношению к лекарственным средствам, производимым с использованием биотехнологий и осуществляющим целенаправленное («точечное») блокирование ключевых моментов воспаления с помощью антител или растворимых рецепторов к цитокинам, а также другим биологически активным молекулам. Таким образом, биологические препараты не имеют никакого отношения к «биологически активным пищевым добавкам». В связи с большим количеством «молекул-мишеней», воздействие на которые потенциально может подавлять иммунное воспаление, разработан целый ряд лекарственных средств из этой группы и еще несколько препаратов проходят клинические испытания.
К основным зарегистрированным в мире для лечения ревматоидного артрита биологическим препаратам относятся:
Для биологических препаратов характерны выраженный клинический эффект и достоверно доказанное торможение деструкции суставов. Эти признаки позволяют относить биологические препараты к группе БПВП. В то же время особенностью группы является быстрое (нередко в течение нескольких дней) развитие яркого улучшения, что объединяет биологическую терапию с методами интенсивной терапии. Характерная черта биологических средств — потенцирование эффекта в сочетании с БПВП, в первую очередь с метотрексатом. В связи с высокой эффективностью при ревматоидном артрите, в том числе у резистентных к обычной терапии пациентов, в настоящее время биологическая терапия выдвинулась на второе по значимости место (после БПВП) в лечении этого заболевания.
К отрицательным сторонам биологической терапии относятся:
Биологические методы терапии показаны, если лечение препаратами из группы БПВП (такими, как метотрексат) не является адекватным вследствие недостаточной эффективности или неудовлетворительной переносимости.
Одной из наиболее важных молекул-мишеней служит ФНО-a, который имеет множество провоспалительных биологических эффектов и способствуют персистенции воспалительного процесса в синовиальной оболочке, деструкции хряща и костной ткани за счет прямого действия на синовиальные фибробласты, хондроциты и остеокласты. Блокаторы ФНО-α являются наиболее широко применяемыми биологическими средствами в мире.
В России зарегистрирован препарат из этой группы инфликсимаб (ремикейд), представляющий собой химерное моноклональное антитело к ФНО-α. Препарат, как правило, назначается в сочетании с метотрексатом. У пациентов с недостаточной эффективностью терапии средними и высокими дозами метотрексата инфликсимаб существенно улучшает ответ на лечение и функциональные показатели, а также приводит к выраженному торможению прогрессирования сужения суставной щели и развития эрозивного процесса.
Показанием к назначению инфликсимаба в комбинации с метотрексатом является неэффективность одного или более БПВП, применявшихся в полной дозе (в первую очередь метотрексата), с сохранением высокой воспалительной активности (пять и более припухших суставов, скорость оседания эритроцитов (СОЭ) более 30 мм/ч, С-реактивный белок (СРБ) более 20 мг/л). При раннем ревматоидном артрите с высокой воспалительной активностью и быстрым нарастанием структурных нарушений в суставах комбинированная терапия метотрексатом и инфликсимабом может быть назначена сразу.
До назначения инфликсимаба требуется провести скрининговое обследование на туберкулез (рентгенография грудной клетки, туберкулиновая проба). Рекомендуемая схема применения: начальная доза 3 мг/кг массы тела больного в/в капельно, затем по 3 мг/кг массы тела через 2, 6 и 8 нед, далее по 3 мг/кг массы тела каждые 8 нед, при недостаточной эффективности доза может повышаться вплоть до 10 мг/кг массы тела. Длительность лечения определяется индивидуально, обычно не менее 1 года. После отмены инфликсимаба поддерживающая терапия метотрексатом продолжается. Следует иметь в виду, что повторное назначение инфликсимаба после окончания курса лечения этим препаратом ассоциировано с повышенной вероятностью реакций гиперчувствительности замедленного типа.
Вторым зарегистрированным в нашей стране препаратом для проведения биологической терапии является ритуксимаб (мабтера). Действие ритуксимаба направлено на подавление В-лимфоцитов, которые не только являются ключевыми клетками, отвечающими за синтез аутоантител, но и выполняют важные регуляторные функции на ранних стадиях иммунных реакций. Препарат обладает выраженной клинической эффективностью, в том числе у больных, недостаточно отвечающих на терапию инфликсимабом.
Для лечения ревматоидного артрита препарат применяется в дозе 2000 мг на курс (две инфузии по 1000 мг, каждая с промежутком в 2 нед). Ритуксимаб вводится внутривенно медленно, рекомендуется проведение инфузии в условиях стационара с возможностью точного контроля за скоростью введения. Для профилактики инфузионных реакций целесообразно предварительное введение метилпреднизолона 100 мг. При необходимости возможно проведение повторного курса инфузий ритуксимаба через 6–12 мес.
Согласно европейским клиническим рекомендациям, ритуксимаб целесообразно назначать в случаях неэффективности или невозможности проведения терапии инфликсимабом. Возможность применения ритуксимаба в качестве первого биологического препарата служит в настоящее время предметом исследований.
Глюкокортикостероиды. Глюкокортикостероиды обладают многогранным противовоспалительным действием, обусловленным блокадой синтеза провоспалительных цитокинов и простагландинов, а также торможением пролиферации за счет воздействия на генетический аппарат клеток. Глюкокортикостероиды оказывают быстрый и ярко выраженный дозозависимый эффект в отношении клинических и лабораторных проявлений воспаления. Применение глюкокортикостероидов чревато развитием нежелательных реакций, частота которых также повышается с увеличением дозы препарата (стероидный остеопороз, медикаментозный синдром Иценко–Кушинга, поражение слизистой ЖКТ). Эти препараты сами по себе в большинстве случаев не могут обеспечить полноценного контроля над течением ревматоидного артрита и должны назначаться вместе с БПВП.
Глюкокортикостероиды при данном заболевании применяются системно и локально. Для системного применения показан основной метод лечения — назначение низких доз внутрь (преднизолон — до 10 мг/сут, метилпреднизолон — до 8 мг/сут) на длительный период при высокой воспалительной активности, полиартикулярном поражении, недостаточной эффективности БПВП.
Средние и высокие дозы глюкокортикостероидов внутрь (15 мг/сут и более, обычно 30–40 мг/сут в пересчете на преднизолон), а также пульс-терапия глюкокортикостероидами — внутривенное введение высоких доз метилпреднизолона (250–1000 мг) или дексаметазона (40–120 мг) могут применяться для лечения тяжелых системных проявлений ревматоидного артрита (выпотной серозит, гемолитическая анемия, кожный васкулит, лихорадка и др.), а также некоторых особых форм болезни. Продолжительность лечения определяется временем, необходимым для купирования симптоматики, и составляет обычно 4–6 нед, после чего осуществляется постепенное ступенчатое снижение дозы с переходом на лечение низкими дозами глюкокортикостероидов.
Глюкокортикостероиды в средних и высоких дозах, пульс-терапия, по-видимому, не обладают самостоятельным влиянием на течение ревматоидного артрита и развитие эрозивного процесса в суставах.
Для локальной терапии применяются препараты в микрокристаллической форме, назначающиеся в виде внутрисуставных и периартикулярных инъекций: бетаметазон, триамсинолон, метилпреднизолон, гидрокортизон.
Глюкокортикостероиды для локального применения обладают ярко выраженным противовоспалительным действием, преимущественно в месте введения, а в ряде случаев — и системным действием. Рекомендуемые суточные дозы составляют: 7 мг — для бетаметазона, 40 мг — для триамсинолона и метилпреднизолона, 125 мг — для гидрокортизона. Эта доза (суммарно) может использоваться для внутрисуставного введения в один крупный (коленный) сустав, два сустава среднего размера (локтевые, голеностопные и др.), 4–5 мелких суставов (пястно-фаланговые и др.), либо для периартикулярного введения препарата в 3–4 точки.
Эффект после однократного введения обычно наступает на протяжении 1–3 дней и сохраняется в течение 2–4 нед при хорошей переносимости.
В связи с этим повторные инъекции глюкокортикостероидов в один сустав нецелесообразно назначать ранее чем через 3–4 недели. Проведение курса из нескольких внутрисуставных инъекций в один и тот же сустав не имеет терапевтического смысла и чревато осложнениями (локальный остеопороз, усиление деструкции хряща, остеонекроз, нагноение). В связи с повышенным риском развития остеонекроза внутрисуставное введение глюкокортикостероидов в тазобедренный сустав в целом не рекомендуется.
Глюкокортикостероиды для локального применения назначаются в качестве дополнительного метода купирования обострений ревматоидного артрита и не могут служить заменой системной терапии.
НПВП. Значение НПВП в лечении ревматоидного артрита за последние годы существенно снизилось в связи с появлением новых эффективных схем патогенетической терапии. Противовоспалительное действие НПВП достигается с помощью подавления активности ЦОГ, или избирательно ЦОГ-2, и тем самым снижается синтез простагландинов. Таким образом НПВП действуют на конечное звено ревматоидного воспаления.
Действие НПВП при ревматоидном артрите — уменьшение выраженности симптомов болезни (боль, скованность, припухлость суставов). НПВП обладают обезболивающим, противовоспалительным, жаропонижающим эффектом, но мало влияют на лабораторные показатели воспаления. В подавляющем большинстве случаев НПВП не способны как-либо заметно изменить течение заболевания. Их назначение в качестве единственного противоревматического средства при достоверном диагнозе ревматоидный артрит в настоящее время считается ошибкой. Тем не менее НПВП являются основным средством симптоматической терапии при данном заболевании и в большинстве случаев назначаются в сочетании с БПВП.
Наряду с лечебным эффектом, все НПВП, включая селективные (ингибиторы ЦОГ-2), способны вызывать эрозивно-язвенное поражение ЖКТ (в первую очередь верхних его отделов — «НПВП-гастропатия») с возможными осложнениями (кровотечения, перфорации и пр.), а также нефротоксические и другие нежелательные реакции.
Основные характерные черты, которые необходимо учитывать при назначении НПВП, следующие.
Существует индивидуальная чувствительность к различным НПВП как в отношении эффективности, так и переносимости лечения. Дозы НПВП при ревматоидном артрите соответствуют стандартным. Продолжительность лечения НПВП определяется индивидуально и зависит от потребности больного в симптоматической терапии. При хорошем ответе на терапию БПВП препарат из группы НПВП может быть отменен.
К наиболее часто применяющимся при ревматоидном артрите НПВП относятся:
Селективные НПВП, по эффективности достоверно не отличаясь от неселективных, реже вызывают НПВП-гастропатии и серьезные нежелательные реакции со стороны ЖКТ, хотя и не исключают развитие этих осложнений. Ряд клинических исследований продемонстрировал повышенную вероятность развития тяжелой сосудистой патологии (инфаркт миокарда, инсульт) у пациентов, получавших препараты из группы коксибов, в связи с чем возможность лечения целекоксибом должна обсуждаться с особой осторожностью у больных с ИБС и другими серьезными кардиоваскулярными патологиями.
Дополнительные медикаментозные методы лечения. В качестве симптоматического анальгетика (или дополнительного анальгетика при недостаточной эффективности НПВП) может использоваться парацетамол (ацетаминофен) в дозе 500–1500 мг/сут, который обладает относительно невысокой токсичностью. Для локальной симптоматической терапии используются НПВП в виде гелей и мазей, а также диметилсульфоксид в виде 30–50% водного раствора в форме аппликаций. При наличии остеопороза показано соответствующее лечение препаратами кальция, витамина Д3, бифосфонатами, кальцитонином.
Общие принципы ведения больных РА
Больному с установленным диагнозом ревматоидный артрит должен быть назначен препарат из группы БПВП, который при хорошем клиническом эффекте может применяться как единственный метод терапии [9]. Другие лечебные средства используются по мере необходимости.
Больной должен быть информирован о характере своего заболевания, течении, прогнозе, необходимости длительного сложного лечения, а также о возможных нежелательных реакциях и схеме контроля за лечением, неблагоприятных сочетаниях с другими препаратами (в частности, алкоголем), возможной активации очагов хронической инфекции на фоне лечения, целесообразности временной отмены иммуносупрессивных препаратов при возникновении острых инфекционных заболеваний, о необходимости контрацепции на фоне лечения.
Терапия ревматоидного артрита должна назначаться врачом-ревматологом и проводиться под его наблюдением. Лечение биологическими препаратами может проводиться только под контролем ревматолога, имеющего достаточные знания и опыт для его проведения. Терапия является длительной и подразумевает периодический контроль активности болезни и оценку ответа на терапию. Упрощенный алгоритм представлен на рисунке 2.
Мониторинг активности болезни и ответа на терапию включает оценку показателей суставного статуса (число болезненных и припухших суставов и др.), острофазовых показателей крови (СОЭ, СРБ), оценку боли и активности болезни по визуальной аналоговой шкале, оценку функциональной активности больного в повседневной деятельности с помощью русского варианта опросника состояния здоровья (HAQ). Существуют признанные международным сообществом ревматологов методики количественной оценки ответа на лечение с помощью рекомендованного Европейской лигой по борьбе с ревматизмом (EULAR) индекса DAS (Disease Activity Score) и критериев Американской коллегии ревматологов (ACR) [1]. Кроме того, должен осуществляться мониторинг безопасности проводимой пациенту терапии (в соответствии и формуляром и существующими клиническими рекомендациями). В связи с тем, что эрозивный процесс может развиваться даже при низкой воспалительной активности, помимо оценки активности болезни и ответа на терапию обязательно применяется рентгенография суставов. Прогрессирование деструктивных изменений в суставах оценивают путем стандартной рентгенографии кистей и стоп с использованием рентгенологической классификации стадий ревматоидного артрита, количественных методик по индексам Sharp и Larsen. С целью мониторинга состояния больного обследование рекомендуется проводить с определенной периодичностью (табл. 2).
Лечение резистентного к терапии РА
Резистентным к лечению целесообразно считать пациента с неэффективностью (отсутствием 20% улучшения по основным показателям) как минимум двух стандартных БПВП в достаточно высоких дозах (метотрексат — 15–20 мг/нед, сульфасалазин — 2000 мг/сут, лефлуномид — 20 мг/сут). Неэффективность может быть первичной и вторичной (возникающей после периода удовлетворительного ответа на терапию либо при повторном назначении препарата). Существуют следующие пути преодоления резистентности к терапии:
С точки зрения отдаленных результатов в отношении функциональных нарушений, качества жизни и ее продолжительности оптимальной стратегией терапии ревматоидного артрита является многолетнее лечение БПВП с планомерной сменой схемы их применения по мере необходимости [11].
Литература
Д. Е. Каратеев, доктор медицинских наук
Институт ревматологии РАМН, Москва

