что такое рекомбинантная векторная вакцина
Что такое рекомбинантная векторная вакцина
В генетическом разнообразии вирусов в природе, особенно корона-, флави-и тогавирусов, важную роль играет рекомбинация. Она может происходить не только между близкородственными, но и отдаленно родственными вирусами.
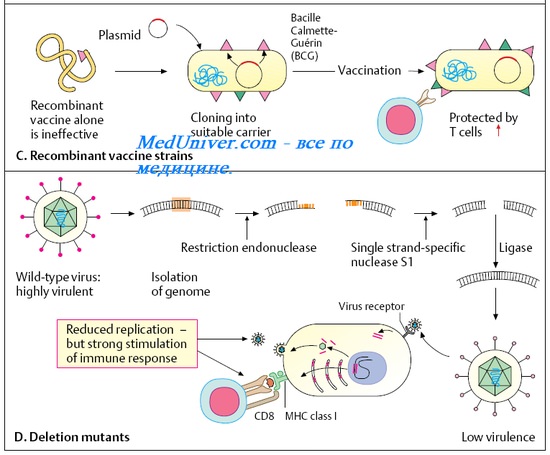
Важным достижением технологии рекомбинантной ДНК явилось открытие возможности замены удаленного гена чужеродным геном. Этот метод использует вирусы как векторы для переноса генов протективных антигенов других вирусов. В геном авирулентного вируса вставляют ген интересующего вируса, кодирующий антиген, вызывающий протективный ответ в привитом организме.
Модифицированный таким образом авирулентный вирус используют как живую вирусную вакцину. Клетки, в которых векторный вирус реплицируется in vivo, экспрессируют чужеродный белок, вызывающий гуморальный и опосредованный клетками иммунный ответ на данный белок.
Вирусные химеры, как вакцины с репликативным механизмом одного вируса и протективными антигенами другого, являются быстрой формой векторных вакцин. Прообразом таких вакцин можно считать реассортантные вакцины.
Вирус осповакцины был одним из первых вирусов, на примере которого была показана возможность такой замены без потери жизнеспособности рекомби-нантного вируса с экспрессией белка, кодируемого чужеродным геном и индукцией иммунитета на этот белок. Подход к получению безопасной эффективной живой вакцины заключается в использовании стабильного вакцинного вирусного штамма для создания рекомбинантов, которые экспрессируют протективные антигены других вирусов, против которых желательно создать иммунитет. Члены семейства вирусов оспы оказались удобными для получения рекомбинантных гибридов, благодаря их большому геному, позволяющему удалять значительные участки ДНК без потери способности к репликации.
Гены, кодирующие различные антигены многих вирусов, были включены в геном вируса осповакцины. Прививка животных этими рекомбинантными векторными вакцинами каждый раз сопровождалась хорошим антительным ответом. Например, вирус осповакцины, использованный в качестве вектора вакцины против бешенства, будучи включенным в приманку для скармливания, защищал лис и хорьков от бешенства. Возможность включения нескольких генов, кодирующих соответствующие иммуногены, позволяет создать новый тип комбинированных (поливалентных) вакцин.
Потенциальными векторами являются многие ДНК-содержащие вирусы, реплицирующиеся в ядре или цитоплазме. Первые во многих случаях могут быть интегрированы в клеточную ДНК, что может привести к персистенции вируса и клеточной трансформации. Этот факт — хороший аргумент в пользу выбора «цитоплазматических» вирусов, таких как вирусы оспы, которые являются наиболее крупными вирусами животных.
Участок генома вирусов оспы, кодирующий тимидинкиназу, не является геномом, функция которого жизненно необходима для размножения вируса, и его можно заменять на чужеродные ДНК.
Чужеродные белки, экспрессирующиеся рекомбинантным вирусом оспы, сохраняют свои антигенные свойства и способность формировать вирионную структуру.
Использование этого вируса в качестве вектора для вакцинации имеет ряд преимуществ: способность размножаться в клетках многих видов животных, экспрессировать несколько генов, индуцировать гуморальный и опосредованный клетками иммунитет, термостабильность, экономичность производства и легкость применения.
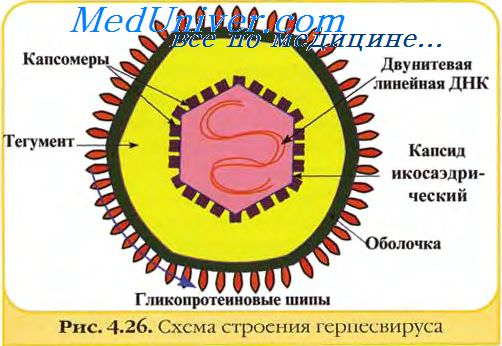
В качестве векторов для создания живых рекомбинантных вакцин могут быть использованы адено-, бакуло- и герпесвирусы. Они, как и вирусы оспы, имеют крупный геном, — по крайней мере с одной несущественной областью для репликации и несколькими участками, в которые могут быть встроены чужеродные гены и экспрессированы без потери инфекционности. В качестве векторов успешно используют вирусы оспы птиц.
Рекомбинантные живые вакцины по существу сочетают в себе свойства живых и компонентных вакцин. Проблема использования вектора живых вакцин в основном аналогична. Основное различие с живыми вакцинами заключается в том, что экспрессируется только один или несколько селективных генов, репли-цируемых вместе с геномом вектора. В этом смысле, данные вакцины похожи на традиционные субъединичные (компонентные), но отличаются от них лишь тем, что являются «реплицирующимися антигенами».
Рекомбинантные векторные вакцины как бы сочетают в себе положительные качества живых и инактивированных вакцин. При репликации в организме рекомбинантного вируса с встроенным чужеродным геном, кодирующим синтез гликопротеина, который может быть экспрессирован на поверхности клеток и может индуцировать развитие как гуморального, так и клеточного иммунного ответа. Субъединичные вакцины могут индуцировать развитие только гуморального иммунного ответа.
Что такое рекомбинантная векторная вакцина
Генно-инженерные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета (более подробно см. главу 7). Возможны несколько вариантов создания генно-инженерных вакцин.
• Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы.
• Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением Аг и его использованием в качестве иммуногена.
• Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин.
Ряд современных противовирусных вакцин сконструирован путём введения генов, кодируюших основные Аг патогенных вирусов и бактерий в геном вируса осповакцины (HBsAg вируса гепатита В) и непатогенных для человека сальмонелл (HBsAg вируса гепатита В и Аг токсина столбнячной палочки). Другим примером служит введение генов возбудителя туберкулёза в вакцинный штамм БЦЖ, что придаёт ему большую активность в качестве дивергентной вакцины. Такие препараты известны как векторные вакцины.
Для активной иммунопрофилактики гепатита В также предложена вакцина, представляющая собой HBsAg вируса. Его получают из дрожжевых клеток, в которые введён вирусный ген (в форме плазмиды), кодирующий синтез HBsAg. Препарат очищают от дрожжевых белков и используют для иммунизации. В качестве метода более быстрой и дешёвой наработки бактериальных экзотоксинов в настоящее время разработаны методы их получения при помощи неприхотливых микроорганизмов, в геном которых искусственно внесены гены токсинообразования (например, в виде плазмид).
Синтетические вакцины
Принцип конструирования вакцин включает синтез или выделение нуклеиновых кислот или полипептидных последовательностей, образующих Aг-детерминанты, распознаваемых нейтрализующими AT. Непременные компоненты таких вакцин — сам Аг, высокомолекулярный носитель (винилпирролидон или декстран) и адъювант (повышающий иммуногенность вакцин). Подобные препараты наиболее безопасны в плане возможных поствакцинальных осложнений, но их разработке мешают две проблемы. Во-первых, не всегда имеется информация об идентичности синтетических эпитопов естественным Аг. Во-вторых, низкомолекулярные синтетические пептиды обладают низкой иммуногенностью, что приводит к необходимости подбора соответствующих адъювантов.
С другой стороны, введение синтетических вакцин в комбинации с адъювантами и иммуномодуляторами перспективно у лиц с нарушениями иммунного статуса. Особые перспективы имеет использование нуклеиновых кислот для иммунопрофилактики инфекций, вызываемых внутриклеточными паразитами. В эксперименте показано, что иммунизация организма РНК и ДНК многих вирусов, малярийного плазмодия или возбудителя туберкулёза приводит к развитию стойкой невосприимчивости к заражению.
Различные типы вакцин против COVID-19
Данная статья входит в серию публикаций, посвященных разработке и распределению вакцин. Узнайте больше о вакцинах, о принципах их действия и о том, как обеспечивается их безопасность и справедливое распределение, в серии публикаций ВОЗ «Все о вакцинах».
По состоянию на декабрь 2020 г. разрабатывается более 200 вакцин-кандидатов против COVID-19. Из них по меньшей мере 52 вакцины-кандидата проходят исследования с участием людей. Несколько других вакцин в настоящее время находятся на этапах I/II и в ближайшие месяцы перейдут на этап III (для получения дополнительной информации об этапах клинических исследований см. третью часть нашего обзора Как разрабатывают вакцины?).
Зачем разрабатывать так много вакцин?
Как правило, все многочисленные вакцины-кандидаты, прежде чем какие-либо из них будут признаны безопасными и эффективными, должны пройти тщательные клинические исследования. Например, из всех вакцин, которые исследуются в лабораториях и испытываются на лабораторных животных, достаточно эффективными и безопасными для того, чтобы перейти к их клиническим исследованиям с участием людей, будут признаны примерно семь из ста. Из вакцин, которые достигают стадии клинических исследований, успешной оказывается только одна из пяти. Наличие большого количества различных вакцин в разработке повышает вероятность того, что одна или несколько вакцин будут признаны безопасными и эффективными для иммунизации приоритетных групп населения.
Различные типы вакцин
Различают три основных подхода к разработке вакцин в зависимости от того, что используют для иммунизации: цельный вирус или бактерию; фрагменты микроорганизма, вызывающие иммунный ответ; только генетический материал, содержащий код для синтеза конкретных белков, а не цельный вирус.
Инактивированная вакцина
В первом способе создания вакцины используются болезнетворные вирус или бактерия, или очень похожие на них микроорганизмы, которые инактивируют (убивают) с помощью химических реагентов, тепла или радиации. Этот метод основывается на технологиях, которые, как было доказано, эффективно защищают человека, – они применяются для изготовления вакцин против гриппа и полиомиелита – и позволяет наладить достаточно масштабное производство вакцин.
Однако для его применения требуются специальные лабораторные помещения, в которых можно безопасно выращивать вирус или бактерию, цикл производства может быть относительно длительным, а для иммунизации, скорее всего, потребуется введение двух или трех доз.
Живая ослабленная вакцина
В живой вакцине используется ослабленный или очень похожий вирус. Примеры вакцин этого типа – вакцина против кори, эпидемического паротита и краснухи (КПК) и вакцина против ветряной оспы и опоясывающего лишая. В этом способе используется технология, аналогичная получению инактивированной вакцины, и он может применяться для массового производства. Однако вакцины этого типа могут оказаться неприемлемыми для людей с ослабленной иммунной системой.
Вирусная векторная вакцина
В этом виде вакцины используется безопасный вирус, который доставляет специфические субэлементы (белки) соответствующего микроорганизма, благодаря чему вакцина способна активировать иммунный ответ, не вызывая болезни. С этой целью в безопасный вирус вводится код для формирования определенных частей соответствующего патогена. Такой безопасный вирус затем используется в качестве платформы или вектора для доставки в клетки организма белка, который активирует иммунный ответ. Примером этого типа вакцин, которые могут быть разработаны в короткие сроки, является вакцина против Эболы.
Субъединичные вакцины
В субъединичных вакцинах используются только специфические фрагменты (субъединицы) вируса или бактерии, которые иммунная система должна распознать. Они не содержат цельных микроорганизмов или безопасных вирусов в качестве вектора. В качестве субъединиц могут использоваться белки или сахара. Большинство вакцин, применяемых в календаре детских прививок, являются субъединичными и защищают от таких болезней, как коклюш, столбняк, дифтерия и менингококковый менингит.
Вакцины на основе генетического материала (нуклеиновых кислот)
В отличие от вакцин на основе ослабленных или нежизнеспособных цельных микроорганизмов или их фрагментов, в вакцине на основе нуклеиновых кислот используется участок генетической структуры, содержащий программу для генерации специфических белков, а не цельный микроорганизм. ДНК и РНК содержат код, который используется клетками нашего организма для выработки белков. При этом ДНК сначала превращается в информационную РНК, которая затем используется в качестве программы для продуцирования специфических белков.
Вакцина на основе нуклеиновой кислоты доставляет в клетки нашего организма определенный набор инструкций в виде ДНК или мРНК, побуждая их синтезировать нужный специфический белок, который иммунная система нашего организма должна распознать и дать на него иммунный ответ.
Технология с использованием генетического материала представляет собой новый способ получения вакцин. До пандемии COVID-19 ни одна из них еще не прошла через все стадии процесса одобрения для введения людям, хотя некоторые ДНК-вакцины, в том числе для определенных видов рака, проходили исследования с участием людей. Из-за пандемии исследования в этой области продвигались очень быстро, и на некоторые вакцины против COVID-19 на основе мРНК выдаются разрешения для использования в чрезвычайных ситуациях; а это означает, что теперь они могут вводиться людям, а не только использоваться в клинических исследованиях.
Какими бывают вакцины от COVID-19 и как они защищают нас от инфекции, «Доктору Питеру» рассказала заместитель управляющего по качеству НИЦ «Эко-безопасность», инфекционист, клинический фармаколог Гульнара Ислямовна Сыраева.
Такой разный иммунитет
Смысл любой вакцинации – так или иначе воздействовать на иммунную систему. Изначально понятие «иммунитет» подразумевало только способность организма противостоять внешним инородным агентам: бактериям, вирусам, простейшим. Потом оно стало шире. В современном понимании – это сложная, многогранная система, которая направлена в том числе на поддержание внутренней целостности и слаженной работы организма. В свое время Илья Мечников и Пауль Эрлих получили Нобелевскую премию за открытие иммунитета. Мечников разработал теорию клеточного иммунитета, Эрлих — гуморального. На момент своих разработок ученые друг друга критиковали, но в итоге жизнь показала, что они оба были правы. На сегодня две их теории не исключают, а дополняют друг друга. За клеточный иммунитет отвечают так называемые Т-клетки, которые поглощают чужеродные микроорганизмы, а также презентируют их — они носят на себе их фрагменты и показывают другим клеткам, после чего запускается выработка антител — специальных белковых комплексов в крови (иммуноглобулины IgА, IgМ, IgG), которые нейтрализуют и поглощают чужеродные микроорганизмы. Антитела отвечают за гуморальный иммунитет.
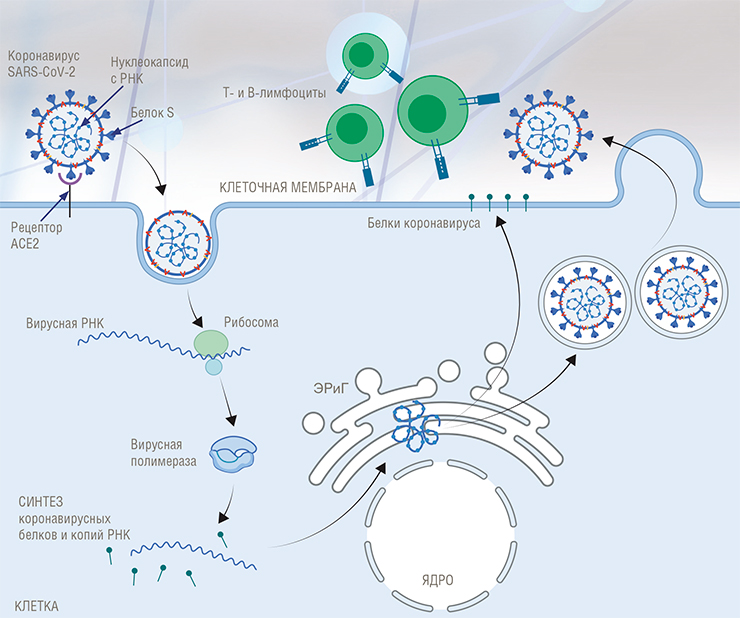
Любое вещество, которое организм человека воспринимает как чужеродное и потенциально опасное для себя, называется антигеном. Новый коронавирус SARS-CoV-2 относится к РНК-содержащим вирусам, и антигеном может быть как внутренняя его часть (нуклеиновые кислоты), так и внешняя (поверхностная оболочка, которая представлена сложными полипептидами – белками).
Помимо того, что иммунитет бывает клеточным и гуморальным, он подразделяется еще на естественный или искусственный.
Естественный иммунитет, в свою очередь, бывает врожденным (как выяснилось, у человека нет врожденного, генетически обусловленного иммунитета к новой коронавирусной инфекции) или приобретенным (он формируется после перенесенной болезни, в некоторых случаях даже на всю жизнь, как после ветрянки).
Искусственный иммунитет бывает активным и пассивным. Если человек уже болеет, у него вырабатываются антитела, но их недостаточно для выздоровления, тогда речь идет о необходимости пассивного иммунитета. Это не что иное, как переливание плазмы крови уже переболевших. Так происходит, например, при заражении клещевым энцефалитом: человеку в течение 72 часов вводят специальные противоклещевые иммуноглобулины. Вакцинация помогает создать активный искусственный иммунитет. Мы вводим человеку вакцину, в которой есть антигены, — на них организм начинает формировать иммунный ответ, но при этом они не вызывают заболевания.
В зависимости от использованных антигенов и принципа создания вакцины делятся на несколько видов. Расскажу об основных из них.
Векторные рекомбинантные вакцины. «Спутник V», «Конвидеция»
К плюсам векторных вакцин можно отнести высокую иммуногенность — при их введении формируется достаточно высокий титр защитных антител. По сути, это самые современные технологии создания вакцин — генная инженерия в чистом виде. Но как раз в ее новизне кроется и минус — они применялись на небольшом проценте популяции и еще мало изучены. Мы пока не можем говорить о долгоиграющих перспективах — сформируется ли пожизненный иммунитет? Или что будет, если вирус мутирует и ген, который использовали в создании вакцины, «в природе» немного изменит свою кодировку — состыкуется ли с ним антительный ответ после вакцинации? Кроме того, при введении такой вакцины организм может также отреагировать на вирус-вектор, что помешает главной цели – формированию стойкого иммунитета против целевого вируса. Именно поэтому для вектора важно выбрать оптимальный вариант — тот, на который реакция организма будет минимальной.
К векторным относится первая российская вакцина против коронавируса «Спутник V», разработанная НИЦ эпидемиологии и микробиологии им. Гамалеи. Разработчики «Спутник V» встроили ген, кодирующий информацию о структуре S-белка шипа коронавируса — он формирует всем известную «корону» и отвечает за связывание вируса с клетками человека. В качестве вектора они использовали давно и хорошо изученный аденовирус, который вызывает сезонную ОРВИ. Над векторными вакцинами трудятся и другие разработчики. В частности, регистрируемая китайская вакцина «Конвидеция» тоже векторная и тоже на основе аденовируса. Заявку на ее регистрацию подала биофармацевтическая компания «Петровакс» (входит в холдинг «Интеррос» Владимира Потанина). Сейчас она проходит 3-ю фазу клинического исследования, в которой только наш центр задействует 300 добровольцев из Петербурга.
До «Спутника V» в России в широкой клинической практике векторные вакцины не применялись. В 2015 году была зарегистрирована подобная вакцина против лихорадки Эбола, разработанная тем же Центром им. Гамалеи. Векторная вакцина против другой разновидности коронавируса – ближневосточного респираторного синдрома (MERS) – еще одна разработка Центра им. Гамалеи с использованием вектора на основе аденовируса, но она пока не зарегистрирована.
Есть еще одна разновидность генно-инженерных вакцин последнего поколения — на основе нуклеиновых кислот (ДНК- и РНК-вакцины). В них также используются модификации генетического материала, но, в отличие от векторных вакцин, этот материал синтезируют искусственно. Иначе говоря, собирают необходимую нуклеиновую последовательность в лаборатории и с ней работают. Это технология завтрашнего дня — пока в России нет ни одной такой вакцины, испытанной на людях.
Цельновирионные вакцины
На цельновирионных вакцинах человечество выросло — это классика. Для создания таких вакцин вирус используется целиком, а не какая-то его часть. Они бывают живыми ослабленными или инактивированными (в них вирус «убит» термически либо воздействием химических агентов, например, с помощью формалина или ацетона).
Для приготовления инактивированных вакцин используется большой спектр возбудителей — бактерий и вирусов. Такие вакцины защищают нас от бешенства (антирабическая), коклюша, гепатита А, гриппа, клещевого энцефалита, брюшного тифа.
Цельновирионную инактивированную вакцину против коронавируса, к примеру, разработал Научный центр им. Чумакова (по словам президента Путина, она уже «на подходе»). Сейчас она проходит стадию клинического исследования. 19 октября на базе научно-исследовательского центра «Эко-безопасность» стартовал второй этап — в нем участвуют 30 добровольцев. Чтобы «подхлестнуть» иммунитет и повысить уровень антител, вакцину вводят двукратно – с разницей в 10 дней. Кстати, дважды вводят и «Спутник V».
Для цельновирионных вакцин с живым, но ослабленным вирусом обычно достаточно одного введения. В них вирус сохраняет возможность размножаться в организме человека. Такие препараты нуждаются в регулярном изучении генетической стабильности, чтобы не вызвать заболевания при иммунизации. Бывают, к примеру, живые вакцины против кори, полиомиелита, гриппа, но их сейчас практически не применяют.
Субъединичные вакцины. «ЭпиВакКорона»
Такие препараты создаются на основе различных антигенных компонентов – субъединиц. Можно взять, к примеру, часть оболочки вируса — белки, которые отвечают за проникновение вируса в клетку. У коронавируса это S-белок. И хотя антитела при введении такой вакцины будут вырабатываться непосредственно на белок, уровень иммунного ответа и качество защитных антител, скорее всего, будет ниже, чем на векторную или цельновирионную вакцины. На целый вирус или кусочек генома вырабатываются более сложные по структуре антитела, чем на изолированный белок. Но надо понимать, что, говоря «белок», мы немного утрируем — там может использоваться много структур, включая поверхностную и внутреннюю мембрану, белки-носители и так далее.
В чем минусы таких вакцин? Поверхностный белок может со временем мутировать, и будет ли вакцина эффективна, скажем, через год — вопрос. Для усиления иммунного ответа в них так же, как и в цельвирионных, используются адъюванты. Плюс же в том, что субъединичные вакцины проще в производстве, чем, например, векторные.
К субъединичным относятся вакцины против пневмококковой и менингококковой инфекций, брюшного и сыпного тифа, холеры.
Вакцины на основе вирусоподобных частиц
Для производства этих вакцин берут пустую белковую оболочку вируса – без «нутра». Вирусоподобные частицы имитируют структуру вируса, но не содержат его генетического материала. В их состав также могут входить адъюванты и иммуностимуляторы.
Из плюсов. Они безопасны и способны вырабатывать высокий иммунный ответ, при этом эффективны даже в виде капель для носа – так они сразу активируют иммунитет слизистых оболочек, которые обычно становятся «входными воротами» для вирусов. В то же время такие вакцины технологически сложны для массового производства и требуют больших финансовых вложений. Опять же, даже при незначительной мутации вируса поверхностный белок может поменять свою конфигурацию, и тогда вакцина попросту может не сработать.
На сегодня такие вакцины созданы для профилактики гриппа, гепатита С.
Вакцинация без мифов
Человечеству не удалось справиться с распространением COVID-19 с помощью одних только противоэпидемических мер. Ученые считают, что пандемия не остановится до тех пор, пока большая часть населения планеты (более 80 %) не приобретет иммунитет к возбудителям этой инфекции, второй год циркулирующей в человеческой популяции. Добиться как личного, так и коллективного иммунитета можно двумя путями: либо переболеть, либо вакцинироваться. А учитывая, что риск умереть от этой болезни в случае тяжелого течения составляет примерно 1 к 30, то выбор очевиден. Тем более что за невероятно короткое время удалось создать много эффективно действующих вакцин, разработанных на самых разных технологических платформах
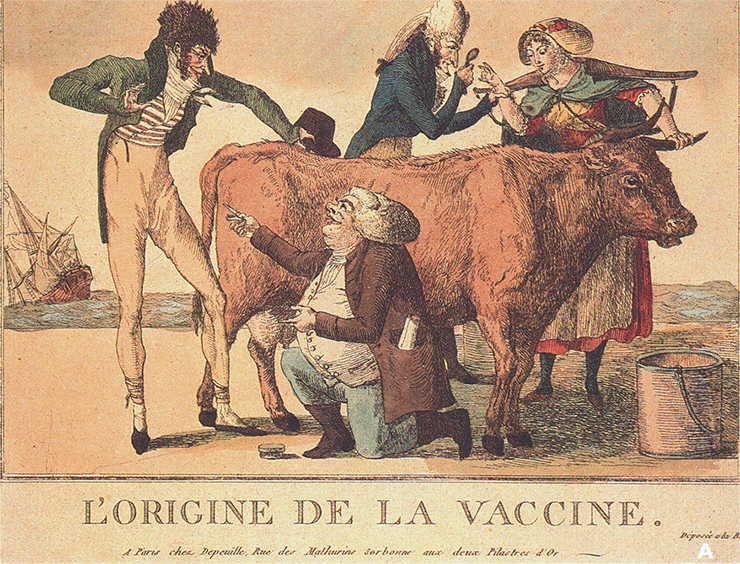
Считается, что история вакцин начинается с британского врача Эдварда Дженнера и французского микробиолога Луи Пастера – изобретателей живых и инактивированных вакцин. Однако на самом деле идея имитировать инфекцию в целях профилактики родилась более тысячи лет назад в Китае и Индии, где стали заражать здоровых людей возбудителем натуральной оспы. Риск умереть в результате такой процедуры был в 20–30 раз меньше, чем от спонтанной инфекции.
Заслуга же Дженнера состоит в том, что он предложил вакцинировать людей не возбудителем человеческой болезни, а подобным, но безопасным для них агентом, вызывающим коровью оспу. К этому решению врач пришел благодаря наблюдениям, что доярки не болеют оспой. После успешных экспериментов такая вакцинация стала общепризнанной. Утверждение появившихся уже тогда антивакцинаторов, что таким образом люди превратятся в коров, не смогло этому помешать.
Следующий шаг сделал спустя почти сотню лет Пастер, который предложил «убивать» или ослаблять возбудителя инфекции перед вакцинацией. А поскольку он был по образованию химиком, а не врачом, то ему противостояли, и довольно мощно, уже сами медики. Но разработанная им для крупного рогатого скота вакцина от сибирской язвы резко снизила заболеваемость и смертность животных и ухаживающих за ними людей, а прививка от бешенства спасла множество человеческих жизней в разных странах. И антивакцинаторы затихли.
Очередным прорывом в противовирусных вакцинных технологиях стало создание так называемых субъединичных белковых вакцин, которые содержат не весь вирус, а только его белки, необходимые для стимуляции иммунитета. Первая такая вакцина была разработана против вируса гепатита В, поскольку оказалось невозможным получить достаточное количество инактивированной вакцины против этой болезни.
В первой субъединичной белковой вакцине против гепатита В использовался оболочечный вирусный белок HBsAg, выделенный из плазмы хронически инфицированных доноров. Но очень скоро выяснилось, что необходимой для этого донорской крови не хватает. И вот в 1979 г. в США с помощью генной инженерии был впервые получен рекомбинантный белок HBsAg. Его продуцентами стали генно-модифицированные клетки дрожжей, в которые был встроен ген, кодирующий вирусный белок.
Новую технологию было легко масштабировать, а стоимость препарата была значительно меньше по сравнению с плазменной вакциной (которая к тому же могла содержать возбудителей и других болезней). Эта рекомбинантная белковая вакцина более пяти лет тестировалась FDA (Food and Drug Administration, USA) перед тем, как прийти на смену плазменной. Она защищает от заражения на срок не менее 30 лет, и сегодня ею прививают всех новорожденных практически во всех странах мира.
Применение генно-инженерных технологий для создания вакцин обернулось колоссальным успехом. Через 20 с лишним лет с использованием аналогичного подхода были разработаны вакцины против папилломавирусной инфекции, которые сейчас применяются в более чем 90 странах мира. Основные компоненты таких вакцин – поверхностные белки – нарабатывают в клетках эукариот, высших организмов с оформленным ядром, к которым относятся и дрожжи. Это связано с тем, что вирусные белки должны быть гликозилированы, чтобы сформировать правильную структуру и вызывать «правильный» иммунный ответ, а в клетках бактерий, которые чаще всего используют в биотехнологическом производстве, соответствующие механизмы отсутствуют.
Пандемия, вызванная коронавирусом SARS-CoV‑2, буквально всколыхнувшая весь мир в начале 2020 г., не оставила времени для размышлений. Стало ясно, что для того, чтобы максимально быстро получить вакцину, необходимы разработки сразу в нескольких направлениях.
Векторный транспорт

Инактивированные вакцины производятся по разным технологиям уже более ста лет, и фактически они представляют собой цельные вирусные частицы, но как бы «зашитые» химическими скрепками без возможности раскрыться. Поэтому в результате иммунизации антитела на их внутренние белки чаще всего не образуются. При грамотном производстве такие вакцины дают при введении минимум побочных реакций, но далеко не всегда – полноценный и долговременный иммунитет.
К примеру, так и не удалось получить эффективные инактивированные вакцины против паротита, ВИЧ-инфекции, гепатита С и вируса герпеса, а для вируса кори инактивированная вакцина оказалась очень дорогой. Что касается коронавируса SARS-CoV‑2, то эффективность инактивированных вакцин оказалась существенно ниже по сравнению с векторными и мРНК-вакцинами, о которых пойдет речь ниже (70–80 против 90–95 %). Так что минимум побочных реакций у вакцины – это хорошо, но более важна ее эффективность.
Уже несколько десятков лет у разработчиков вакцин были в запасе еще два новаторских подхода. Развивались они давно, но из-за консерватизма контролирующих органов до 2020 г. эти разработки оставались на стадии клинических испытаний.
Почему мы считаем COVID‑19 опаснее гриппа? Потому что смертность от гриппа в среднем составляет примерно 0,02 % от числа заболевших, а от новой коронавирусной инфекции она как минимум в 100 раз выше.
В целом данные по смертности от COVID‑19 очень разнятся для разных стран и разных периодов пандемии. С чем это связано? В Италии в 2020 г. на эту инфекцию списывали все смерти в больницах с положительным диагнозом на SARS-CoV‑2 – независимо от того, умирал пациент от дыхательной недостаточности или от других причин. В результате формально смертность от COVID‑19 составляла 6 %. В России же в 2020 г. «считали» наоборот, и реальная смертность занижалась.
Чтобы оценить действительную ситуацию со смертностью от COVID‑19, обратимся к официальным данным Департамента здравоохранения г. Москвы*. Так, с января по апрель 2020 г. смертность в Москве выросла на 3,7 % по сравнению с таким же периодом 2019 г. (42,8 и 41,3 тыс. человек соответственно). При этом наибольшая разница была в апреле – в разгар эпидемии.
В качестве причин более половины дополнительных смертей указаны болезни системы кровообращения (БСК). А виновником около четверти всех случаев «прибавочной» смертности оказался COVID‑19. Однако во многих случаях он же указывался в свидетельствах о смерти одновременно с теми же БСК. Очевидно, что именно коронавирус стал «катализатором» развития основного заболевания, и это относится к болезням не только сердечно-сосудистой, но и дыхательной системы.
Таким образом, реальная летальность от коронавируса в Москве за первые 4 месяца 2020 г. составила 2 % от официально заболевших, если брать во внимание лишь те случаи, где он являлся единственной причиной, и 3,8 % – если учитывать его в качестве не только основного, но и сопутствующего заболевания
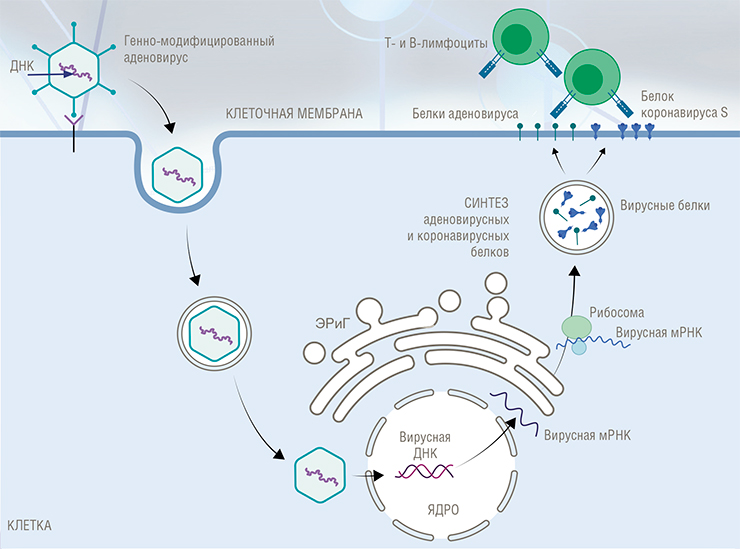
Во-первых, это векторные вакцины, работы над которым ведутся с 1980-х гг. В этом случае в генетический материал непатогенного вируса вставляют ген основного иммуногенного белка патогена, и этот «гибрид» (непатогенный и чаще всего неспособный размножаться в организме человека) используют для вакцинации.
Когда такой рекомбинантный вирус попадает в клетки, информация с вирусного генома «считывается» в виде матричной РНК, по которой в клетке синтезируются вирусные белки, включая тот самый встроенный иммуногенный белок патогена. Далее этот белок, как при обычной инфекции, встраивается в клеточную мембрану, имитируя ситуацию заражения организма инфекционным агентом, не утратившим способность к размножению. Организм реагирует на такой экспонированный на клетке белок формированием иммунного ответа.
В качестве векторов-переносчиков генов иммуногенных вирусных белков испытывались разные вирусы: осповакцины, кори, аденовирусы, везикулярного стоматита, желтой лихорадки, альфа- и флавивирусы и др. Еще до 2020 г. ряд таких кандидатных вакцин дошел до клинических испытаний 1—2-й фазы, показав свою перспективность, но дальше этого дело не пошло. Кстати сказать, в 1990-е гг. несколько кандидатных вакцин были разработаны в новосибирском ГНЦ вирусологии и биотехнологии «Вектор», но контролирующие органы тогдашнего российского Минздрава не пустили их дальше первых двух фаз клинических испытаний, мотивируя это тем, что таких вакцин раньше не было. Но ведь и до Пастера не было инактивированных вакцин!
Слово о «Спутнике»
Ярким примером векторных вакцин может служить российский «Спутник V»**. Эта двухкомпонентная вакцина сконструирована на основе двух разных серотипов человеческого аденовируса – 26 и 5. Для выработки иммунного ответа на коронавирус в геном каждого из штаммов были вставлены ДНК-копии гена, кодирующего основной коронавирусный белок оболочки S. Он вставлен таким образом, чтобы в инфицированных клетках синтезировалась матричная РНК, кодирующая именно этот белок.
Почему использовались два вектора-переносчика? Это связано с тем, что только живые аттенуированные (на основе ослабленных возбудителей) вакцины, да и то не все, обеспечивают хороший иммунный ответ после единственной инъекции. А инактивированные и субъединичные дают надежный иммунный ответ только после двух или трех инъекций. «Спутник V» сделан на основе двух серотипов аденовируса, чтобы сформировавшийся иммунитет к аденовирусным антигенам первой компоненты не мешал формированию усиленного иммунного ответа на вирусный белок при второй инъекции.
Еще одна особенность векторных вакцин, о которой уже упоминалось: сами вирусные носители не размножаются в организме человека. Для этого, к примеру, у аденовируса удаляют часть генов из области Е (так называемых ранних генов), отвечающей за его копирование и «маскировку» от иммунной системы. Такой дефектный вирус не может вызвать у вакцинированного аденовирусную инфекцию: он лишь некоторое время производит целевой продукт и часть своих белков, после чего погибает.
Поэтому и размножать его приходится в специальных клеточных культурах, в геномах которых имеются недостающие аденовирусные гены.
«Спутник V» зарегистрирован более чем в 60 странах мира и применяется, помимо России, в таких государствах, как Аргентина, Венгрия, Сан-Марино, Алжир и другие. В случае его регистрации в Европейском медицинском агентстве соответствующие сертификаты о вакцинации будут действовать и в странах ЕС.
Все применяемые ныне векторные вакцины, как и «Спутник V», создавались на базе аденовирусов. Вместе с тем шли работы и по созданию вакцин против COVID‑19 на основе вирусов кори, осповакцины, гриппа и других векторов, но большинство из них не показало хорошего защитного эффекта. Российский «Спутник V» по всем характеристикам сейчас считается одной из лучших векторных вакцин. И хотя поствакцинальные реакции на него довольно существенные, он формирует сильный иммунитет.
Как создается аденовирусная векторная вакцина? Из генома аденовируса вырезаются фрагменты (области E 1 и E 3), которые позволяют ему размножаться и обходить иммунную систему. Такой вирус называется нереплицирующимся, т. е. неспособным копировать сам себя. Далее на место гена E 1 встраивается искусственно синтезированный ген, кодирующий чужеродный белок-антиген. Получается конструкция, состоящая из неразмножающегося аденовируса, которая способна производить белки-мишени, но не способна скрыть свое присутствие в инфицированной клетке от внимания иммунной системы
Один из часто возникающих вопросов в отношении всех векторных вакцин: можно ли использовать их для ревакцинации, ведь в организме формируется иммунитет и против самих вирусных носителей? Точный ответ на него могут дать только результаты испытаний. Но согласно предварительным данным, такие вакцины можно применять для повторной вакцинации уже через полгода. И пусть с меньшей эффективностью, но зато и без существенных поствакцинальных реакций.
К середине 2021 г. для вакцинации стали применяться четыре векторных вакцины – все на основе разных дефектных аденовирусов с встроенным полным геномом поверхностного S-белка исходного варианта нынешнего коронавируса SARS-CoV‑2:
• «Спутник V» (Национальный исследовательский центр эпидемиологии и микробиологии Н. Ф. Гамалеи, Россия; носители – аденовирусы 26-го и 5-го серотипов; две инъекции через 21 день, эффективность 91,4 %);
• Вакцина Oxford/AstraZeneca (Великобритания и ЕС; носитель – аденовирус шимпанзе 26-го серотипа, две инъекции через 14 дней, эффективность 76 %);
• Вакцина Johnson&Johnson (США; носитель – аденовирус 26-го серотипа человека; одна инъекция, эффективность 64—73 % по данным испытаний в США, Южной Африке и Бразилии);
• Вакцина Convidecia (CanSino Biologics и Институт биологии Академии военных наук НОАК, Китай; носитель – аденовирус 5-го серотипа; 1 инъекция, эффективность 65,28 %)
Суть – в пузырьках
Помимо векторных вакцин, усилия ученых направлены на создание так называемых мРНК-вакцин. В случае их применения в организм попадает не генетический материал вирусов, а лишь матричная РНК – готовая основа для синтеза патогенного вирусного белка, который должен вызывать иммунный ответ. Для доставки в наши клетки такая мРНК «пакуется» в специально разработанные липидные пузырьки.
Результаты клинических испытаний вакцины «Спутник V» опубликованы в двух статьях во всемирно известном научном журнале The Lancet, который основан в 1823 г. и является вторым по цитируемости общемедицинским журналом мира после New England Journal of Medicine (Logunov, Dolzhikova, Zubkova et al., 2020; Logunov, Dolzhikova, Shcheblyakov et al., 2021). И хотя придирчивые читатели задали в комментариях к этим публикациям непростые вопросы, авторы на большинство из них достойно, на мой взгляд, ответили. А подобные дискуссии в этом журнале не редкость
Американская компания Moderna была основана десять лет назад для разработки именно этого типа вакцин. К 2020 г. она создала уже восемь кандидатных вакцин против целого ряда респираторных вирусных инфекций. Как минимум три из них еще несколько лет назад прошли первые фазы клинических испытаний на добровольцах.
Механизм работы вакцины, созданной в Moderna против SARS-CoV‑2, примерно такой же, как у векторных, только проще. Она состоит из липидных пузырьков, заполненных раствором, который содержит молекулы матричной РНК, кодирующей все тот же коронавирусный белок S. При введении в мышечную ткань эти пузырьки сливаются с мембраной клеток, и мРНК высвобождается. А далее все происходит, как описано выше для векторных вакцин. Иначе говоря, иммуногенная часть этой вакцины аналогична той, что и у применяющихся сейчас векторных.
Другую популярную мРНК-вакцину разработала крупнейшая американская транснациональная компания Pfizer совместно с небольшой германской фирмой BioNTech. Она действует по тому же принципу, однако ее мРНК сконструирована немного по-другому, имеются отличия и в составе липидных пузырьков.
Эти вакцины требуют ввода двух инъекций одним и тем же препаратом. Эффективность их весьма высока – более 90 %, и сейчас они – самые массовые в производстве и применении. Преимущества мРНК-вакцин очевидны. Во-первых, при их использовании в организме не возникает иммунных реакций на «сопутствующие» компоненты самой вакцины, как в случае векторных. Во-вторых, при необходимости разработки вакцины против другого возбудителя нужно просто заменить одну матричную РНК на другую.
Это очень перспективный подход к конструированию вакцин. Недостаток у подобных вакцин один: их надо хранить и перевозить при достаточно низких температурах. Правда, им страдает и ряд векторных вакцин.
Вакцина и организм
Общее воздействие на организм человека как векторных, так и мРНК-вакцин нетрудно оценить.
Как известно, в нашем организме примерно 30 трлн (30х10 12 ) клеток. В одной дозе векторной вакцины «Спутник V», согласно инструкции, 10 11 вирусных частиц. Таким образом, одна доза вакцины может, в принципе, заразить одну клетку из 300, т. е. 0,3 % от общего числа. Фактически эта цифра будет на один-два порядка меньше, потому что на одной эпителиальной клетке имеются десятки рецепторов для аденовируса. Заметим, что в случае инактивированных вакцин число вводимых в организм вирусных частиц имеет близкий порядок – 10–50 млрд, так что рассуждение о большем вреде векторных вакцин в сравнении с инактивированными не обосновано.
Что касается мРНК-вакцин, то на сайте компании Pfizer не указано количество молекул матричной РНК в дозе вакцины, поэтому нельзя оценить, сколько их попадает в организм в результате одной инъекции. Но, исходя из логических соображений, доля клеток, куда проникла молекула мРНК, вряд ли превышает такую же долю для аденовирусов в случае векторных вакцин.
У некоторых векторных аденовирусных вакцин против COVID‑19 была выявлена очень редкая побочная реакция в виде тромбообразования. В ряде случаев она привела даже к смертельным исходам, что вызвало серьезные беспокойства у населения. Такие осложнения были зафиксированы у 5–10 человек среди миллиона привитых вакциной Oxford/AstraZeneca и у 1–2 человек из миллиона привитых вакциной Johnson&Johnson, в которой используется в качестве носителя аденовирус 26-го серотипа, как и в первом компоненте «Спутника V». В отношении самого «Спутника V» подобной информации нет.
В нескольких препринтах, посвященных выяснению причин этих весьма серьезных осложнений, были выдвинуты три возможные причины: попадание основного содержимого шприца не в мышцу, а в крупный кровеносный сосуд; редкая генетическая особенность; повышенная свертываемость крови в день инъекции. Но все это пока рабочие гипотезы, которые проверяются. В любом случае вероятность этого осложнения при применении той же вакцины Johnson&Johnson сопоставима со смертью в собственной ванне – события, безусловно, крайне редкого.
Еще один вопрос, который иногда задают, касается феномена антителозависимого усиления инфекции. Как известно, обычно антитела способствуют фагоцитированию («заглатыванию») вируса иммунными клетками, что препятствует его размножению. Однако в некоторых случаях благодаря связыванию вирусной частицы с cубоптимальными антителами вирус после проникновения в иммунные клетки не деградирует, а, напротив, начитает активно размножаться. Это вызывает гибель иммунных клеток и, соответственно, усиление инфекции.
Такой феномен достоверно зафиксирован, к примеру, в отношении лихорадки денге: при перенесении человеком заболевания, вызванного одним из серотипов этого вируса, в случае заражения вирусом другого серотипа болезнь проходит намного тяжелее и доля смертельных случаев резко возрастает. То же самое наблюдалось при создании и применении первых вакцин против лихорадки денге, а также против малярии.
Предполагалось, что такое явление может наблюдаться и в случае коронавирусных инфекций, поэтому при разработке всех вакцин его учитывали и пытались отслеживать. К счастью, в случае COVID‑19 подобных осложнений до сих не выявлено, как при заболевании, так и при вакцинации (Halstead, Katzelnick, 2020).
Мир вакцинируется
Благодаря огромному «спросу» к 21 августа 2021 г. на стадии доклинических испытаний находилось уже 75 кандидатных вакцин. В клинических испытаниях на добровольцах участвовали 99 вакцинных препаратов, при этом треть из них – на завершающей, 3-й фазе. И уже больше десятка вакцин было в ряде стран разрешено для применения полностью либо ограниченно.
Все ведущие вакцины в мире до сих пор испытываются в рамках 3-й фазы клинических испытаний с участием десятков тысяч человек, которые закончатся не ранее осени 2021 г. Но если бы их не начали применять уже полгода назад, то число смертей от коронавирусной инфекции было бы в несколько раз больше.
Наиболее масштабно производятся мРНК-вакцина компании Pfizer и векторная вакцина компании Johnson&Johnson. В шестерку самых массовых вошли также китайские инактивированные вакцины Sinovac и Sinopharm, векторная вакцина компании AstraZeneca и мРНК-вакцина компании Moderna. Затем – с большим отрывом – идет отечественный «Спутник V».
К середине августа 2021 г. в мире было произведено более 4,8 млрд доз вакцин, причем доля России в этом производстве – менее 1,5 % (около 40 млн доз)***. Так как практически все вакцины требуют двукратной вакцинации, этого объема достаточно, чтобы в принципе защитить более 2,4 млрд человек.
При вакцинации зарубежными вакцинами ни в одном случае не требуется определение титров антител. Противопоказания минимальны: ими служат только тяжелая текущая инфекция и сильная аллергическая реакция на первый компонент вакцины. Наиболее безопасными на сегодняшний момент считаются инактивированные и мРНК-вакцины, которые можно использовать и для беременных женщин. А недавно была доказана безвредность для беременных женщин и некоторых векторных вакцин (Shimabukuro, Kim, Myers, 2021).
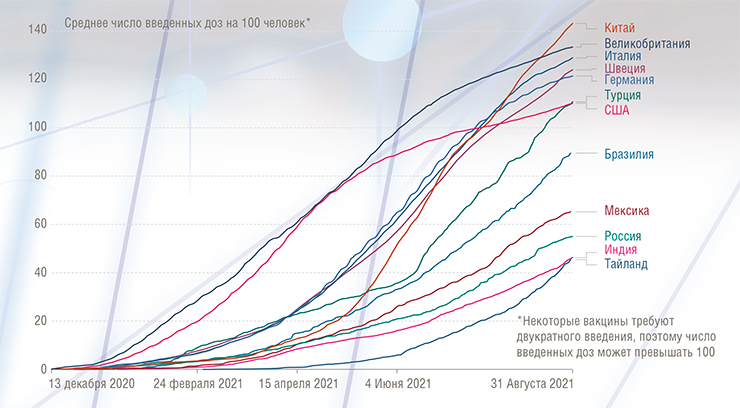
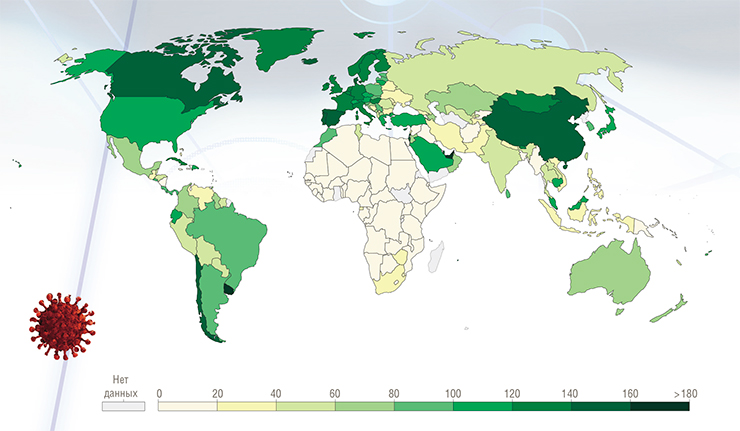
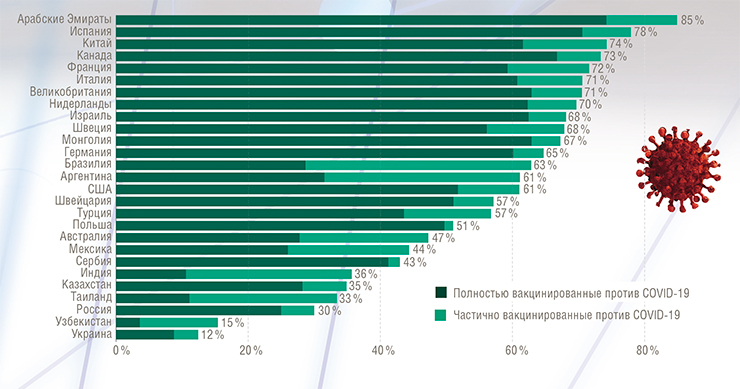
По степени охвата вакцинированием все государства можно разделить на группы. В первой группе окажутся те страны, где более половины населения получили хотя бы одну дозу вакцины, во второй – где было вакцинировано более 25 %. В России к середине августа хотя бы одну дозу получило около четверти всего населения.
Для того, чтобы в сентябре полноценную прививку сделали 60 % россиян (такой показатель нужен для обеспечения минимального коллективного иммунитета, необходимого для окончания пандемии), требуется привить в шесть раз больше человек, чем это было сделано за первое полугодие 2021 г. А, к примеру, для прекращения пандемии при распространении коронавирусного варианта дельта нужно, согласно прогнозу ВОЗ, вакцинировать около 80 % населения (Abu-Raddad et al., 2021). До такого показателя Россия до конца 2021 г. не дойдет без кардинального – на порядок – ускорения темпов вакцинации.
В странах, где продолжают соблюдаться противоэпидемические меры, а доля вакцинированных приближается к 60 % (Великобритания, Израиль и др.), заболеваемость к июню 2021 г. упала до минимального уровня с начала года. Что касается ее июльского подъема в США и Великобритании (в первую очередь из-за распространения вирусного варианта дельта), то директор Центров по контролю и профилактике заболеваний в США Р. Валенски назвала его «в основном эпидемией непривитых». Однако нужно отметить, что вариант дельта в несколько раз более заразный, чем прежние, и в принципе способен «пробивать» иммунитет у некоторых давно вакцинированных людей.
В России на начало лета новой коронавирусной инфекцией переболело, по данным санкт-петербургских исследователей, около 30 % населения (Barchuk et al., 2021). В это время у нас началась мощная третья волна заболеваемости COVID‑19. Причин этому несколько: от пренебрежения противоэпидемическими мерами, включая защитные маски, и проведения масштабных публичных мероприятий до массового заноса из Индии варианта дельты. При этом одна из самых значимых причин – низкий уровень вакцинирования населения. И если мы кардинально не изменим ситуацию с вакцинацией и противоэпидемическими мерами, то у нас будут и четвертая, и пятая, и шестая волны.
Главное – это не просто издавать приказы, а тщательно отслеживать и контролировать их выполнение. Ведь, к примеру, вакцин у нас откровенно не хватает: «Спутник V» пока производится в недостаточном количестве, а ее первый компонент в качестве однокомпонентной вакцины «Спутник Лайт» лишь недавно был разрешен к использованию для пожилых людей. И в этом отношении совершенно непонятен призыв к ревакцинации, в то время как около трех четвертей населения не вакцинировано вообще.
Подводя итоги, можно сказать, что на сегодняшний день уже есть более-менее безопасные вакцины с эффективной защитой от этой инфекции.
За векторными вакцинами – будущее для здоровых людей, потому что разработать их можно быстро, они дают сильный иммунитет и относительно дешевы. Производство таких вакцин легко масштабировать, их проще перевозить и хранить. Но и поствакцинальные реакции на них есть. И в этом смысле самыми перспективными являются вакцины на основе мРНК, как наиболее очищенные и минимизированные по составу, а также числу и тяжести побочных реакций. Производство этих вакцин также можно масштабировать, однако они существенно дороже, а перевозить и хранить их надо при низких (до минус 70 ° С) температурах.
Нельзя забывать и о классических инактивированных вакцинах, которые сейчас массово выпускаются в Индии и Китае и начали производиться в России и Казахстане.
Но окончательно сравнить все вакцины против COVID‑19 можно будет только после финальных оценок их реального защитного эффекта, побочных реакций и безопасности, которые будут сделаны на основе анализа заболеваемости на больших выборках из вакцинированных и невакцинированных людей. Публикации подобных результатов ожидаются в начале 2022 г.
Безусловно, защитный эффект от любых вакцин может утрачиваться со временем, поэтому вакцинации от COVID‑19 станут, скорее всего, регулярными – раз в 2-3 года, а то и чаще. И SARS-CoV‑2, по-видимому, войдет в нашу жизнь так же, как в нее вошли вирусы гриппа, «обычные» коронавирусы и другие возбудители ОРВИ.
Abu-Raddad L. J., Chemaitelly H., Butt A. A. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants // NEJM. 2021. V. 385. № 2. P. 187–189. DOI: 10.1056/NEJMc2104974
Halstead S. B., Katzelnick L. COVID-19 Vaccines: Should We Fear ADE? // The Journal of Infectious Diseases. 2020. V. 222. P. 1946–1950.
Logunov D. Y., Dolzhikova I. V., Zubkova O. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2020. V. 396. P. 887–897.
Logunov D. Y., Dolzhikova I. V., Shcheblyakov D. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2021. V. 397. P. 671–681.
Shimabukuro T. T., Kim S. Y., Myers T. R., et al. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons // NEJM. 2021. V. 384. P. 2273–2282.