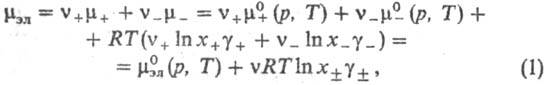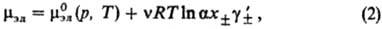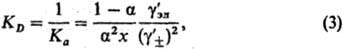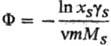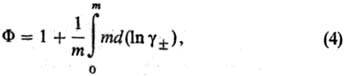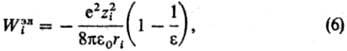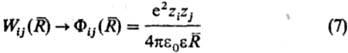что такое раствор электролита
Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от: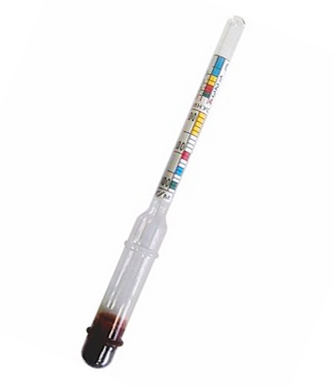
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.
При работе с электролитом следует выполнять 
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Р. э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных Р. э. (т. е. св-ва, зависящие только от концентрации растворенного в-ва, но не от его природы) существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос),понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация Р. э., особенности теоретич. подходов в сравнении с др. классами р-ров. Наиб. изучены водные Р. э., играющие важную роль во многих биол., геол. и техн. процессах. Неводные Р. э. служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения в-в и др.).
В зависимости от состояния растворенного в-ва до растворения выделяют два класса Р. э.-р-ры ионофоров и р-ры ионогенов. Ионофоры в чистом состоянии существуют в виде ионных кристаллов (напр., галогениды щелочных металлов). В сильнополярных р-рителях (напр., в воде) ионофоры, как правило, диссоциируют полностью и составляют р-ры сильных электролитов. В слабополярных р-рителях (напр., в уксусной к-те) они образуют р-ры слабых электролитов. Ионогены до растворения состоят из молекул, они являются потенц. электролитами, электролитич. диссоциация проходит, как правило, в две стадии и обычно не полностью (хлорная к-та в уксусной к-те).
В качестве стандартного состояния компонентов в Р. э. выбирают: для р-рителя-состояние чистой жидкости, для растворенного в-ва-состояние в гипотетич. р-ре, где его концентрация и активность равны единице, а термодинамич. св-ва 


В электролитах с неполной степенью диссоциации (а D (или константы ассоциации К а ):
Для описания отклонения от идеального состояния разбавленных Р. э. используют кажущиеся осмотические коэффициенты, характеризующие отклонение осмотич. давления от значения, определяемого законом Вант-Гоффа, и связанные с ионными коэф. активности соотношением:
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
РАСТВОРЫ ЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Растворы электролитов обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных растворов электролитов (т. е. св-ва, зависящие только от концентрации растворенного в-ва, но не от его природы) существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворов электролитов, особенности теоретич. подходов в сравнении с др. классами р-ров. Наиб. изучены водные растворы электролитов, играющие важную роль во многих биол., геол. и техн. процессах. Неводные растворы электролитов служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения в-в и др.).
В зависимости от состояния растворенного в-ва до растворения выделяют два класса растворов электролитов-р-ры ионофоров и р-ры ионогенов. Ионофоры в чистом состоянии существуют в виде ионных кристаллов (напр., галогениды щелочных металлов). В сильнополярных р-рителях (напр., в воде) ионофоры, как правило, диссоциируют полностью и составляют р-ры сильных электролитов. В слабополярных р-рителях (напр., в уксусной к-те) они образуют р-ры слабых электролитов. Ионогены до растворения состоят из молекул, они являются потенц. электролитами, электролитич. диссоциация проходит, как правило, в две стадии и обычно не полностью (хлорная к-та в уксусной к-те).
Растворители для растворов электролитов-как правило, полярные жидкости (чистые или смешанные). Чем больше диэлектрич. проницаемость e р-рителя, тем значительнее ослабляется сильное электростатич. притяжение противоположно заряженных ионов, что способствует возникновению в р-ре ионов. Интенсивное взаимод. последних с молекулами р-рителя приводит к связыванию ионов с молекулами р-рителя (см. Сольватация). Важна также способность молекул р-рителя выступать в качестве доноров или акцепторов протонов или электронов. В зависимости от этих двух св-в различают четыре группы р-рителей: 1) протонные р-рители (вода, спирты, карбоновыс к-ты и др.), к-рые являются хорошими донорами протона и обладают высокой диэлектрич. проницаемостью ( e > 15); 2) апротонные дшюлярные р-рители (нек-рые апротонные амиды, кстоны, сульфоксиды и др.), обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными св-вами в отношении протона; 3) электронодонорные-р-рители (напр., эфиры); 4) неполяр-ныс р-рители (сероуглерод, углеводороды), к-рые обладают низкой диэлектрич. проницаемостью ( e
Находящиеся в растворах электролитов ионы могут существовать в виде своб. сольватир. ионов или в виде ассоциатов-контактных или сольватно разделенных ионных пар, тройников и т.д. Поскольку ионные пары не проводят электрич. ток, содержание своб. ионов в растворах электролитов определяется по его электрич. проводимости, в то время как общее число ионов (свободных и ассоциированных) можно определить, напр., спектрофотомет-рич. методами.
В качестве стандартного состояния компонентов в растворах электролитов выбирают: для р-рителя-состояние чистой жидкости, для растворенного в-ва-состояние в гипотетич. р-ре, где его концентрация и активность равны единице, а термодинамич. св-ва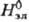
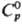
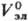
где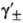
Для описания отклонения от идеального состояния разбавленных растворов электролитов используют кажущиеся осмотические коэффициенты, характеризующие отклонение осмотич. давления от значения, определяемого законом Вант-Гоффа, и связанные с ионными коэф. активности соотношением:
Наряду с хим. потенциалами ионов используют также электрохим. потенциал i-го иона с валентностью z i :
К неэлектростатич. вкладам в W i относят индукционный и дисперсионный вклады (см. Дисперсионное взаимодействие), а также вклад, связанный с работой, к-рую необходимо затратить для образования в р-рителе полости и внедрения в нее иона. Расчет этих вкладов производится теми же методами, что и для р-ров неэлектролитов. Для расчета энергии сольватации применяют квантовохим. методы.
Бинарные слагаемые в энергии межионного взаимод. выражаются через потенциалы W ij (R), описывающие эффективное взаимод. ионов сортов i и j, находящихся на расстоянии R друг от друга. Соотв. тернарные слагаемые выражаются через потенциалы, описывающие трехчастичное взаимод. ионов и т. д. Учет бинарных и высших слагаемых в выражении для энергии межионного взаимод. позволяет описывать концентрац. зависимости термодинамич. св-в растворов электролитов.
С увеличением концентрации электролита возникает необходимость учитывать и некулоновскую часть межионного взаимод., для чего прибегают к нек-рым моделям. При этом наряду с индукционным, дисперсионным, обменным и др. видами межчастичных взаимод. некулоновский потенциал учитывает сольватац. эффекты, связанные с влиянием р-ри-теля. В частности, учет некулоновской части взаимод. стабилизирует уменьшение коэф. активности ионов с концентрацией и может объяснить их увеличение, наблюдаемое экспериментально. Наипростейшей ионной моделью растворы электролитов является модель заряженных твердых сфер (т. наз. примитивная модель). Первые попытки описания примитивной модели были выполнены в рамках теории Дебая-Хюккеля (второе приближение). Более корректно учет размера ионов и неку-лоновского взаимод. осуществляется на основе методов статистич. термодинамики (см. Жидкость).
В рамках примитивной модели размеры ионов отличаются от кристаллографич. радиусов из-за сольватац. эффектов. Однако даже при одном и том же выборе размеров ионов удовлетворительно описать эксперим. результаты для разл. термодинамич. св-в растворах электролитов в примитивной модели оказалось затруднительным. К более корректным результатам приводит модель парного взаимод. типа «прямоугольной ямы», в к-рой ширина потенц. ямы выбирается равной диаметру молекулы р-рителя, а глубина ямы считается подгоночным параметром, учитывающим сольватац. эффекты; при этом используются кристаллографич. размеры ионов. В более реалистич. модели Фридмана в некулонов-ском потенциале межионного взаимод. выделяют три слагаемых, соответствующих: 1) главному отталкиванию ионов, определяемому их кристаллографич. размерами; 2) эффекту поляризации полости ионов р-рителем; 3) потенциалу Гер-ни-Франка, описывающему структурные эффекты, связанные с перекрыванием сольватных оболочек ионов при их сближении. Расчеты на основе ион-молекулярных моделей показывают, что на малых расстояниях межионные потенциалы имеют отталкивательный характер, на больших расстояниях, в соответствии с (7), зависят от расстояния между ионами асимптотически, как и при кулоновском взаимод., на промежут. расстояниях осциллируют вблизи этой асимптоты, причем с уменьшением размера иона (или с увеличением его валентности) амплитуда осцилляции возрастает, что соответствует усилению роли сольватац. эффектов.
Пренебрежение трехчастичными (и высшими) межионными взаимод. ограничивает возможности ионного подхода. В частности, для 1,1-зарядных водных растворов электролитов ионный подход обеспечивает количеств. описание термодинамич. св-в в области концентраций до 1 М. Учет концентрац. зависимости диэлектрич. проницаемости позволяет немного расширить эту концентрац. область. Формально расширения области применимости ионного подхода можно достигнуть, дополняя полученные с его помощью результаты разл. эмпирич. поправками. Примером такого подхода может служить полуэмпирич. ур-ние Питцера для осмотич. коэффициента или метод Робинсона-Стокса описания ионных коэф. активности с учетом гидратации (с помощью гидра-тац. чисел). Для описания многокомпонентных растворов электролитов широко используется правило Здановского, основанное на предположении о том, что смешение изописстич. р-ров разл. электролитов, химически не взаимодействующих между собой, происходит без изменения активности р-рителя.
Наипростейшей ион-молекулярной моделью растворов электролитов является ион-дипольная модель, в к-рой ионы рассматриваются как заряженные твердые сферы, а молекулы р-рителя моделируются твердыми сферами с дипольным моментом. Полученные выражения для термодинамич. ф-ций обобщают ур-ния, используемые в ионном подходе. В частности, в предельном случае малых концентраций выражения для ионных коэф. активности включают члены, основанные на теории Дебая-Хюккеля, а выражения для энергии сольватации-борновскую ф-лу (6) с эффективным радиусом иона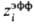
Предпринимаются попытки учета квадрупольного элект-рич. момента и поляризуемости молекул р-рителя, а также взаимод., ответственных за образование в растворах электролитов ассоциатов и сольватов. Наиб. реальные модели разработаны в осн. для водных растворов электролитов и базируются обычно на компьютерном моделировании. Для описания ионно-молекулярных и межмолекулярных взаимод. применяют эмпирич. модели воды (модель ST2, модель центр. сил и др.), а также модели, основанные на квантовохим. расчетах. Рассчитанные парциальные радиальные ф-ции распределения дают информацию о структуре р-ра. В частности, с помощью ионно-молекулярных ф-ций определяют координац. числа сольватации. Найденные с помощью парциальных радиальных ф-ций структурные факторы удовлетворительно согласуются с данными дифракц. измерений.
Электрон-ядерный подход основан на учете электроста-тич. взаимод. между электронами и ядрами, входящими в состав ионов и молекул в растворах электролитов. Этот подход является наиб. последовательным, он основан на квантовомех. рассмотрении и разработан пока лишь для ион-молекулярных комплексов.
Важное значение в физ. химии растворов электролитов имеют исследования транспортных св-в, особенно электрич. проводимости (см. Электропроводность электролитов). Наличие ионов заметно сказывается на диффузии, вязкости, теплопроводности.
Лит.: Робинсон Р. А., Стоке Р. Г., Растворы электролитов, пер. с англ., М., 1963; Измайлов Н.А., Электрохимия растворов, 3 изд., М., 1976; Мищенко К. П., Полторацкий Г.М., Термодинамика и строение водных и неводных растворов электролитов, 2 изд., Л., 1976; Юхновский И. Р., Головко М.Ф., Статистическая теория классических равновесных систем, К., 1980; Ионная сольватация, М., 1987; Falkenhagen H., Theorie der Elektrolyte, Lpz., 1971; The chemical physics of solvation, pt А, В, С, Amst., 1985-88.
Что такое раствор электролита
4.3 РАСТВОРЫ ЭЛЕКТРОЛИТОВ
4.3.1 Электролитическая диссоциация
CH3COOH 
Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных * или полярных связей *, а также достаточная полярность * самого растворителя *. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Степенью диссоциации ( α ) электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е. 
Константа равновесия для процесса диссоциации называется константой диссоциации ( K). В общем случае для электролита, диссоциирующего на два иона:
АВ 
Для приведенного выше процесса диссоциации уксусной кислоты:
[A + ] = [B – ] = α C ; [AB] = C(1– α );
Таким образом, степень диссоциации возрастает с разбавлением раствора.
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например:
H2CO3
HCO3 – 
Первое равновесие – диссоциация по первой ступени – характеризуется константой
Для диссоциации по второй ступени:
ЭЛЕКТРОЛИТЫ
Полезное
Смотреть что такое «ЭЛЕКТРОЛИТЫ» в других словарях:
ЭЛЕКТРОЛИТЫ — в широком смысле жидкие или твёрдые в ва и системы, в к рых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрич. тока (ионную проводимость); в узком смысле в ва, распадающиеся в р ре на ионы. При растворении Э.… … Физическая энциклопедия
ЭЛЕКТРОЛИТЫ — ЭЛЕКТРОЛИТЫ, жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле химические соединения, которые в растворах распадаются на ионы вследствие электролитической диссоциации.… … Современная энциклопедия
ЭЛЕКТРОЛИТЫ — вещества, разлагающиеся под влиянием гальванич. тока. Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ЭЛЕКТРОЛИТЫ тело, разлагаемое химически на составные простые посредством электрического тока, т. е. над которым… … Словарь иностранных слов русского языка
Электролиты — ЭЛЕКТРОЛИТЫ, жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. В узком смысле химические соединения, которые в растворах распадаются на ионы вследствие электролитической диссоциации.… … Иллюстрированный энциклопедический словарь
ЭЛЕКТРОЛИТЫ — водные и другие растворы щелочей, кислот и солей, проводящие электр. ток. Э. наз. проводниками второго рода, т. к. они резко отличаются от металлов (проводников первого рода). Электр. ток, проходя по проводникам первого рода, не производит… … Технический железнодорожный словарь
электролиты — – системы, обладающие в жидком или твердом состоянии ионной проводимостью. Словарь по аналитической химии [3] … Химические термины
Электролиты — – соли и др. химические вещества, растворы которых проводят электрический ток из за наличия ионов, образующихся в результате электролитической диссоциации. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ … Энциклопедия терминов, определений и пояснений строительных материалов
Электролиты — Электролит химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты проводники второго рода,… … Википедия
Электролиты — [electrolytes] жидкие или твердые вещества, в которых в результате электролитической диссоциации образуются в сколько нибудь заметной концентрации ионы, обусловливающие прохождение постоянного электрического тока. Электролиты в растворах… … Энциклопедический словарь по металлургии