что такое промотор в биологии
Промотор
Промоторный участок в пределах оперона может частично перекрываться или вовсе не перекрываться с операторным участком цистрона (гена).
То, под каким промотором находится кодирующий РНК участок ДНК, играет решающее значение в интенсивности экспрессии этого гена в каждом конкретном типе клеток. Активация промотора определяется присутствием в каждом типе клеток своего набора транскрипционных факторов
Полезное
Смотреть что такое «Промотор» в других словарях:
промотор — ускоритель, активатор Словарь русских синонимов. промотор сущ., кол во синонимов: 2 • активатор (9) • … Словарь синонимов
ПРОМОТОР — ПРОМОТОР, в химии вещество, применяемое в небольших количествах вместе с катализатором для увеличения активности КАТАЛИЗАТОРА. Например, в ПРОЦЕССЕ ХАБЕРА железо катализатор применяется для ускорения реакции соединения водорода с азотом под… … Научно-технический энциклопедический словарь
промотор — а, м. (нем. Promotor … Словарь иностранных слов русского языка
Промотор — последовательность нуклеотидов в молекуле ДНК, ответственная за начало транскрипции. Источник: Порядок и организация контроля за пищевой продукцией, полученной из/или с использованием сырья растительного происхождения, имеющего генетически… … Официальная терминология
промотор — Последовательность молекулы ДНК, место инициации процесса транскрипции [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN promoter … Справочник технического переводчика
промотор — ПРОМОТЕР, ПРОМОТОР а, м. promoteur m. нем. Promotor <лат. promovere продвигать. един. Инициатор, зачинщик. К концу мая и мы выедем, настоящего плана нет, и хотя <натали> угомонилась, но я главный промотор длинного свиданья на Лимане… … Исторический словарь галлицизмов русского языка
промотор — promoter (promotor) промотор. Участок молекулы ДНК, к которому присоединяются молекулы РНК полимеразы (при этом молекулярные основы взаимодействия между П. и РНК полимеразой пока неясны), что сопровождается инициацией… … Молекулярная биология и генетика. Толковый словарь.
промотор — гидрофобизатор; отрасл. активатор; промотор Вещество, наносимое на поверхность тела с целью поддержания капельной конденсации (путем создания гидрофобного поверхностного слоя) … Политехнический терминологический толковый словарь
промотор — проматор (промотор) натхненник, керівник, покровитель … Зведений словник застарілих та маловживаних слів
Промотор (биология)
Промотор — регуляторная участок ДНК, расположенная перед (по направлению к 5 ‘конца молекулы) открытой рамки считывания гена или в начале оперона, обеспечивая контроль транскрипции этого гена или оперона. Каждый ген или оперон может иметь более одного промотор, регулируемые отдельно друг от друга, и, кроме того, другие регуляторные участки. Промотор необходимо для инициации транскрипции.
Прокариоты
Строение бактериального промотора
Типичный бактериальный промотор содержит 2 последовательности:
Эти последовательности являются консервативными, но отдельные нуклеотиды могут варьировать у разных видов и генов. Кроме того, такие элементы узнаются только сигма-субъединицей РНК-полимеразы массой 70 килодальтон, другие изоформы узнают другие последовательности.
Вблизи промотора могут быть расположены другие регуляторные последовательности: операторы, цис-элементы. Гены бактерий часто объединены в оперон — группы генов, кодирующих определенный биохимический путь, совместно регулируются и расположены близко друг к другу на хромосоме. Оперона могут иметь один или несколько промоторов. Лактазной оперон, который был описан первым, имеет только один промотор, благодаря которому транскрибируется три гена.
Инициация транскрипции
Промотор распознается фактором инициации транскрипции — сигма-субъединицей РНК-полимеразы. Пока сигма-субъединица находится в комплексе с полимеразой, она перебирает последовательности ДНК, пока не наткнется с промотором, последовательности которого у нее самая родственностью. Отключение фактора инициации от промотора происходит одновременно с элонгацией транскрипции.
Промоторы могут иметь разную «силу промотора», то есть связываться с РНК-полимеразной комплексом с разной эффективностью. Слабые промоторы требуют дополнительных факторов для начала транскрипции. Сила промотора также зависит от уровня суперспирализации бактериальной ДНК: при наличии отрицательного скручивания молекулы, она начинает плавиться и транскрипция начинается быстрее.
Эукариот
Эукариот имеют 3 класса РНК-полимеразы, каждый из которых имеет собственные промоторы и механизмы инициации транскрипции.
Строение промотора РНК-полимеразы II
К базальных элементов промотора относятся:
Не все гены эукариот имеют такие элементы.
Инициация транскрипции
В эукариот РНК-полимераза II, которая ответственна за синтез большинства мРНК и некодирующих РНК, представляет собой белковый комплекс из 12 субъединиц. Для инициации транскрипции на промоторе должен собраться пре-инициаторным комплекс из 6 субъединиц.
С ТАТА-боксом связывается белок TBP (англ. TATA-box binding protein), который раскручивает ДНК в месте промотора. Этот белок имеет несколько кофакторов, которые познают другие участки промотора (низовой элемент, ГЦ-бокс), если определенный ген не имеет ТАТА-бокса.
1 : РНК-полимераза, 2 : Репрессор, 3 : Промотор, 4 : Оператор, 5 : Лактоза, 6 : lacZ, 7 : lacY, 8 : lacA.
Внизу : ген включен. Лактоза ингибирует репрессор, позволяя РНК-полимеразе связываться с промотором и экспрессировать гены, которые синтезируют лактазу. В конце концов, лактаза переваривает всю лактозу до тех пор, пока она не перестанет связываться с репрессором. Затем репрессор свяжется с оператором, остановив производство лактазы.
СОДЕРЖАНИЕ
Обзор
Определение относительного местоположения
Относительное расположение в ядре клетки
В ядре клетки, по-видимому, промоторы распределены преимущественно на краю хромосомных территорий, вероятно, для совместной экспрессии генов на разных хромосомах. Кроме того, у людей промоторы проявляют определенные структурные особенности, характерные для каждой хромосомы.
Элементы
Бактериальный
Вероятность появления каждого нуклеотида
Эукариотический
Эукариотические промоторы разнообразны, и их трудно охарактеризовать, однако недавние исследования показывают, что они делятся на более чем 10 классов.
Промоторы взаимодействуют с энхансерами, факторами транскрипции, комплексом медиатора и петлями ДНК при транскрипции млекопитающих.
Активная экспрессия генов у млекопитающих инициируется, когда сигналы передаются промоторам, связанным с генами. Последовательности промоторной ДНК могут включать в себя различные элементы, такие как островки CpG (присутствующие примерно в 70% промоторов), TATA-бокс (присутствующий примерно в 24% промоторов), инициатор (Inr) (присутствующий примерно в 49% промоторов), вышестоящий и расположенные ниже элементы распознавания TFIIB (BREu и BREd) (присутствующие примерно в 22% промоторов) и нижележащий коровый промоторный элемент (DPE) (присутствующий примерно в 12% промоторов). Присутствие множественных метилированных сайтов CpG на островках CpG промоторов вызывает стабильное молчание генов. Однако эксперименты Weingarten-Gabbay et al. показали, что присутствие или отсутствие других элементов имеет относительно небольшое влияние на экспрессию генов. Две последовательности, ТАТА-бокс и Inr, вызывали небольшое, но значительное увеличение экспрессии (увеличение на 45% и 28% соответственно). Элементы BREu и BREd значительно снижали экспрессию на 35% и 20% соответственно, а элемент DPE не оказывал заметного влияния на экспрессию.
На схематической иллюстрации в этом разделе показан энхансер, который зацикливается и находится в непосредственной физической близости с промотором целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ), при этом один член димера прикреплен к его мотиву связывания на энхансере, а другой член прикреплен к его мотиву связывания на промоторе (представленном красные зигзаги на иллюстрации). Несколько факторов транскрипции, специфичных для функции клетки (в клетке человека имеется около 1600 факторов транскрипции), как правило, связываются со специфическими мотивами на энхансере, и небольшая комбинация этих факторов транскрипции, связанных с энхансером, при приближении к промотору петлей ДНК, регулирует уровень транскрипции целевого гена. Медиатор (коактиватор) (комплекс, обычно состоящий из примерно 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (pol II), связанному с промотором.
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК, причем РНК-полимеразы действуют в двух разных направлениях, образуя две эРНК, как показано на рисунке. Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. Маленькую красную звездочку, представляющую фосфорилирование фактора транскрипции, связанного с энхансером, на иллюстрации). Активированный энхансер начинает транскрипцию своей РНК перед активацией промотора, чтобы инициировать транскрипцию информационной РНК из своего гена-мишени.
Двунаправленный (млекопитающие)
Субгеномный
Обнаружение
Эволюционное изменение
Изменения в промоторных последовательностях имеют решающее значение для эволюции, на что указывает относительно стабильное количество генов во многих клонах. Например, большинство позвоночных имеют примерно одинаковое количество кодирующих белок генов (около 20 000), последовательность которых часто высококонсервативна, поэтому большая часть эволюционных изменений должна происходить из-за изменений в экспрессии генов.
De novo origin промоутеров
Учитывая короткие последовательности большинства промоторных элементов, промоторы могут быстро развиваться из случайных последовательностей. Например, в E. coli
60% случайных последовательностей могут развивать уровни экспрессии, сравнимые с lac-промотором дикого типа только с одной мутацией, и эти
10% случайных последовательностей могут служить активными промоторами даже без эволюции.
Привязка
Процесс связывания промотора имеет решающее значение для понимания процесса экспрессии генов.
Место нахождения
Хотя холофермент РНК-полимеразы проявляет высокое сродство к неспецифическим сайтам ДНК, эта характеристика не позволяет нам уточнить процесс локализации промотора. Этот процесс локализации промотора был приписан структуре холофермента ДНК и сигма 4 комплексам ДНК.
Заболевания, связанные с нарушением функции
Островки CpG в промоторах
Метилирование CpG-островков стабильно заставляет гены молчать
Гипер / гипометилирование промотора CpG при раке
Молчание генов репарации ДНК посредством метилирования CpG-островков в их промоторах, по-видимому, особенно важно при прогрессировании рака (см. Метилирование генов репарации ДНК при раке ).
Канонические последовательности и дикого типа
Использование термина « каноническая последовательность» для обозначения промотора часто проблематично и может привести к неправильному пониманию последовательностей промотора. Канонический в некотором смысле подразумевает совершенное.
В случае сайта связывания фактора транскрипции может существовать единственная последовательность, которая связывает белок наиболее прочно в определенных клеточных условиях. Это можно было бы назвать каноническим.
Однако естественный отбор может способствовать менее энергичному связыванию как способу регуляции транскрипционного выхода. В этом случае мы можем назвать наиболее распространенную последовательность в популяции последовательностью дикого типа. Это может быть даже не самая выгодная последовательность в преобладающих условиях.
Недавние данные также указывают на то, что некоторые гены (включая протоонкоген c-myc ) имеют мотивы G-квадруплекса в качестве потенциальных регуляторных сигналов.
Заболевания, которые могут быть связаны с вариациями
Некоторые случаи многих генетических заболеваний связаны с вариациями промоторов или факторов транскрипции.
Учредительный vs регулируемый
Использование термина
Али-Баба и 40 промоторов
Микоплазмы атакуют эритроцит курицы
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Паразитизм — явление универсальное для биологической жизни. Вне зависимости от того, какую систематическую группу представляют и в каком диапазоне размеров действуют паразиты, их приемы в целом совпадают. Развиваясь независимо, они, тем не менее, пришли к объединяющему их принципу «кинжал и мантия» — не брезгуют обманом, самозванством и внезапной жестокостью. На нижнем пределе размеров живого таким промышляют бактерии — внутриклеточные паразиты. Здесь мы рассмотрим микоплазм, и прежде всего Mycoplasma gallisepticum — важного патогена птиц. Рассказ пойдет о том, как этот сильно упростившийся организм научился быстро переключать активность своих генов, а также о его особых промоторах.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Паразитизм в особо мелком размере
Добиться успеха можно честным и кропотливым путем. А можно схитрить. Верно это как в повседневной, так и в биологической жизни. В случае, когда на кону успех репродуктивный, то есть максимальные численность и распространение, отъявленными жуликами можно назвать паразитов. Их можно встретить на всех уровнях организации живого и в различных царствах. Приемы они могут использовать поведенческие, морфологические, обманывающие восприятие или иммунитет, применяющие молекулярные механизмы. да, есть даже своего рода паразитизм молекулярный [1]. При этом замысел в целом сохраняется: прикинуться кем-то другим (или никем — камуфляж!), прокрасться к самому ценному и вероломно его присвоить. Слишком церемониться с хозяином нет нужды — его благополучие не входит в планы паразита. Ему главное не полечь под тяжестью убитого. Кстати, о философии паразитизма «Биомолекула» уже размышляла [2].
На передовой паразитического фронта находятся самые маленькие клеточные (а значит и живые, omnis cellula e cellula — клетка происходит только от клетки) организмы. Размеры их переваливают через границу в 1 микрон (вплоть до 100 нанометров), что приближает их к нановселенной. По большей части они как раз являются паразитами, а именно — паразитами внутриклеточными. Таковы хламидии, таковы риккетсии, листерии, коксиеллы и самые маленькие из них — микоплазмы, на которых мы сегодня сосредоточимся [3]. Есть среди таких нанобактерий и паразитические археи (строго говоря, принадлежащие другому даже не царству, а домену жизни — археям), и честные свободноживущие бактерии, например, обитающие в глубинах океaна [7].
Эти паразиты — внутриклеточные подрывники поражают различные ткани животных и человека, включая специализированные (макрофаги) и неспециализированные фагоциты; эпителиальные, эндотелиальные клетки, а также клетки печени. Как только паразиты пробраются внутрь, им открывается возможность следовать различными путями в цитозоле (основой среде клетки) или изолированных вакуолях [3].
Любопытно отметить, что временами бывать снаружи клетки приходится даже самым внутриклеточным паразитам. Большинству, по крайней мере. Отдельные представители приспособились к передаче от клетки к клетки напрямую, добавив еще один порок — домоседство — к паразитизму. Внеклеточным паразитам приходится иметь дело с гуморальными механизмами иммунитета и фагоцитозом, обойдя которые, они получают возможность внеклеточного размножения. Паразиты же внутриклеточные борются главным образом за свое проникновение в целевые клетки, такие как макрофаги и эпителиальные. Для этого они выработали способность связываться с чувствительными хозяйскими клетками — процесс включает стадию внутриклеточного размножения.
Успешная инфекция требует контакта паразита с определенной клеткой, содержимое которой представляет собой подходящую среду для роста бактерии. Несколько затруднительным теоретическим вопросом является следующий. Внутриклеточных паразитов разделяют на факультативных и облигатных в зависимости от способности к самовоспроизводству в бесклеточной среде, по сути — искусственно созданной. Вопрос собственно в том, такие уж они в этом случае внутриклеточные [3].
Скользкий тип
Перейдем же к микоплазмам. В системе живого мира им и их сородичам отведен отдельный класс бактериального царства — Mollicutes. Название происходит от латинских слов mollis («мягкий, гибкий») и cutis («кожа»). Слава у этого класса самая сомнительная. И клеточной стенки у них нет, и постоянной формы, и перемещаются они, скользя по субстрату, а не при помощи флагелл-жгутиков, как все нормальные прокариоты. О размерах же их уже было сказано. Паразиты-микоплазмы к тому же всеядны: и люди им подвержены (совсем уж порочная бактерия Mycoplasma genitalium), и различные животные, и даже растения [4].
Один из механизмов, позволяющих микоплазмам, да и другим внутриклеточным паразитам, маневренно обходить иммунную контратаку, — быстрые переключения экспрессии генов в формате «все или ничего» (англ. phase variation), называемые также расщеплением культуры. Такие переключения могут быть случайными или определяться тем же иммунитетом хозяина [5].
В случае микоплазм к главным механизмам такого переключения относится смена репертуара поверхностных липопротеинов. Бактерия способна «интерактивно», то есть отвечая на реакцию хозяина, менять липопротеины (молекулы-композиты — и белки и липиды одновременно) на своей поверхности. А это мешает узнаванию и липопрепотеинов, и покрытых ими микоплазм. При этом известно несколько различных механизмов такого переключения. Они являются видоспецифичными или же общими у близких видов. В их числе ошибки репликации, сайт-специфичная рекомбинация, генная конверсия и т.д. [4]. Рассмотрим уникальную в этом отношении микоплазму — M. gallisepticum. Описание начнем с того, что в ее случае механизмы смены репертуара поверхностных липопротеинов до конца не выяснены. Тем острее интерес!
Фокус на галлисептикум
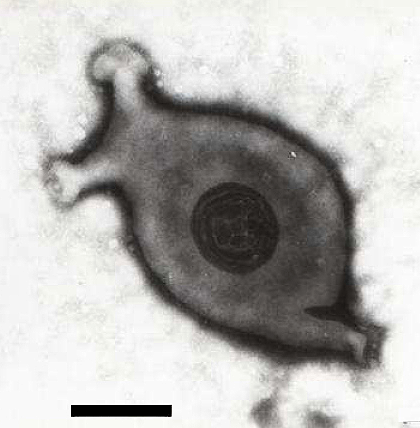
Рисунок 1. Электронная микрофотография Mycoplasma gallisepticum. Линейка имеет размер 140 нм.
Mycoplasma gallisepticum является значимым для, что называется, народного хозяйства вредителем птицы. Дикие виды также подвержены ей. Сам подозреваемый изображен на рисунке 1, его преступление — на рисунке 2. Развивающаяся при этом инфекция затрагивает дыхательные пути.
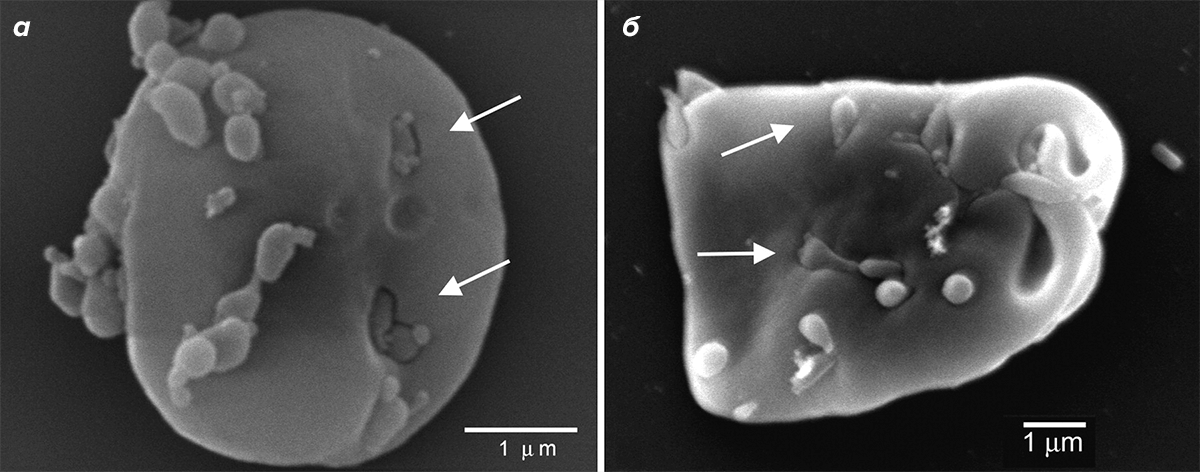
Рисунок 2. Сканирующая электронная микроскопия эритроцитов овцы (а) и курицы (б) после инфекции in vitro штаммом M. gallisepticum Rlow. Стрелки показывают самих микоплазм или следы их внедрения на поверхности эритроцитов.
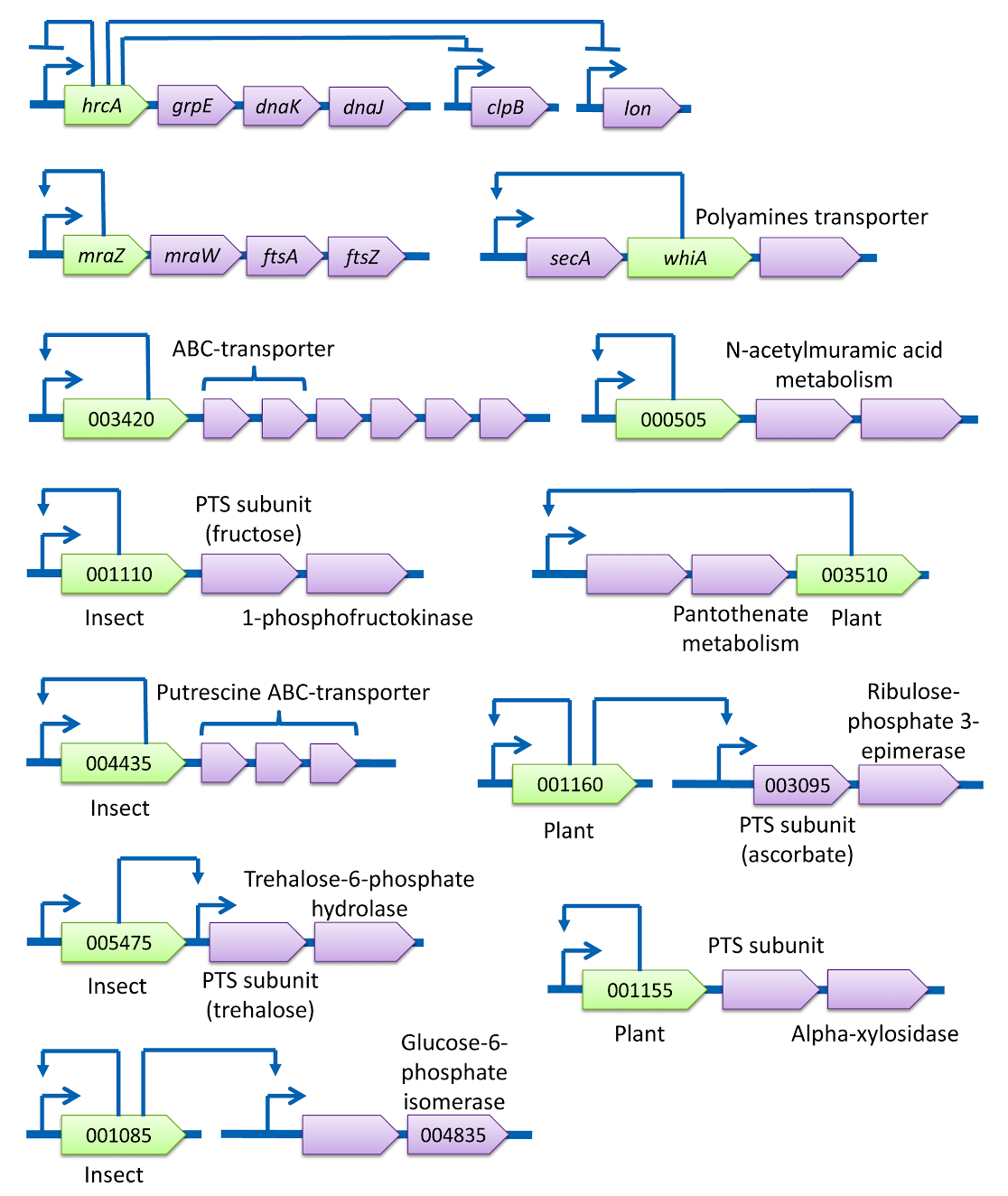
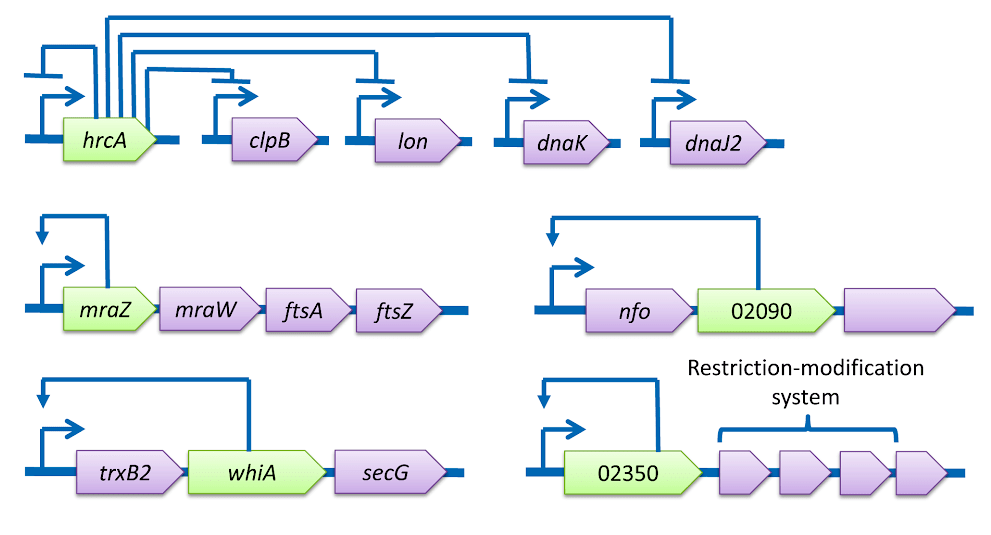
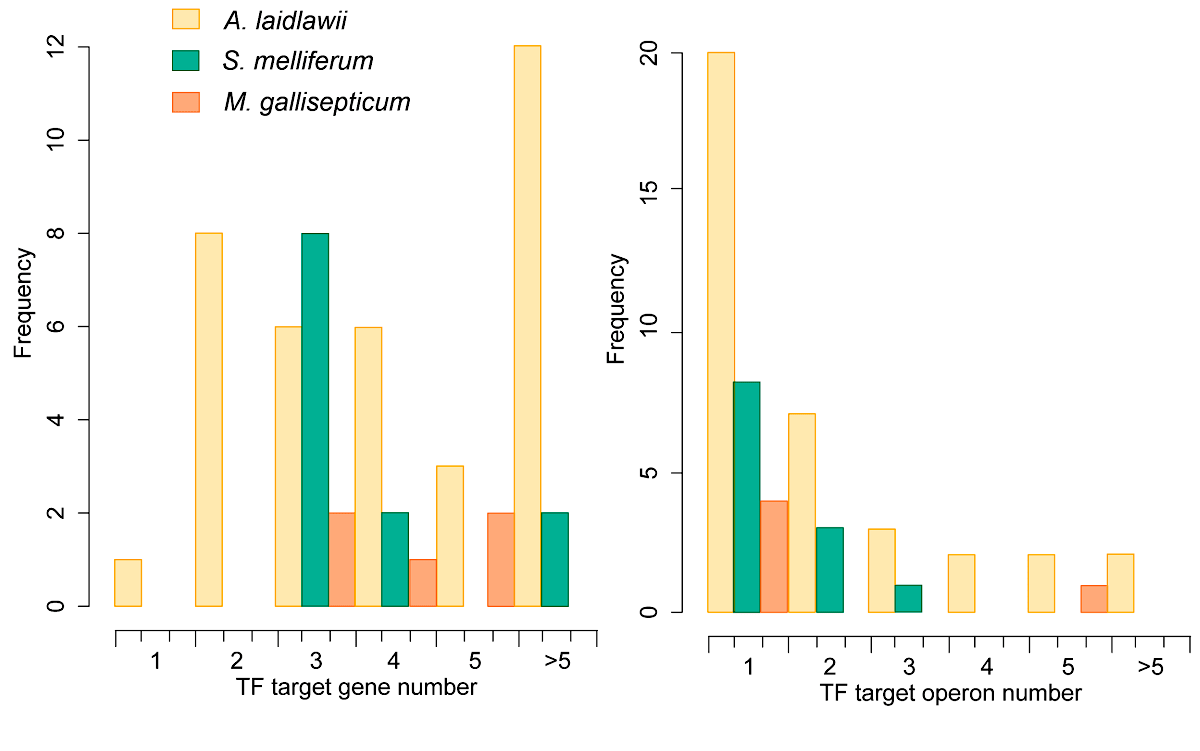
Как и положено представителю племени Mollicuta, клетка галлисептикумa очень сильно упрощена. Соответствующим образом оказался «оптимизирован» и ее геном, приобретя характерные черты такового у внутриклеточного паразита. Живя на всем готовом, эта бактерия потеряла многие метаболические и регуляторные пути. О масштабах потерь можно судить по рисунку 3. На нем приведены схемы регуляции транскрипции для трех представителей Mollicuta. Наряду с предметом нашего обсуждения M. gallisepticum приведены также данные для паразита домашней пчелы Spiroplasma melliferum и Acholeplasma laidlawii — свободноживущей бактерии, добывающей пропитание за счет комменсального (взаимовыгодного) симбиоза с растениями и использования разлагающегося субстрата. Схема регуляции в этой связи для последней не приведена — для этого «самостоятельного» организма она занимает впятеро больше места.
Рисунок 3а. Схематическое изображение сетей регуляции транскрипции Spiroplasma melliferum. Изогнутая стрелка обозначает промотор; линия с Т-образным концом — репрессию, то есть подавление активности; широкие стрелки с подписями — соответствующие гены.
Рисунок 3б. Схематическое изображение сетей регуляции транскрипции Mycoplasma gallisepticum. Изогнутая стрелка обозначает промотор; линия с Т-образным концом — репрессию, то есть подавление активности; широкие стрелки с подписями — соответствующие гены.
Рисунок 3в. Количество транскрипционных факторов (TF) у Acholeplasma laidlawii, S. melliferum и M. gallisepticum
Среди немногочисленных описанных генов M. gallisepticum есть генное семейство гемагглютинина и вариабельного липопротеина — vlhA (variable lipoprotein and hemagglutinin). Повторимся: липопротеины — белки с липидной надстройкой, которые микоплазма способна активно менять. С гемагглютинином все несколько скучнее. А именно он нужен патогену для собственно посадки и взаимодействия с поверхностью хозяйской клетки. Функция vlhA-белков, однако, остается не выясненной до конца. По-видимому, они задействованы в адгезии клеток и проникновении паразита внутрь. Семейство включает немногим больше 40 генов, которые организованы в 3–5 кассет. Обращает на себя внимание, что структура промоторов таких генов существенно отличается от таковых других генов M. gallisepticum [4].
Те самые сорок
«Обычные» промоторы бактерий, управляющие активностью генов фазы активного роста культуры в, так скажем, «мирное время», имеют определенную консервативную (универсальную для них всех в определенных участках) последовательность. Такие промоторы узнает выполняющий транскрипцию фермент РНК-полимераза в комплексе с субъединицей сигма-70. Это своего рода «вставляющаяся» часть составного комплекса на основе РНК-полимеразы — так называемого холофермента. Именно такой сигма-фактор определяет специфическое взаимодействие с промоторами некоторой группы. Промоторы же генов vlhA лишены консервативной последовательности, характерной для специфично узнающихся сигма-70 промоторов. Высказаны предположения, что гены vlhA могут иметь некоторую альтернативную сигма-субъединицу. Но самое, пожалуй, любопытное в них — область тринуклеотидных повторов GAA перед самóй последовательностью генов. Такие повторы последовательности ДНК называются короткими тандемными (short sequence repeats, SSR), или микросателлитами [6]. В отличие от не повторяющихся участков ДНК, они эволюционируют иначе — в целом более изменчивы и динамичны. SSR характерны для самых различных геномов, и в случае прокариот обнаружены в генах, кодирующих различные факторы вирулентности. Именно они и придают патогенам патогенность. К числу таких генов принадлежат и ферменты — в частности, отвечающие за модификацию липополисахаридов или адгезинов (тоже служат для того, чтобы бактерия «пришвартовалась» к клетке-хозяину). Таким образом, микросателлиты делают возможными высокую генетическую и фенотипическую изменчивость. При этом область GAA-повторов Mycoplasma gallisepticum может активно меняться — как по числу повторов, так и по нуклеотидам в них. Такие изменения возникают как следствие ошибок репликации, когда часть последовательности повторов выпетливается и дуплекс ДНК оказывается как бы проскользнувшим. Свой вклад могут вносить также нарушения процессов репарации ДНК [6].
Очень интересно, что галлисептикум единовременно экспрессирует один и только один ген семейства vlhA. Ведь большинство факторов транскрипции и вообще соответствующей регуляции его редуцированный геном утратил. Как же M. gallispeticum удается менять различные режимы жизненного цикла (все та же phase variation) и переключать экспрессию семейства vlhA, оставив в положении «ВКЛ» всего один из них?
Как это работает?!
Гены vlhA, а значит, и соответствующие промоторы, разбросаны по очень небольшому геному M. gallisepticum. Размер его менее 1 млн пар оснований — снова рекордно малый. GC-состав — тоже выдающийся и равен 0,3, то есть на тугоплавкие пары нуклеотидов G—C (формирующие между собой три водородные связи) приходится менее трети. На объединенные двумя водородными связями пары A—T, как нетрудно посчитать, остается всё остальное (0,7). Система регуляции транскрипции предельно упрощена. Из факторов транскрипции — белков, связывающихся в регуляторной части гена и тем самым изменяющих его активность, — остались считанные единицы (рис. 3). Несмотря на это, данная микоплазма не просто эффективно меняет свои фазы жизненного цикла (атаковать — осваиваться — размножаться), но делает это чрезвычайно быстро [4]. В чем же ее секрет?
Итак, мы имеем немногим более 40 генов vlhA (у слабопатогенного штамма Rlow их, например, 43 [4]). Экспрессия этих генов контролируется соответствующими промоторами. Нам нужно включать то один, то другой из этих раскиданных по геному промоторов, всякий раз оставляя рабочим единственный. Первые эксперименты в этой области указывали, что активные гены семейства vlhA объединяет «черная метка» — присутствие ровно 12 тринуклеотидов GAA. И метка эта постоянно мутирует — просто в силу скачкообразной изменчивости микросателлитов. Что, в свою очередь, может влиять на то, какому гену включиться в определенный момент. Позднее выяснили, что картина несколько сложнее [4].
Размеры GAA-трека навели исследователей на мысль о некотором гипотетическом «белке Х», который может на него садиться (рис. 4). Авторы соответствующей гипотезы указывали, что его связывание должно вызывать активацию экспрессии одного из генов семейства vlhA [8]. Белок этот так и остался на бумаге — исследования в этой области не развивались.
Рисунок 4. Схематическое изображение предполагаемого белка (hemagglutinin activator protein, HAP) и место его связывания
Как иначе можно объяснить удивительно оперативную и способную «интерактивно» реагировать на иммунный ответ хозяина регуляцию транскрипции на фоне отсутствия стандартной машинерии? Мы предполагаем участие отдельного типа кодирования функции ДНК — а именно физических и структурных свойств ее двойной спирали. Нам привычно воспринимать эту молекулу как нечто «цифровое», инертное хранилище информации. И правда, кодирующие части генов состоят из триплетов, каждый из которых кодирует некоторую аминокислоту или команды вроде «начать/завершить считывание». Однако областей с такой самоочевидной функцией немного — особенно в сравнении с размером генома. В то же время регуляторные участки ДНК, то есть определяющие переключения «потока» информации при экспрессии генов реализуют свои функции иначе. В этом случае работает «код» не нуклеотидной последовательности (буквенный), а физических и структурных свойств дуплекса. ДНК, таким образом, активно и даже настраиваемо участвует в регуляторных процессах.
Для чего это нужно?
Дело в том, что регуляция потока информации от ДНК к белку, включающая ее перекодирование, воспроизведение и «текущее обслуживание» ДНК, происходит благодаря различными ДНК-связывающим белками, включая т.н. белки-катализаторы — ферменты. Такие белки нередко руководствуются не строгими «словами» в их нуклеотидной последовательности, а особенностями структуры и физики дуплекса. В этом процессе могут быть важны различные характеристики ДНК — электростатический потенциал, термодинамические свойства, склонность к изгибам и т.д. Такое разнообразие связано со сложностью и многостадийностью самого процесса транскрипции.
Соответствующие данные получены нами ранее для другого шедевра внутриклеточного паразитизма — бактериофагов группы Т7 [9], [10]. Наиболее известный и изученный за последние несколько (!) десятков лет бактериофаг Т7 интересен тем, что представляет собой «геномный каскад». Это означает, что три части крошечного генома экспрессируются последовательно, одна за другой. При этом промоторы для персональной РНК-полимеразы фага (угадайте ее размеры) очень схожи, в ряде случаев — идентичны по последовательности.
А вот физические свойства дуплекса ДНК таких промоторов сильно отличаются. Это удалось показать для электростатического потенциала, направляющего самые первые взаимодействия промотора и РНК-полимеразы. Таким образом, данный параметр важен до непосредственного сближения промотора и РНК-полимеразы. Подобную картину нам удалось описать и для другого свойства — склонности промоторных участков ДНК плавиться при скручивании. Напомним, что под плавлением ДНК понимают расхождение цепей дуплекса друг от друга. Благодаря таким резким различиям в физике очень схожих по своему «тексту» промоторов становится возможным их быстрое и точное различение, а стало быть, и смена фаз жизненного цикла фага.
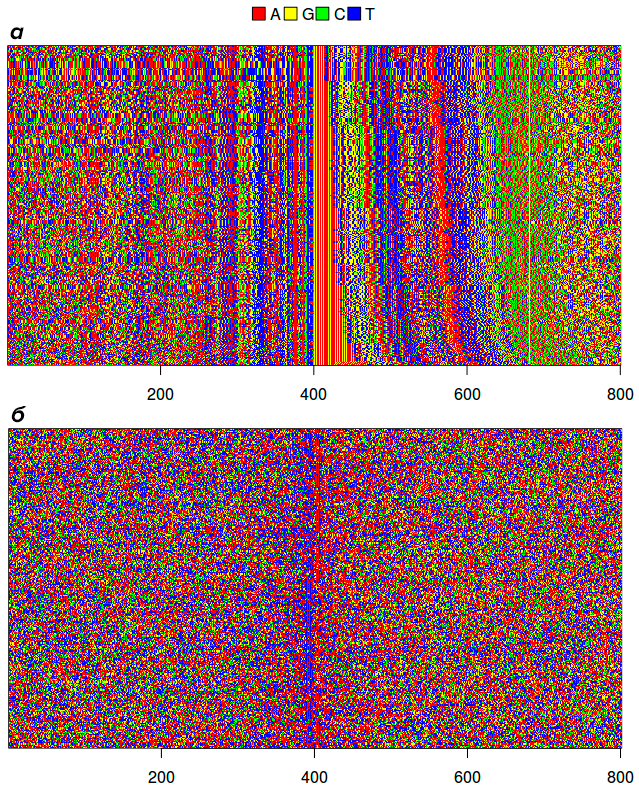
Подобное положение дел нам удалось описать и для нашего галлисептикума. С этой целью мы создали два датасета: в первый вошли промоторы vlhA из 12 различных штаммов M. gallispetium, во второй (для сравнения) — полный набор промоторов генов, не относящихся к семейству vlhA. Первым делом мы взглянули на их нуклеотидную последовательность или, как еще говорят, первичную структуру. Соответствующая визуализация последовательностей представлена на рисунке 5 (изображение оригинальное, публикуется впервые). На ней легко заметить необычно длинные консервативные участки, непосредственно прилегающие к треку GAA-повторов с обеих сторон. Их протяженность делает их уникальными для прокариот. А ведь они еще и не имеют гомологов в каких-либо других геномах!
Рисунок 5. Выравнивание для всех промоторов семейства vlhA из 12 различных штаммов M. gallisepticum (а) и полного набора прочих генов штамма S6 (б). Первые упорядочены таким образом, что имеющие более короткие GAA-треки расположены выше. Это позволяет легко различать их как желто-красную полосу. Правее них расположены области собственно промотора — ближайшая красно-синяя область (что соответствует обилию аденина и тимина). Публикуется впервые, на основе данных из [4].
В чем же особенность физических свойств этих особых промоторов? Используя методы моделирования, мы рассмотрели ряд доступных для вычислений параметров ДНК. Электростатический потенциал промоторов vlhA демонстрирует характерные паттерны в области, где ДНК связывается с промотором. Для промоторов группы «не-vlhA» таковых не наблюдается. Еще более интересным оказалось различие между этими группами по параметру с замысловатым названием — «вызванная суперспиральностью дестабилизация дуплекса ДНК» (stress-induced duplex destabilization, SIDD). Если коротко: она определяет, насколько легко ДНК плавится при определенной степени скрученности (к которой дуплекс может быть чувствителен). Промоторы группы vlhA оказались «тугоплавкими», что в целом нехарактерно для промоторов бактерий. Остальные же продемонстрировали высокую дестабилизацию, то есть стандартное легкое плавление дуплекса ДНК.
Подведем итоги: при помощи вычислений нам удалось показать существенные различия в физике между промоторами vlhA и «простыми» промоторами M. gallisepticum [4]. Что ж, теперь дело за экспериментаторами, которые помогут нам проверить и интерпретировать эти данные в «мокрых» (лабораторных) исследованиях. И выяснить назначение загадочных длинных консервативных последовательностей вокруг трека тандемных повторов.