что такое препарат второй линии
Базисное лечение ревматоидного артрита
Ревматоидный артрит – это патология аутоиммунного характера. Болезнь проявляется после 30 лет у 1% населения планеты, и разрушает суставы. Женщины болеют в 4 раза чаще мужчин.Базисное лечение ревматоидного артрита должно начинаться с появлением первых признаков заболевания. Применение комплекса препаратов и использование физиотерапевтических методик позволяет замедлить течение болезни.
Описание заболевания
Ревматоидный артрит (РА) поражает суставы. Для патологии характерно воспаление запястных и фаланговых участков, плечевые, локтевые, коленные, голеностопные и тазобедренные суставы. Системные поражения приводят к их диструкции.
Точная причина проявления патологии неизвестна. К факторам, которые способствуют прогрессу артрита, причисляют:
Заболевание запускает процесс выработки антител. Вначале макрофаги мигрируют в зону поражения синовиальной оболочки. Это становится причиной воспалительных процессов в сосудах. Макрофаги и лимфоциты продуцируют цитокины и хемокины, провоцирующие воспаление суставов. Считается, что системные проявления вызывает высвобождение энзимов и медиаторов воспаления. Это приводит к разрушению суставного хряща. В сложных случаях разрушается и кость.
Клинические проявления начинаются с утренней скованности суставов, потери аппетита и общей слабости. Наибольший прогресс РА отмечается в первый год. Поражённые суставы отекают и становятся чувствительными. Малейшее движение приносит боль. Синовиальная оболочка утолщается, а суставная капсула растягивается и деформируется.
Базисная терапия РА
Их целью является снижение воспалительных процессов, протекающих в синовиальной оболочке. Противовоспалительные препараты могут уменьшить боль и степень скованности. Они не могут изменить течения болезни. Устранить причины РА и обеспечить стойкую ремиссию такие препараты не могут. Их применяют для снятия симптоматики и замедления деструктивных процессов.
Применяемые средства делятся на разные группы.
Препараты первого ряда
Базисными препаратами для лечения ревматоидного артрита являются самые эффективные лекарственные средства. Они оказывают противоопухолевое и цитостатическое воздействие. В группу входят препараты.
Противопоказаниями к приёму могут быть нарушения в работе печени, выраженная анемия и тромбоцитопения. Не назначаются лекарства первой линии в случае выявления неконтролируемой инфекции или иммунодефицита, почечной недостаточности или гипопротеинемии. Противопоказан приём беременным и кормящим женщинам.
К побочным действиям относят повышение АД, снижение массы тела, повышение КФК, головные боли и головокружения, выпадение волос и аллергические реакции.
Препараты второго ряда
Эти медикаменты назначаются больным ревматоидным артритом в случаях, когда есть противопоказания для приёма препаратов первого ряда. В группу второй линии входят такие лекарства.
Эти препараты не используют в терапии ревматоидного артрита, если выявлены заболевания почек или сахарный диабет, декомпенсированный порок сердечной мышцы или милиарный туберкулёз. Базисные средства не применяются после обнаружения поливалентной аллергии и сильного истощения, язвенного колита и печёночной недостаточности.
Среди побочных эффектов приёма лекарств называют нефропатию, проявление дерматитов, стоматитов, анемий. При передозировке меняется состав крови, и появляется белок в моче.
В базисной терапии ревматоидной патологии препараты применяются системно на протяжении 0,5-1,5 года. Улучшение клинической картины наступает через 50-60 дней их приёма.
Симптоматические препараты
Эти средства назначают для снятия симптомов. В группу входят глюкокортикоиды и нестероидные препараты противовоспалительного действия (НПВП). Приоритетным является назначение НПВП, которые снимают боль, и увеличивают степень суставной подвижности. Лекарства блокируют синтез простагландинов (веществ, провоцирующих воспаление). В группу НПВП входят:
Если использование нестероидных противовоспалительных препаратов в течение 4-8 недель не даёт результатов, назначаются глюкокортикоиды. Гормональные препараты снимают боли, когда эксудат скапливается в суставной полости. В число препаратов входят:
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Что такое препарат второй линии
Выделяют схемы АРВТ первой, второй, третьей и т. д. линии и схемы резерва (спасения).
Также к схемам первого ряда (линии) относятся схемы, измененные вследствие развития побочных эффектов, нежелательных явлений. Таким образом можно сделать вывод, что комбинация противовирусных препаратов первой линии – это схема, которые не менялась по причине неэффективности.
Схема первой линии включает, как правило, 2 препарата нуклеозидной основы (например Тенофовир или Абакавир) и третий препарат из другой группы, с другим механизмом действия.
Этим они отличаются от схем лечения вич-инфекции, которые назначают особым категориям больных. Например, людям с когнитивными нарушениями, получающим лечение ХВГС, беременным, пациентам имеющие нарушения липидного профиля, сахарный диабет и другие.
Соответственно препараты третьей линии назначают при неэффективности схем второй.
Обычно они включают в себя препараты разных групп, подбор которых осуществляется индивидуально для каждого пациента, исходя из анализа теста на резистентность (мутаций вируса конкретного пациента), истории ранее проводимой терапии, межлекарственных взаимодействий, сопутствующих заболеваний.
Для оценки эффективности АРВТ главными показателями являются:
1. Исследование вирусной нагрузки (вирусологические критерии).
Поэтому своевременный лабораторный контроль поможет врачу правильно оценить эффективность.
2. Исследование уровня СД4 и других показателей иммунограммы (иммунологическая эффективность) – это критерии восстановления иммунной системы. Этот процесс происходит медленно и существенно зависит от степени иммунодефицита на момент начала лечения. У пациентов, начинающих лечение на фоне тяжелого иммунодефицита (CD4
Что такое препарат второй линии
Злокачественные эпителиальные опухоли яичников — солидные новообразования, чрезвычайно чувствительные к химиотерапии (ХТ) первой линии (70—80 %) с высокой частотой полных ответов. Однако у большинства больных раком яичников (РЯ) возникает рецидив, и в конечном итоге они умирают при явлениях резистентности к химиотерапии (ХТ).
Даже при применении препаратов платины 5-летняя выживаемость больных с первоначально выявленной поздней стадией заболевания составляет менее 25 %. До настоящего времени результаты химиотерапии (ХТ) второй линии при всех морфологических вариантах рака яичника (РЯ) остаются неутешительными.
При наличии эффекта от полихимиотерапии (ПХТ) первой линии после развития лекарственной резистентности практически нет шансов на существенный успех второго, третьего препаратов или их сочетаний. Иногда имеют место частичные ответы и исчезают опухолевые выпоты, но это длится недолго. Тем не менее большинство онкогинекологов применяюттерапию второй линии активными препаратами, не использовавшимися в первой схеме лечения.
Есть надежда, что со временем появятся эффективные препараты второй и третьей линий. В настоящее время XT второй линии не рекомендована к широкому применению. У каждого опытного онкогинеколога есть группа пациенток, не реагирующих на XT первой линии, с хорошим эффектом от повторной операции при локальном или регионарном рецидиве заболевания. Так часто бывает при выявлении локальной опухоли во время лапаротомии «second-look» или после длительного безрецидивного периода.
Чувствительность к производным платины (устойчивая реакция на терапию первой линии на основе препаратов платины) — прогностический показатель ответа на терапию второй линии, содержащую цитостатик с этим элементом. Ответ на первичное лечение и безрецидивный промежуток более 6 мес. — показатель чувствительности к препаратам платины.
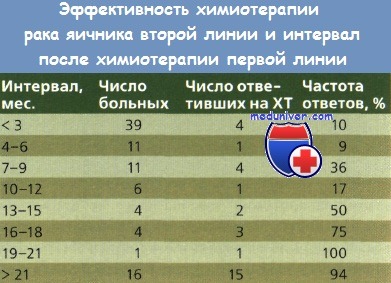
При прогрессировании или стабилизации заболевания, а также при возникновении рецидива в течение 6 мес. после начала первичной XT на основе препаратов платины опухоли расценивают как платинорезистентные. Эффективность терапии в этих двух группах пациенток различна. Blackledge и соавт. проанализировали данные обследования 92 пациенток, получавших пять разных режимов терапии второй линии, и установили, что перерыв в лечении препаратами платины был устойчивым фактором прогноза эффективности лечения.
Это наблюдение было одинаково верным для схем второй линии как на основе препаратов платины, так и без них. У пациенток с перерывом в лечении менее 6 мес. частота противоопухолевого ответа составила менее 10 %, с ростом этого промежутка до более 21 мес. этот показатель увеличился до 90 %.
Seltzer и соавт. сообщили, что у 11 пациенток с полным ответом на химиотерапию (XT) первой линии на основе платины эффективность терапии второй линии составила 72 %, включая 36 % полных ответов. Согласно данным Markman и соавт., у больных, не получавших химиотерапию (XT) более 24 мес, частота ответа на цисплатин равняется 77 %, а при перерыве влечении втечение 5—12 мес. — 27 %.
Eisenhauer и соавт. сообщили о частоте объективного ответа на карбоплатин 43 % у пациенток, не получавших химиотерапию (XT) более 2 мес, а при перерыве в лечении до 2 мес. — 10 %. Эти данные указывают на необходимость тщательного отбора пациенток для проведения химиотерапии (XT) второй линии. Для II фазы исследования требуется достаточная выборка пациенток с чувствительностью и резистентностью к препаратам платины.
Кроме того, нужно стратифицировать больных в зависимости от протяженности интервала между химиотерапией (XT) первой и второй линий. В целом для II фазы исследования ожидаемая эффективность активных средств химиотерапии (XT) в группе пациенток, чувствительных к препаратам платины, составляет более 25—30 %, а в платинорезистентной — более 10 — 15 %.
Эффективность карбоплатина в качестве второй линии терапии рака яичника (РЯ) составила 14—38 % с частотой полных ответов 25—50 %. У пациенток с рефрактерностью к цисплатину и алкилирующим препаратам частота ответов равнялась 6—13 %, в случаях предшествующей эффективной терапии цисплатином — 31 %, у нелеченных больных (неудачная ЛТ) — 45 %. Если болезнь прогрессирует во время лечения цисплатином, то объективный ответ на карбоплатин не наблюдается.
Стандартная доза паклитаксела эффективна у 22—23 % пациенток с платинорезистентной опухолью. Kohn и соавт. изучали эффективность высоких доз паклитаксела, требующих поддержки гемопоэза, у пациенток с платинорезистентным заболеванием: частота ответов отмечалась в 48 % случаев. Но, как и при применении других препаратов, длительность их была короткой. Тем не менее паклитаксел — основной препарат терапии второй линии при платинорезистентном раке яичника (РЯ).
Значимость интенсивности дозы анализируют в рандомизированных исследованиях во всем мире; полученные результаты позволят точно определить дозировку паклитаксела для комбинированных режимов лечения первой и второй линий.
В последние 10 лет для лечения рецидивного рака яичника (РЯ) наибольший интерес представляют три препарата: гемцитабин, пегилированный липосомный доксорубицин и топотекан. Поскольку эти препараты оказались эффективными, их также включили в клинические исследования терапии первой линии.
GOG сообщила о положительных результатах II фазы исследования эффективности лечения топотеканом (5 дней по 1,5 мг/м 2 с интервалом 21 день): частота ответов составила 33 %, медиана выживаемости — 11,2 мес. Основными побочными эффектами были недомогание, анемия и тромбоцитопения. Сейчас большинство онкологов используют недельный режим применения топотекана, назначая 3,5—4 мг/м2 в 1, 8 и 15-й дни 28-дневного цикла.
Gordon и соавт. сообщили о III фазе исследования эффективности пегилированного липосомного доксорубицина (Доксил) по 50 мг/м 2 каждые 28 дней и топотекана по 1,5 мг/м2 в сутки в течение 5 дней каждые 21 день при лечении рефрактерного РЯ. В группе пациенток с резистентностью к препаратам платины различий в выживаемости не отметили. При лечении пегилированнным липосомным доксорубицином больных, чувствительных к препаратам платины, риск смерти снизился на 30 %; медиана выживаемости равнялась 108 и 70 нед. соответственно.
Эффективность монотерапии рефрактерных опухолей гемцитабином невелика, при комбинации с препаратом платины, обычно цисплатином, она возрастает. Nagourney и соавт. сообщили о результатах лечения цисплатином (30 мг/м 2 ) и гемцитабином (600—750 мг/м 2 ) в 1-й и 8-й дни каждые 21 день: частота полных ответов составила 26 %, частичных — 44 % (общая частота ответов 70 %), медиана времени до возникновения прогрессирования у больных, ответивших на лечение, — 7,9 мес. (диапазон 2,1 — 13,2 мес). Токсичность проявлялась в виде нейтропении, анемии, тромбоцитопении, тошноты, рвоты и периферической нейропатии. Имеются данные о способности гемцитабина устранять резистентность к цисплатину.
В настоящее время главная проблема лечения рефрактерного рака яичника (РЯ) заключается в выборе режима лечения: последовательная монотерапия или ПХТ. По данным двух европейских отчетов, ПХТ предпочтительнее. В одном исследовании (ICON4/AGO-OVAR 2,2) участвовало более 800 пациенток. Вся группа была с высокой платиночувствительностью, более чем у 75 % больных перерыв в лечении превышал 12 мес. При медиане наблюдения 42 мес. анализ показал, что 2-летняя выживаемость при ПХТ составила 57 %, при лечении только препаратом платины — 50 %, медиана общей выживаемости — 29 и 24 мес. соответственно.
Это исследование, представляющее множество параллельных клинических испытаний, проведенных разными группами в 119 клиниках 5 стран, подвергли критике. В качестве препарата платины использовали цисплатин или карбоплатин; лечение проводили ежемесячно. Немало больных раньше не получали таксаны. Исход заболевания, как оказалось, не зависел от того, получали они таксаны во время химиотерапии (XT) первой линии или нет.
В США большинство больных раком яичника (РЯ) получают первичное лечение таксанами и карбоплатином, поэтому перенос результатов и опыта этого исследования на женщин США сомнителен. По данным других, менее крупных исследований, в т. ч. испанского (GEICO), ПХТ рефрактерного рака яичника (РЯ) может улучшить результат. Тем не менее пациенткам с безрецидивным промежутком более 12 мес. предпочитают назначать химиотерапию (XT) второй линии с комбинацией таксанов и препаратов платины.
Другая стратегия удлинения перерыва в применении препаратов платины состоит в лечении рецидивов другими препаратами, например пегилированный липосомным доксорубицином и топотеканом. Сейчас широко применяется повторное лечение производным платины, часто в комбинации с гемцитабином, либо таксанами в сочетании с таргетным средством.
Другие препараты (гексаметилмеламин, 5-фторурацил, этопозид) редко вызывают умеренные кратковременные ответы на терапию.
Интраперитонеальная химиотерапия (ХТ), которая обсуждалась в этой статье на сайте, с применением нескольких цитостатиков также используется в качестве второй линии лечения рака яичника (РЯ). Эффективность этого метода химиотерапии (ХТ) ограничена наличием остаточных небольших опухолей (максимальный диаметр менее 0,5 см). Однако без проведения III фазы рандомизированных исследований трудно оценить окончательное влияние па выживаемость, хотя есть отдельные сообщения о длительной безрецидивной выживаемости (> 4 лет) после интраперитонеальной терапии рефрактерных опухолей малого объема.
Данных о длительной эффективности терапии второй линии при раке яичника (РЯ) недостаточно; есть сообщения только об умеренных кратковременных ответах. Кроме того, в исследованиях отсутствует ясное определение ключевых терминов — «платиночувствительности» и «платинорезистентности». В будущем необходимо четко выделить эти группы пациенток и обсудить возможность установления критериев паклитаксел-чувствительных и пакситаксел-рефрактерных опухолей. Чувствительность к препаратам платины — хорошая основа экспериментальных исследований цитотоксических механизмов действия комбинаций цитостатиков на основе препаратов платины, их дозировок и режима введения.
Резистентность к этим препаратам заставляет искать новые подходы к изучению лекарственной устойчивости. У пациенток с минимальным размером опухоли по данным операций «second-look» применяли облучение брюшной полости с бустерным воздействием на область таза. По данным некоторых исследований, за непродолжительное время наблюдения 30 % больных оставались в состоянии ремиссии. Однако по нашему опыту длительного наблюдения, даже в этой оптимальной группе более чем у 90 % пациенток появится рецидив, вероятно, это связано с перекрестной устойчивостью клеток к облучению и химиотерапии (XT). Кроме того, после многочисленных операций и облучения возрастает риск кишечной непроходимости.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
PsyAndNeuro.ru
Лечение генерализованного тревожного расстройства
Распространенность генерализованного тревожного расстройства (ГТР) – 6 %. Медианный возраст начала заболевания – 31 год, средний возраст начала заболевания – 32,7 лет. Распространенность у детей – 3 %, у подростков – 10,8 %. Возраст начала заболевания у детей и подростков – между 10 и 14. Есть данные, указывающие на то, что у женщин ГТР встречается в 2-3 раза чаще по сравнению с мужчинами, а также на то, что ГТР чаще заболевают пожилые люди. Это расстройство часто остается нераспознанным и менее чем треть пациентов получает адекватное лечение. Положение осложняется тем, что, возможно, надо разделять ГТР у детей и ГТР у взрослых. Скачать файл рекомендаций целеком можно по ссылке.
ГТР связано с функциональными нарушениями и ухудшением качества жизни. При первичном обращении к врачу 60-94 % пациентов с ГТР жалуются на болезненные физические симптомы и в 72 % случаев именно это становится причиной для поиска врачебной помощи.
Представляем вашему вниманию обзорный перевод клинических рекомендаций по лечению генерализованного тревожного расстройства, составленных экспертами Канадской ассоциации тревожных расстройств. Перевод подготовлен совместными усилиями научного интернет-портала «Психиатрия & Нейронауки» и Клиники психиатрии «Доктор САН» (Санкт-Петербург).
Коморбидность
ГТР ассоциируется с высоким уровнем коморбидных психических расстройств, в числе которых тревожные расстройства и большое депрессивное расстройство. Также повышен риск соматических заболеваний, включая болевые синдромы, гипертонию, проблемы с сердечно-сосудистой системой и желудком. Наличие коморбидной депрессии повышает степень тяжести болезни.
Диагноз
ГТР характеризуется повышенной тревогой и волнением (большую часть дней в течение последних шести месяцев) по поводу разнообразных событий и видов деятельности, например учебы или работы. Кроме того, ГТР ассоциируется с неусидчивостью, мышечным напряжением, усталостью, проблемами с концентрацией, раздражительностью и нарушениями сна.
Критерии DSM-5 для постановки диагноза ГТР
Психологическая помощь
Мета-анализы определенно показывают, что КПТ значительно ослабляет симптомы ГТР. В небольшом количестве исследований сравнивалось действие КПТ и фармакотерапии, которые показали примерно одинаковую силу эффекта. Индивидуальная и групповая психотерапия одинаково эффективно ослабляют тревожность, но индивидуальная психотерапия может быстрее снижать беспокойство и ослаблять депрессивные симптомы.
Интенсивность психотерапии была оценена в мета-анализе 25 исследований. Для ослабления тревожности курс психотерапии длительностью меньше восьми сессий так же эффективен как и курс длительностью больше восьми сессий. Для ослабления волнения и депрессии более интенсивные курсы эффективнее, чем курсы с небольшим количеством сессий. Несколько исследований показали пользу ИКПТ.
Мета-анализ не нашел значительной разницы между действием КПТ и релаксационной терапией. Однако более современные исследования говорят об ограниченной эффективности релаксационной терапии. Масштабное РКИ показало, что бальнеотерапия, релаксационная терапия со спа-процедурами, лучше чем СИОЗС снижает тревожность; однако есть сомнения в правильности проведения исследования.
Доказана эффективность поведенческой психотерапии, основанной на принятии, метакогнитивной психотерапии, КПТ, нацеленной на исправление восприятия неопределенности, основанной на осознанности когнитивной терапии.
Психодинамическая психотерапия тоже может дать результат, но на данный момент ясных доказательств ее эффективности нет.
Добавление к КПТ интерперсональной и эмоционально-процессуальной терапии не дает существенных преимуществ в сравнении с КПТ без добавлений. Предварительная беседа до начала курса КПТ помогает уменьшить сопротивление терапии, улучшить комплайенс – такая стратегия особенно полезна в тяжелых случаях.
Комбинация психотерапии и фармакологического лечения
Доступно немного данных об использовании комбинации психотерапии и фармакологического лечения. Мета-анализ показал, что комбинация фармакологического лечения с КПТ действует эффективнее чем одна КПТ, если сравнивать результаты сразу после курса лечения, но не через шесть месяцев. Доступны данные исследований, сравнивавших комбинацию диазепама или буспирона плюс КПТ с одной КПТ. Небольшое количество исследований, сравнивавших фармакотерапию с фармакотерапией, к которой добавили психотерапию, дают противоречивые результаты.
На данный момент нет обоснований для комбинирования КПТ с фармакотерапией. Но, как и в случае с другими тревожными расстройствами, если пациенту не становится лучше после КПТ, рекомендуется использование фармакотерапии. Подобным образом, если не становится лучше от фармакотерапии, то можно ждать эффекта от КПТ. Мета-анализ и несколько РКИ говорят о сохранении результатов психотерапии в течение 1-3 лет после лечения.
Фармакологическое лечение
При лечении ГТР доказана эффективность СИОЗС, СИОЗСиН, ТЦА, бензодиазепинов, прегабалина, кветиапина XR.
Первая линия
Антидепрессанты (СИОЗС и СИОЗСиН): РКИ доказывают эффективность эсциталопрама, сертралина и пароксетина, а также дулоксетина и венлафаксина XR. Эффективность СИОЗС и СИОЗСиН одинакова. Есть данные, что эсциталопрам менее эффективен, чем венлафаксин XR или кветиапин XR.
Другие антидепрессанты: Есть доказательства того, что агомелатин так же эффективен, как эсциталопрам.
Прегабалин: Эффективность прегабалина такая же, как у бензодиазепинов (уровень доказанности 1).
Вторая линия
Бензодиазепины: Доказана эффективность алпразолама, бромазепама, диазепама и лоразепама (уровень доказанности 1). Хотя уровень доказанности высокий, эти препараты рекомендуются как лечение второй линии и обычно для краткосрочного применения из-за побочных эффектов, зависимости и синдрома отмены.
ТЦА и другие антидепрессанты: Имипрамин в лечении ГТР так же эффективен как бензодиазепины (уровень доказанности 1). Но из-за побочных эффектов и потенциально токсичной передозировки, имипрамин рекомендуется как средство второй линии. Данных о бупропионе XL немного, но есть исследование, в котором он показал такую же эффективность как эсциталопрам (средство первой линии), поэтому его можно использовать как средство второй линии.
Вортиоксетин, так называемый серотониновый модулятор, воздействует на разные серотониновые рецепторы. Результаты исследований эффективности вортиоксетина противоречивы, но есть данные в пользу за того, чтобы использовать его при ГТР.
Кветиапин XR: Эффективность кветиапина XR доказана и эквивалентна эффективности антидепрессантов. Но прием кветиапина связан с набором веса, седацией и более высоким по сравнению с антидепрессантами уровнем отказа от лечения из-за побочных действий. Из-за проблем, связанных с переносимостью и безопасностью атипичных антипсихотиков, этот препарат рекомендуется как средство второй линии для пациентов, которые не могут принимать антидепрессанты или бензодиазепины.
Другие препараты: Буспирон в нескольких РКИ показал такую же эффективность как бензодиазепины. Для сравнения буспирона с антидепрессантами недостаточно данных. Из-за недостаточной эффективности в клинической практике буспирон следует отнести к препаратам второй линии.
Гидроксизин показал эффективность близкую к эффективности бензодиазепинов и буспирона, но клинического опыта применения этого препарата при ГТР недостаточно.
Третья линия
К препаратам третьей линии отнесены лекарства с плохо исследованной эффективностью, побочными эффектами, редко применяемые в качестве первичного лечения ГТР.
Добавочные препараты
Стратегия использования добавочных препаратов изучалась на пациентах, не давших адекватный ответ на лечение СИОЗС, и может быть применена в случаях резистентного ГТР.
Добавочные препараты второй линии: Прегабалин к качестве дополнения к основному препарату показал эффективность при лечении пациентов, не давших ответа на предыдущее лечение (уровень доказанности 2).
Добавочные препараты третьей линии: Мета-анализ не показал улучшений при применении атипичных антипсихотиков как добавочных препаратов, но зато показал повышение частоты обрыва лечения. Противоречивые результаты показывают исследования эффективности рисперидона и кветиапина в качестве дополнительных препаратов.
Из-за слабо доказанной эффективности, риска набора веса и метаболических побочных эффектов, атипичные антипсихотики нужно оставить для резистентных случаев ГТР и, за исключением кветиапина XR, использовать только как дополнение к основному препарату.
Препарат
Уровень доказанности
| Первая линия: Агомелатин, дулоксетин, эсциталопрам, пароксетин, прегабалин, сертралин, венлафаксин Вторая линия: Алпразолам*, бромазепам*, бупропион, буспирон, диазепам, гидроксизин, имипрамин, лоразепам*, кветиапин*, вортиоксетин Третья линия: Циталопрам, дивалпроекс, флуоксетин, миртазапин, тразодон Добавочные препараты (вторая линия): Прегабалин Добавочные препараты (третья линия) : Арипипразол, оланзапин, кветиапин, рисперидон Не рекомендованы как добавочные препараты: Зипрасидон Не рекомендованы: Бета-блокаторы (пропранолол), pexacefront, тиагабин *У этих препаратов свои механизмы действия, эффективность и профиль безопасности. В числе препаратов второй линии в большинстве случаев лучше использовать бензодиазепины, если нет риска злоупотреблений; бупропион XL лучше отложить на потом. Кветиапин XR – хороший выбор, если говорить об эффективности, но, учитывая метаболические проблемы, связанные с атипичными антипсихотиками, его лучше оставить для пациентов, кому невозможно назначить антидепрессанты или бензодиазепины. |
Поддерживающая фармакологическая терапия
Мета-анализ показал, что продолжительный прием СИОЗС (6-12 месяцев) эффективно предотвращает рецидив (отношение шансов рецидива = 0,20).
Рецидив после 6-18 месяцев приема дулоксетина, эсциталопрама, пароксетина и венлаяаксина XR отмечался в 10-20 % случаев, по сравнению с 40-56 % в контрольной группе. Продолжение приема прегабалина и кветиапина XR также предотвращает рецидив через 6-12 месяцев.
Долгосрочные РКИ показали, что эсциталопрам, пароксетин и венлафаксин XR помогают сохранять положительный результат в течение шести месяцев.
Биологические и альтернативные виды лечения
В целом эти виды лечения могут быть полезны для некоторых пациентов, но данных пока мало.
Биологическая терапия: Одно небольшое исследование показало, что рТМС эффективна в качестве монотерапии и дополнения к СИОЗС (уровень доказанности 3).
Альтернативная терапия: Лавандовое масло (уровень доказанности 1) и экстракт гальфимии глаука (уровень доказанности 2) показали эффективность сравнимую с эффективностью лоразепама. Кокрейновский мета-анализ говорит о двух исследованиях, показывающих, что страстоцвет так же эффективен как бензодиазепины (уровень доказанности 2) и одно исследование, не обнаружившее эффекта валерианы. К сожалению, травяные препараты плохо стандартизированы и существенно различаются в доле активного вещества, поэтому рекомендовать их нельзя.
РКИ эффективности силовых упражнений или аэробных упражнений как добавления к основному лечению показало значительное ослабление симптомов (уровень доказанности 2). Обзор исследований эффективности акупунктуры показал, что все исследования говорят о наличии положительного эффекта, но из-за методологических особенностей исследований, эффективность этого вида лечения нельзя считать доказанной. Есть исследования, говорящие о том, что при лечении ГТР могут быть полезны медитация и йога (уровень доказанности 3).
Нерекомендованная альтернативная терапия: Терапия ярким светом не улучшает состояние при ГТР (уровень доказанности 2).
Автор перевода: Филиппов Д.С.
Источник: Katzman et al. : Canadian clinical practice guidelines for the management of anxiety, posttraumatic stress and obsessive-compulsive disorders. BMC Psychiatry 2014 14 (Suppl 1):S1.