что такое потенциал ионизации атома
Энергия ионизации и ее потенциал
Дата публикации: 20 октября 2020
Ионы
С греческого ión переводится как идущий.
Ионы-это частицы с положительным или отрицательным зарядом, в которые превращаются атомы или группы атомов при потере или присоединении электронов, или других заряженных частиц.
Первым ввел термин Ионы М.Фарадей в 1834 году. Он изучал действие электрического тока на растворы щелочей, кислот, солей и выдвинул предположение, что электропроводность этих растворов обусловлена движением ионов.
Ионы могут быть:
Они могут быть:
Величина заряда иона зависит от количества присоединенных или потерянных частиц.
В растворе или расплаве электролита их движение хаотично и лишь при пропускании электрического тока через раствор или расплав их движение становится направленным. К катоду (отрицательно заряженный электрод) движение осуществляют положительно заряженные ионы (катионы). К катионам относятся ионы металлов, водорода и ион амония(K+,Na+,Fe2+,H+,NH4+). А к аноду (положительно заряженный электрод) движутся отрицательно заряженные ионы(анионы). К анионам относятся ионы кислотных остатков, гидрокси-ион и другие(NO3-,Cl-,OH-).
Все растворы электролитов электронейтральны, потому что сумма зарядов анионов и катионов равны между собой.
Ионы в составе молекул вещества
Ионы могут быть в составе молекул различных веществ.
Ионы можно встретить как самостоятельные частицы во всех агрегатных состояниях веществ:жидкостях, кристаллах, газах.
В газах
В природных условиях ионы образуются при разряде молнии, от солнечных лучей и космического излучения.
Ионы в организме
Ионы в организме живых существ выполняют множество различных функций: обусловливают механизм проникновения клеточных мембран, регулируют сокращения мышечных волокон, способствуют проведению импульса возбуждения по нервным волокнам и др. Состояние диссоциации и ассоциации ионов в молекулы в тканевых жидкостях и клетках организма поддерживается на определенном уровне в норме. Но при некоторых состояниях может смещаться.
Энергия ионизации
Энергия ионизации — это наименьшая энергия, которую нужно затратить для удаления электрона из свободного атома.
Ее иногда называют первый ионизационный потенциал. Потенциал ионизации связан с энергией ионизации. Обозначается потенциал ионизации буквой U. Измеряется в В(вольтах).
Зависимость энергии ионизации с потенциалом ионизации выражается по формуле:
Величина энергии ионизации является внутренним свойством и не имеет отношения к способу ионизации. Потенциал ионизации- исторически полученная величина при первом методе ионизации электронным ударом.
Что такое ионизационные потенциалы
Ионизационный потенциал или потенциал ионизации — это та работа, которую нужно потратить, чтоб оторвался электрон от атома и при этом был удален на бесконечно большое расстояние (т. е. таким образом, чтоб не попадал под действие положительно заряженного ядра).
Потенциалы ионизации бывают:
Проще и легче отщепить от атома первый электрон. Для отрыва следующих электронов потенциал ионизации будет расти т. к. увеличится свободный заряд иона, притягивающего электроны.
Отщепить первый электрон труднее всего у инертных газов, потому что их замкнутые электронные оболочки обладают исключительной стабильностью. Соответственно второй и третий электроны будет оторвать еще сложнее.
Легче всего отщепить первый электрон у атомов щелочных металлов т. к. он единственный валентный электрон.
В одной подгруппе электрон будет иметь наименьшую связь и более легко отрываться, чем выше у него порядковый номер. Имея аналогичную электронную структуру атому проще потерять электрон в том случае, если он находится дальше от положительно заряженного ядра.
При наименьшем ионизационном потенциале атома произойдет наиболее легкая отдача электрона.
Еще одной важной характеристикой атома является сродство к электрону.
Сродство к электрону — это величина энергии, которая выделяется или поглощается при присоединении электрона к свободному атому и превращении его в отрицательный ион.
Легче всего электроны присоединяют к себе те атомы, которые достраивают внешнюю орбиту т. е. по конфигурации похожи на благородные газы. К таким элементам можем отнести те, у которых на внешней оболочке от 4 до 7 электронов. Легче всего отдают электроны атомы элементов, у которых после отдачи электрона остается восьмиэлектронная оболочка. Это элементы, у которых на наружной оболочке находится 1,2 или 3 электрона.
Нет зависимости величины сродства элемента к электору и его ионизационного потенциала. Это означает, что сродство элемента к электрону не будет больше при его большем ионизационном потенциале. На эту величину сильное влияние оказывает структура электронной оболочки атома. Например, при высоком ионизационном потенциале инертных газов у них большая устойчивость структуры электронных оболочек, по этой же причине очень маленькое сродство к электрону.
Вам нужно войти, чтобы оставить комментарий.
ПОТЕНЦИАЛ ИОНИЗАЦИИ
ПОТЕНЦИАЛ ИОНИЗАЦИИ частицы (молекулы, атома, иона), минимальная разность потенциалов U, к-рую должен пройти электрон в ускоряющем электрич. поле, чтобы приобрести кинетич. энергию, достаточную для ионизации частицы. Потенциал ионизации частицы X с образованием частицы X’ соответствует процессу:
Более общее понятие-энергия ионизации Е, миним. энергия, необходимая для удаления электрона из частицы на бесконечность. Она связана с потенциалом ионизации соотношением:
где е-элементарный электрич. заряд. Энергия ионизации является св-вом частицы и не зависит от способа удаления электрона, тогда как потенциал ионизации, строго говоря, лишь характеристика исторически первого метода ионизации электронным ударом (см. Ионы в газах). Энергия ионизации, выраженная в эВ, численно совпадает с потенциалом ионизации, выраженным в В.
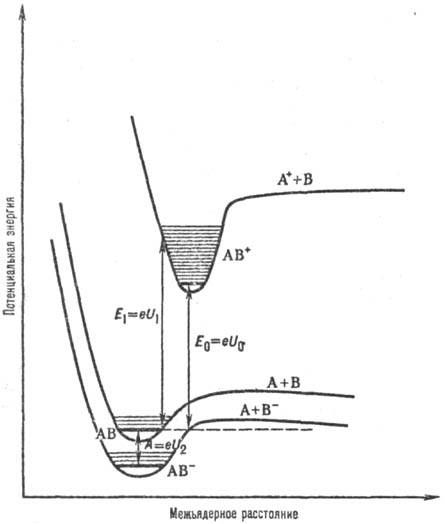
Для атомов понятия первого, второго и т. д. потенциала ионизации относят к ионизации невозбужденного атома с образованием невозбужденного положит. иона. Для молекул различают адиабатический потенциал ионизации и вертикальные потенциалы ионизации Адиабатический потенциал ионизации отвечает процессу, при к-ром из молекулы, находящейся в основном состоянии, в результате ионизации образуется положит. мол. ион также в основном состоянии. Вертикальные потенциалы ионизации характеризуют ионизацию молекул, при к-рой образующийся мол. ион может находитья в произвольном энергетич. состоянии (электронном и колебательном), причем соответствующие квантовые переходы происходят без изменения межъядерных расстояний (рис. 1).
Возможно термодинамич. определение потенциала ионизации атомов и адиабатического потенциала ионизации молекул через стандартную энтальпию D H 0 р-ции X
D H 0 = N A E = N A Ue,
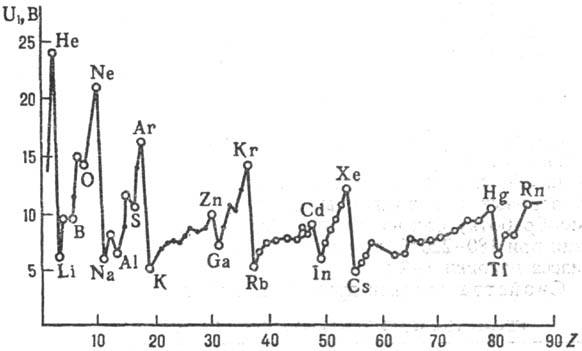
Первые потенциалы ионизации известны для атомов всех элементов перио-дич. системы и нсск. тыс. молекул. У легких атомов с зарядом ядра Z
Рис. 2. Зависимость первых потенциалов ионизации U 1 атомов хим. элементов от атомного номера Z.
В кон. 70-х гг. 20 в. обнаружены т. наз. суперщелочи-молекулы с экстремально низкими значениями потенциалов ионизации: ОК 4 (3,62 В), ОК 3 (3,65 В), ClNa 2 (4,15 В) и др.
При переходе от валентных электронов атома к остовным потенциал ионизации резко увеличивается. Так, для Be U 1 9,320 В, U 2 18,206 В, U 3 153,850 В.
Квантовомех. расчеты потенциалов ионизации для атомов, двух- и трехатомных молекул дают значения, близкие по точности к экспериментальным. Точность расчета в целом зависит от метода; так, для многоатомных молекул в рамках метода мол. орбиталей она обычно не превышает 1 эВ (см. Купманса теорема).
П отенциал ионизации вместе со сродством к электрону определяет величину электроотрицательности атомов и молекул. Знание потенциалов ионизации необходимо для расчетов термохим. процессов в иони-зир. газах и плазме (газоразрядные приборы, магнитогид-родинамич. генераторы, процессы в верх. слоях атмосферы и т.п.).
Лит.: Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. Справочник, под ред. В. Н. Кондратьева, М., 1974; Аллен К. У., Астрофизические величины, пер. с англ., М., 1960; Степанов Н. Ф., Пу-пышев В. И., Квантовая механика молекул и квантовая химия, М., 1991.
Что представляет ионизация
Почти вся теоретическая химия, связанная с атомными и молекулярными реакциями, является квантовой физикой, которая изучает энергетические изменения, связанные с электронами. Важным понятием, связанным с электронами, является определение что такое ионизация.

Чтобы освободиться от силы притяжения атомного ядра, электрону требуется энергия, которая может поступать из внешних источников. Если этой энергии окажется достаточно образуются ионы.
Ионы-это атомы, которые получили или потеряли электроны.
Процесс расщепления молекул вещества на положительные и отрицательные ионы при растворении вещества называется ионизацией.
Ионизация является эндотермической, то есть атом или молекула увеличивает свою внутреннюю энергию (берет из внешнего источника). Для каждого атома химического элемента, уровни этой энергии для каждой атомной орбитали отличаются.
Что необходимо для процесса расщепления
Для процесса расщепления молекул вещества с образованием ионов необходима энергия ионизации, ионизационный потенциал. Определяется как общее количество энергии, необходимой для освобождения электрона, который вращается во внешней оболочке любого атома.
Кроме того, химики также определяют его как полную энергию, необходимую для освобождения одного моля электронов от одного моля конкретного атома.
В физике предпочитают использовать электронвольты (eV, эВ) на атом, как единицу для потенциала ионизации, в то время как в химии измеряется в терминах кДж/моль (килоджоулей на моль). Например, энергия ионизации водорода 13,5984 эВ (1310 кДж/моль).
Чем ниже энергия, тем выше тенденция атома становиться восстановителем и более реактивным он является. С другой стороны, чем выше энергия ионизации, тем выше тенденция становиться окислителем и менее реактивным.
Энергия, необходимая для выделения одного электрона из внешней энергетической оболочки атома, известна как первый потенциал ионизации, в то время как энергия, необходимая для освобождения от второго, известна как второй потенциал ионизации. Второй потенциал ионизации всегда выше первого. Это происходит потому, что, чем больше убирается электронов из его внешних оболочек, тем сильнее атом удерживает остальные, которые остались.
Сейчас мы подробно поговорим что такое ионизация в процессе.
Процесс образования ионов на примере
Чтобы понять процесс ионизации, рассмотрим структуру хлорида натрия. Хлорид натрия — это поваренная соль которую мы используем в нашей повседневной жизни. Атомные номера Na и Cl равны 11 и 17 соответственно. Это означает, что атом натрия имеет 11 и атом хлора имеет 17 электронов на своих орбитах.
Атом Na имеет только один электрон на своей внешней орбите. В то время как хлор содержит семь на своей внешней орбите. Но мы знаем, что для стабильности атомы обычно требуют восемь электронов на своей внешней орбите. Таким образом, оба указанных атома химически активны. Когда эти атомы собраны вместе, атом Na теряет свои самые внешние электроны, становится положительно заряженным, а атом Cl получает один электрон и становится отрицательно заряженным. Так как атомы получают восемь электронов в их внешней орбиты путем их обмена. Между Na и Cl действует электростатическая сила между и они совместно сделали одну молекулу NaCl.
Как отмечается, ионные связи возникают, когда металл связывается с неметаллом, и эти связи чрезвычайно прочны.
Ионные соединения и твердые тела
Не только соль сформирована ионным скреплением. Соль также пример ионного твердого тела или кристаллического твердого тела которое содержит ионы.
Кристаллический солидис: тип твердого тела в котором составные части аранжированы в простой, определенной геометрической картине которая повторена во всех направлениях.
Существует три типа кристаллического твердого вещества: молекулярное твердое (например, сахароза или столовый сахар), в котором молекулы имеют нейтральный электрический заряд; атомная твердые (алмаз, например, из чистого углерода); и ионные твердые.
Соль не образуется из обычных молекул, как вода или углекислый газ. Внутреннюю структуру соли можно представить в виде повторяющейся серии хлоридных анионов и катионов натрия, плотно упакованных друг с другом, как апельсины в ящике.
Эта плотная упаковка положительных и отрицательных зарядов помогает сформировать плотное скрепление, и поэтому соль необходимо нагреть до высокой температурой прежде чем она расплавится. Твердая соль не проводит электричество, но расплавленная, она становится весьма хорошим проводником. Когда она твердая, ионы плотно упакованы, и таким образом не способствуют движению электрических зарядов; но когда структура нарушена путем плавления или растворения в чем либо движение ионов возможно.
Энергия для процесса
Вода не является хорошим проводником, хотя она, безусловно, позволит протекать через нее электрическому току, поэтому опасно эксплуатировать электроприбор вблизи воды.
Соль при расплавлении становится хорошим проводником, но этого можно добиться и растворением ее в воде.
На примере поваренной соли видно что такое ионизация. Однако это один из видов ионизации, который может быть определен как процесс, в котором один или несколько электронов удаляются из атома или молекулы, чтобы создать ион, или процесс, в котором ионное твердое вещество, такое как соль, диссоциирует на его компонентные ионы при растворении в растворе.
Количество энергии, необходимое для достижения ионизации, называется энергией ионизации или потенциалом ионизации.
Когда атом находится на своем нормальном энергетическом уровне, говорят, что он находится в основном состоянии. В этот момент электроны занимают свои нормальные орбитальные структуры. Между электроном и положительно заряженным ядром, в котором находятся протоны, всегда существует высокая степень притяжения. Энергия, необходимая для перехода электрона на более высокую орбиталь увеличивает общую энергию атома, который находится в возбужденном состоянии.
Возбужденное состояние атома — это просто шаг на пути к его ионизации путем удаления электрона. «Шаг» является подходящей метафорой, потому что электроны не просто дрейфуют вдоль континуума от одного энергетического уровня к другому, как человек поднимается по лестнице. Они делают дискретные шаги, как человек взбирается по лестнице или трапу. Это один из ключевых принципов квантовой механики, передовой области физики, которая также имеет многочисленные приложения к химии. Подобно тому, как говорится о внезапном изменении как о «квантовом скачке», электроны совершают квантовые скачки с одного энергетического уровня на другой.
Из-за высокого притяжения между электроном и ядром первый удаляемый электрон находится на самой внешней орбите. Это количество энергии называется первой энергией ионизации. Удалить второй электрон будет значительно сложнее, так как теперь атом является катионом, а положительный заряд протонов в ядре больше отрицательного заряда электронов. Следовательно, энергия, необходимая для удаления второго электрона намного выше, чем первая.
Образование ионов элементов и соединений
Существуют уровни энергии ионизации для элементов, хотя следует отметить, что водород, поскольку имеет только один электрон, имеет только первую энергию ионизации. Как правило, показатели увеличиваются слева направо вдоль периода или строки периодической таблицы и уменьшаются сверху вниз вдоль столбца или группы.
Причина, по которой энергия ионизации увеличивается вдоль периода, заключается в том, что неметаллы в правой части таблицы имеют более высокую энергию, чем металлам, которые находятся на левой стороне. Величина уменьшается вдоль группы, потому что элементы ниже в таблице Менделеева имеют более высокие атомные номера, что означает больше протонов и, следовательно, больше электронов. Поэтому им легче отказаться от одного из своих электронов, чем от элемента с более низким атомным номером — так же, как миллионеру было бы легче потерять тысячу рублей, чем это было бы для человека, зарабатывающего минимальную заработную плату.
Для молекул в соединениях энергия ионизации обычно связана с элементами, атомы которых составляют молекулу. Подобно тому, как элементы с меньшим количеством электронов, как правило, менее склонны отказаться от одного, так и молекулы с несколькими атомами. Таким образом, энергия ионизации диоксида углерода (СО2), содержащего всего три атома, относительно высока. И наоборот, в больших молекулах, как с большими атомами, есть больше электронов, чтобы отказаться, и поэтому легче отделить один из них от молекул.
Применение процесса
Другим процессом ионизации является ионизация полем, при которой она производится путем воздействия на молекулу очень интенсивного электрического поля. Ионизация поля происходит в ежедневной жизни, когда статическое электричество образует малую искру. Искра фактически поток электронов.
В прикладных лабораториях профессионально известно что такое ионизация и используются точные приборы. Этот процесс гораздо более эффективен, чем электронным ударом и требуется гораздо меньше энергии по отношению к энергии, необходимой для удаления электронов. Технологические достижения медицины широко применяют этот процесс.
Химическая ионизация использует метод подобный ионизации удара электрона, за исключением того, что вместо электронов, луч используется для того чтобы бомбардировать и ионизировать образец. Ионы используемые в этой бомбардировке типично малые молекулы, как в метане, пропане или аммиаке. Тем не менее, молекулярный ион гораздо больше чем электрон, и эти столкновения высокореактивны.
Многие масс-спектрометры используют источник, способный как к электронному удару, так и к химической ионизации.
Ионизация может обеспечиваться электромагнитным излучением, длина волны которого короче длины волн видимого света, т. е. ультрафиолетовым светом, рентгеновскими лучами или гамма-лучами.
Также существует фотоионизация малых молекул, как то кислород (O2). Фотоионизация происходит в верхних слоях атмосферы, где ультрафиолетовое излучение от Солнца вызывает ионизацию кислорода и азота (N2) в их молекулярных формах.
Вот, что такое ионизация в популярном виде.
Что такое потенциал ионизации атома
ПОТЕНЦИАЛ ИОНИЗАЦИИ частицы (молекулы, атома, иона), минимальная разность потенциалов U, к-рую должен пройти электрон в ускоряющем электрич. поле, чтобы приобрести кинетич. энергию, достаточную для ионизации частицы. П. и. частицы X с образованием частицы X’ соответствует процессу:
Более общее понятие-энергия ионизации Е, миним. энергия, необходимая для удаления электрона из частицы на бесконечность. Она связана с П. и. соотношением:
Для атомов понятия первого, второго и т. д. П. и. относят к ионизации невозбужденного атома с образованием невозбужденного положит. иона. Для молекул различают адиабатический П. и. и вертикальные П. и. Адиабатический П. и. отвечает процессу, при к-ром из молекулы, находящейся в основном состоянии, в результате ионизации образуется положит. мол. ион также в основном состоянии. Вертикальные П.и. характеризуют ионизацию молекул, при к-рой образующийся мол. ион может находитья в произвольном энергетич. состоянии (электронном и колебательном), причем соответствующие квантовые переходы происходят без изменения межъядерных расстояний (рис. 1).
Возможно термодинамич. определение П. и. атомов и адиабатического П. и. молекул через стандартную энтальпию D H 0 р-ции X
Первые П. и. известны для атомов всех элементов перио-дич. системы и нсск. тыс. молекул. У легких атомов с зарядом ядра Z Z. При движении слева направо по периоду П. и., вообще говоря, постепенно увеличивается; при увеличении Z в пределах подгруппы П. и. уменьшается (рис. 2).
Рис. 2. Зависимость первых потенциалов ионизации U 1 атомов хим. элементов от атомного номера Z.
В кон. 70-х гг. 20 в. обнаружены т. наз. суперщелочи-молекулы с экстремально низкими значениями П. и.: ОК 4 (3,62 В), ОК 3 (3,65 В), ClNa 2 (4,15 В) и др.
При переходе от валентных электронов атома к остовным П. и. резко увеличивается. Так, для Be U 1 9,320 В, U 2 18,206 В, U 3 153,850 В.
Квантовомех. расчеты П. и. для атомов, двух- и трехатомных молекул дают значения, близкие по точности к экспериментальным. Точность расчета в целом зависит от метода; так, для многоатомных молекул в рамках метода мол. орбиталей она обычно не превышает 1 эВ (см. Купманса теорема ).
П. и. вместе со сродством к электрону определяет величину электроотрицательности атомов и молекул. Знание П. и. необходимо для расчетов термохим. процессов в иони-зир. газах и плазме (газоразрядные приборы, магнитогид-родинамич. генераторы, процессы в верх. слоях атмосферы и т.п.).
Лит.: Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. Справочник, под ред. В. Н. Кондратьева, М., 1974; Аллен К. У., Астрофизические величины, пер. с англ., М., 1960; Степанов Н. Ф., Пу-пышев В. И., Квантовая механика молекул и квантовая химия, М., 1991.
Определение потенциалов ионизации (энергии ионизации) атомов элементов
Задача 195.
Для атома углерода значения последовательных потенциалов ионизации составляют (в В): I1 = 11,3, I2 = 24,4, I3 = 47,9, I4 = 64, I5 =392. Объяснить: а) ход изменения потенциалов ионизации; б) чем вызван резкий скачок при переходе от I4 к I5.
Решение:
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Энергию ионизации выражают в электрон-вольтах (эВ).
Энергию ионизацию можно определить, бомбардируя атомы электронами, ускоренными в электрическом поле. Наименьшую разность потенциалов, при которой скорость электронов становится достоянием для ионизации атомов, называют потенциалом ионизации атомов данного элемента. Потенциал ионизации (I), выраженный в вольтах (В), численно равен энергии ионизации (Е), выраженной в электрон-вольтах.
Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй – энергии отрыва второго электрона и т.д. По мере отрыва электронов от атома положительный заряд образующегося иона возрастает, поэтому для отрыва каждого последующего электрона требуется большая затрата энергии, так что последовательные потенциалы ионизации атома углерода (I1, I2, I3, I4) возрастают. Особенно резко возрастает потенциал ионизации при отрыве электрона с главным квантовым числом меньшим, чем у предыдущего. Так в случае атома С (2s 2 2p 2 ) разность между I1 и I2 составляет I3,13 (24,4 – 11,3 = 13,В), что меньше, чем между I2 и I3 (23,5В) и между I3 и I4 (16,1В). Это связано с большей затратой энергии на удаление третьего электрона, находящегося, в отличие от двух предыдущих, на более близком от ядра расстоянии.
Резкий скачок потенциала ионизации при переходе от I4 к I5 можно объяснить тем, что после отрыва четырёх внешних электронов образуется система, состоящая из одного энергетического слоя (1s 2 ), которая обладает высокой устойчивостью завершённого электронного слоя, а также меньшим значением n(n = 1).
Задача 196.
Энергии ионизации атомов благородных газов составляют (в эВ): Не 24,6; Ne 21,6; Аг — 15,8; Кг 14,0; Хе — 12,1; Ru — 10,8. Объяснить ход изменения энергии ионизации в этой подгруппе.
Решение:
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Энергию ионизации выражают в электрон-вольтах (эВ). При достаточной энергии можно удалить из атома два, три и более электронов.
Потенциал ионизации (энергия ионизации) может служить мерой большей или меньшей «металличности» элемента: чем меньше потенциал ионизации, чем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента. Так потенциалы ионизации у щелочных металлов имеют меньшие значения, чем у элементов подгруппы меди, значит, металлические свойства щелочных металлов выражены в большей степени, чем меди и серебра.
б) В главных подгруппах радиусы атомов элементов одинаково возрастают с увеличением заряда ядра. Кроме того, увеличение числа электронных слоёв, промежуточных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводит к ослаблению связи внешнего электрона с ядром и, следовательно, к уменьшению потенциала ионизации.
У элементов подгруппы меди тоже наблюдается возрастание атомного радиуса, но в месте с тем, при увеличении заряда ядра и количества электронов, происходит усиление электростатического взаимодействия между ядром и электронами, что приводит к большему укреплению связи внешнего электрона с ядром, т.е. к увеличению потенциала ионизации.
Задача 198.
Одинакова ли энергия ионизации атома цезия и атома лития, у которого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать.
Решение:
У атомов лития и цезия на внешнем электронном слое находится по одному s-электрону, только у атома лития s-электрон находится на втором энергетическом уровне (2s 1 ), а у цезия – на шестом (6s 1 ). Заряды ядер атомов лития и цезия, соответственно составляют +3 и +55. При возбуждении валентного электрона атома лития на 6s-подуровень, атом лития приобретает шесть энергетических уровней. При этом заряд ядра его атома не изменяется, а остаётся прежним +3, но объём атома существенно увеличивается. Что приводит к уменьшению связи внешнего электрона с ядром и, соответственно, к уменьшению энергии ионизации I1.
Хотя возбуждённый атом лития, как и атом цезия, содержит валентный электрон на шестом энергетическом уровне, энергии ионизации I1 их атомов будут иметь различные значения, потому что у них разные заряды и разное число электронов и, следовательно, различное электростатическое взаимодействие этих электронов с ядром атома. Очевидно, что при малом заряде ядра атома лития, энергия ионизации I1 атома возбуждённого лития будет иметь меньшее значение, чем атома цезия.
Таким образом, при завершении заполнения 2s-подуровня потенциал I1 возрастает, при начале заполнения электронами 2p-подуровня первым электроном, т.е. при появлении нового подуровня I1 уменьшается, а затем возрастает до заполнения p-орбиталей по одному электрону (у B, C, N). Затем, значение I1 снова уменьшается при начале заполнения 2p-орбиталей вторыми электронами (О) и, увеличивается до полного заполнения 2p-орбиталей (F и Ne).
Задача 200. Объяснить ход изменения энергии ионизации (эВ) в ряду Mg – Al –Si 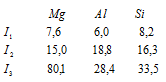
Решение:
Магний на внешнем электронном слое содержит два 3s-электрона, алюминий – три электрона (два 3s и один 3p), кремний – четыре электрона (по два 3s и 3p). По мере последовательного отрыва электронов от атомов положительный заряд образующихся ионов возрастает. Поэтому для удаления каждого последующего электрона требуется большая затрата энергии, так что последовательные энергии ионизации атома (I1, I2, I3) возрастают, что и наблюдается у атомов Mg, Al и Si. Особенно резко возрастает энергия ионизации при отрыве электрона с главным квантовым числом меньше, чем у предыдущего электрона. Так в случае Mg (3s 2 ) разность между I1 и I2 много меньше, чем между I2 и I3. У Al и Si этой закономерности не наблюдается, так как у Al (3s 2 3p 1 ) и у Si (3s 3 p 4 ) все три электрона находятся на одном энергетическом уровне.
Энергия ионизации I1 у алюминия меньше, чем у магния. Объясняется это тем, что при переходе от Mg к Al начинается заполнение электронами нового 3p-подуровня, т.е. возникает новый электронный экран, который немного снижает I1 у атома Al, так как 3s- и 3p-электронные облака имеют приблизительно одинаковые размеры. Далее у атома Si происходит рост.
Энергия ионизации I2 с ростом Z атомов элементов в периоде, с уменьшением их радиусов, закономерно увеличивается, так как вторые электроны у магния и алюминия с одинаковыми квантовыми показателями (3s-электроны). У кремния I2 уменьшается, так как возникает новый электронный экран, причём это уменьшение незначительно, потому что 3s- и 3p-орбитали лишь немного разнятся по энергии между собой.