что такое постоянная антигенная стимуляция организма
Интервью с иммунологом: ответы на вопросы о вакцинации
Интервью с иммунологом: ответы на вопросы о вакцинации
Дорогие друзья, сегодня в нашей рубрике «Интервью с врачом» необычный гость. Наш директор, врач-генетик и к.м.н. Макеева Оксана Алексеевна побеседовала с Еленой Георгиевной Чуриной — д.м.н., профессором, врачом иммунологом-аллергологом. Тема — очень актуальная, будет посвящена вакцинации от новой коронавирусной инфекции.
О. А.: Елена Георгиевна, давайте сразу начнем с главного вопроса. Расскажите, пожалуйста, всех ли можно прививать, какие противопоказания, какие осложнения?
Е. Г.: Всех прививать, конечно, нельзя. Абсолютные противопоказания для вакцинации — беременность, аутоиммунные заболевания, онкологические заболевания, аллергические заболевания в стадии обострения, любые анафилактические реакции в анамнезе. Есть еще много относительных противопоказаний, в этом случае вопрос решается лечащим врачом пациента.
Вакцинация, которая сейчас активно предлагается и реализуется — в действительности продолжение третьей фазы испытаний — клинических исследований. Клинические исследования — это очень длительная и важная стадия и основными ее целями являются: получение объективных и полных данных о безопасности и эффективности вакцины, выявление побочных эффектов, в том числе отдаленных последствий, оценка соотношения риска и пользы при использовании изучаемой вакцины. И этот цикл обычно длится в течение 3-5 лет! Недавно появилась информация о тромбоэмболических осложнениях, в том числе развитии инсультов у людей после вакцинирования вакциной Astra Zeneca в ряде стран Европы. Напомню, что эта вакцина, по аналогии с вакциной Спутник V, также разработана на аденовирусной платформе.
Таким образом, вакцина Спутник V не прошла развернутую и полномасштабную третью фазу и поступила в гражданский оборот преждевременно, с ускоренной досрочной регистрацией и с мотивацией активной вакцинации населения, для создания коллективного иммунитета и защиты от вируса. На самом деле, все намного сложнее. Вакцинация никогда не защитит от проникновения вируса в организм. Она нужна для того, чтобы избежать тяжелого течения инфекции и фатальных осложнений. Антитела какое-то время находятся в кровотоке и, если они нейтрализующие, то могут связать определенные белки вируса, например, S-белок коронавируса. Но эта защита сработает только тогда, когда вирус минует первую линию защиты на слизистой ротоглотки и попадет в кровоток. У абсолютного большинства пациентов вся динамика ОРВИ, от проникновения вируса в организм до выздоровления разворачивается в верхних дыхательных путях.
О. А.: Давайте разграничим базовую вакцинацию ребенка по национальному календарю и вакцинацию взрослого населения от респираторных вирусных инфекций, то есть от гриппа и вот сейчас, от COVID-19.
Е. Г.: Особенности иммунного реагирования у каждого человека отличаются, в этом отношении мы все уникальны. С чего начинается иммунный ответ? Вирус внедряется в организм и сразу садится на слизистую оболочку носоглотки и ротоглотки — входные ворота для инфекции. Активируется врожденный иммунитет, его ключевые клетки — макрофаги — и сразу запускается воспаление. Для чего мы делаем прививку? Для того, чтобы в крови образовался пул протективных антител, которые будут блокировать вирусные белки и не давать вирусу размножаться и поражать другие клетки, уже в нижних отделах респираторного тракта. Они сработают только тогда, когда наступит генерализация инфекции, а не в первые 5-7 дней, когда весь процесс происходит на слизистых верхних дыхательных путей, для этого нужны эффективные механизмы местной защиты — секреторный IgА, макрофаги, местные Т-киллерные клетки и антимикробные белки. Таким образом, вакцина не защитит от заражения, она защитит от возможных осложнений, и только при условии выработки именно нейтрализующих антител к S-протеину.
Что касается вакцинации детей от особо опасных инфекций в соответствии с национальным календарем профилактических прививок, то здесь совсем другие механизмы реализации иммунного ответа на инфекцию изначально. Эти инфекции имеют раннюю и стойкую стадию вирусемии — присутствия вируса в крови и длительный инкубационный период, в отличие от респираторных вирусов. И после такой вакцинации формируется стойкий пожизненный иммунитет, образуются Т- и В-клетки памяти, которые всю жизнь живут вместе с нами.
О. А.: Чем отличается иммунитет после болезни, естественный, от искусственного иммунитета, достигаемого в ходе вакцинации? В первом случае слизистые защищены, а во втором нет?
Е. Г.: Не совсем так. Слизистые оболочки в полной мере никогда не могут быть защищены. Естественный или врожденный иммунитет — очень мощный и всеобъемлющий, основная масса живых существ на земле прекрасно обходится только врожденными механизмами. Высоко специфический адаптивный иммунитет — более позднее эволюционное приобретение млекопитающих, он связан с уникальной, избирательной специфичностью антигенраспознающих рецепторов на Т- и В-лимфоцитах. Если произошло хотя бы незначительное изменение генома у микроба, то иммунный ответ снова будет развиваться как в первый раз. А все респираторные вирусы, как правило, РНК-содержащие и очень быстро мутирующие. Вы уже читали про разные мутации COVID-19? Итальянская, бразильская, британская и т.д. мутации, и их будет очень много. У коронавируса есть пока несколько мутаций, но он высокомутирующий, и на каждую геномную последовательность будет разная специфичность рецепторов лимфоцитов. И что, против каждого штамма прививаться? Поэтому, довольно проблематично создать эффективную вакцину от любых респираторных вирусов.
Когда у человека уже реализовался естественный иммунный ответ на определенный вирус, даже если не было клинических признаков болезни, то выработались самые разнообразные защитные факторы, и это не только антитела! Неправильно оценивать противовирусный иммунный ответ, как антительный или гуморальный. Противовирусный ответ — это, прежде всего, Т-клеточный иммунный ответ, первая линия защиты на слизистых, макрофаги, многочисленные антимикробные белки, контактные взаимодействия между клетками, реакции, которые определяют дальнейший сценарий иммунного ответа в целом. Хорошо, если есть антитела, но они не смогут полностью защитить организм, и наоборот, если их нет — это вовсе не значит, что мы без защиты от коронавируса.
О. А.: Если мы вводим вакцину подкожно, то это только стимуляция антительного ответа и другого иммунитета не будет?
Е. Г.: Нет, разовьются разные иммунные ответы. Антиген в структуре вакцины попал в циркуляцию, необходимые процессы формирования Т-клеточного ответа обязательно будут запущены. Но абсолютно экстраполировать эту ситуацию на естественное проникновение вируса через слизистые верхних дыхательных путей нельзя. Почему мы постоянно говорим о том, что очень много «бессимптомных больных» и пациентов с легким течением инфекции? Да, как раз потому, что наши уникальные механизмы внутренней иммунной защиты срабатывают вовремя и блокируют размножение вируса. С вакциной немного другая ситуация — мы вводим в организм антиген в структуре аденовируса (Спутник V) и не можем точно утверждать, по какому механизму пойдет иммунный ответ. Если антитела уже есть, то могут возникнуть очень тяжелые побочные реакции, например, антителозависимое усиление инфекции (АЗУИ).
О. А.: Это реакция организма на вакцинацию или реакция на повторное инфицирование, когда в организме уже есть антитела, и произошло столкновение с вирусом?
Е. Г.: Может быть и та, и другая ситуация. Если человек переболел бессимптомно, хотя мне очень не нравится эта странная формулировка «бессимптомный больной», то есть просто он встретился где-то с вирусом, и у него уже есть активный защитный иммунитет, клетки памяти и антитела. При введении вакцины в этом случае возможно очень острое течение болезни, с осложнениями. Я бы рекомендовала обязательно провести исследование на наличие всех видов антител к COVID-19, прежде чем принять решение о вакцинации. АЗУИ возникает потому, что сразу образуется иммунный комплекс: антитела, которые уже есть в организме, плюс вирус и белки системы комплемента, запускается острое воспаление. Если много антител, то эти комплексы будет поглощаться клетками макрофагами, взаимодействовать с определенными рецепторами, но, вместо того, чтобы разрушиться и погибнуть, вирус продолжит размножаться в макрофагах. И в этой ситуации возможно развитие цитокинового шторма. Поэтому тем, кто уже переболел, я бы не рекомендовала вакцинироваться.
О. А.: Расскажите, пожалуйста, у всех ли после перенесенной коронавирусной инфекции появляются антитела? Можно ли переболеть и не иметь антител?
Е. Г.: Антитела всегда будут изначально, но их может быть мало, и, спустя какое-то время, они просто не будут фиксироваться методом иммуноферментного анализа, иначе говоря, останутся следовые количества антител. И в этом есть важный биологический смысл, что антитела подвергаются быстрой деградации. Это механизм иммунорегуляции, направленный на то, чтобы предотвратить потенциальные аутоиммунные процессы. Ничего хорошего нет в постоянной циркуляции по организму каких-либо антител, это канонические положения иммунологии, в любом учебнике их можно прочесть.
Кроме того, как правило, нет корреляции между клиническим течением заболевания и титром антител в крови при любых вирусных инфекциях. В моей практике есть пациенты с рецидивирующей герпетической инфекцией, но при этом с очень низким количеством антител к вирусам герпеса.
Установление клинического диагноза — это, в первую очередь — клиническое мышление врача. А сегодня мы наблюдаем такую картину, когда вся диагностика сводится лабораторным и инструментальным методам. Например, КТ. Удивляет, с какой легкостью назначается это серьезное, очень высокое по лучевой нагрузке обследование. И что мы видим? Например, 90% поражения легких по КТ? Это просто картина матового стекла, пневмонит, системное воспаление мелких сосудов и отек, это не поражение именно альвеол, если бы так было, то человек бы уже не жил. Мы должны ориентироваться на объективный статус и общее состояние пациента, на его настроение, самочувствие, активность. Если у человека все хорошо, и он прекрасно себя чувствует, а КТ показывает, например, 30% поражения легких, при этом ему все равно в ряде случаев рекомендовали срочную госпитализацию, в результате практически здоровый человек заболевал внутрибольничной бактериальной пневмонией, и все заканчивалось фатально.
О. А.: Чтобы возник цитокиновый шторм, человек должен одномоментно получить большое количество частиц коронавируса?
Е. Г.: Большое количество вирусных частиц, примерно 1000, надо получить для того, чтобы заболеть ковидом. Цитокиновый шторм развивается при синдроме активации макрофагов — самых главных клеток врожденного иммунитета, и это не такое частое осложнение, но его можно спровоцировать применением интерферонов и таких препаратов, как кагоцел и ингавирин. Что происходило год назад, с самого начала эпидемии? На первом этапе даже бессимптомных пациентов только с положительным ПЦР-тестом на коронавирус везли в госпитали, все лежали вместе. Таким образом формировались очаги инфекции внутри больниц, возрастала в геометрической прогрессии антигенная нагрузка на иммунную систему пациентов, а самое страшное — присоединялась внутрибольничная бактериальная суперинфекция, резистентная ко всем антибиотикам, которые на сегодня существуют.
Когда я увидела первые протоколы лечения COVID-19, то поняла, что, насколько это возможно, буду ограждать людей от госпитализации. Несколько видов антибиотиков, противомалярийные препараты и лекарства от ВИЧ-инфекции — от побочных эффектов такого лечения может умереть даже здоровый и молодой человек.
О. А.: Если человек получил небольшую долю коронавируса, то он легче справится с ней, чем если одномоментно получать много?
Е. Г.: Да, конечно. Когда вирусных частиц немного, скорее всего, вообще не будет никаких проявлений инфекции, гораздо опаснее высокая вирусная нагрузка.
О. А.: Полезно ли получить и пережить эту маленькую дозу?
Е. Г.: Очень полезно! Микробиота каждого человека уникальна, и чем она более разнообразна, тем лучше. Компоненты микробиома производят физиологическую микровакцинацию, постоянно стимулируют клетки врожденного иммунитета, держат их на низком старте для того, чтобы иммунитет оперативно сработал при необходимости. Нужно обязательно контактировать с антигенами. Дети, которые не посещают детский сад, все равно переболеют основными вирусными инфекциями, но уже в школе, пока не наработают адаптивный иммунный ответ.
О. А.: В гигиенической теории про вакцинацию так и говорят — она дает возможность иммунитету поработать. Это не так?
Е. Г.: Нет, это искусственная тренировка. Гигиеническая теория привела к резкому росту аллергических и аутоиммунных заболеваний! Невозможно вакцинацией воспроизвести все механизмы естественного иммунного ответа. Препараты микробных продуктов или аутовакцины в этом аспекте работают намного лучше — это вакцинация на уровне местного иммунитета. Таким способом мы помогаем клеткам иммунной системы активироваться, принимая лизаты бактерий. Может быть даже высокая температура, но это всегда хорошо, потому что, например, у часто болеющих людей хроническое воспаление протекает без температуры и затягивается, так как активного иммунного ответа нет.
О. А.: Итак, мы за базовую вакцинацию ребенка по национальному календарю, но против не до конца неизученной вакцины от респираторного вируса?
Е. Г.: Конечно. Мой ребенок — вакцинирован полностью от опасных инфекций по календарю, и даже дополнительно я его провакцинировала от менингококковой инфекции. Вакцинируем обязательно, потому что, как минимум, по туберкулезу у нас по-прежнему, не очень хорошая ситуация. Но когда мы говорим о массовой ежегодной вакцинации взрослого населения от ОРВИ, особенно о людях в возрасте 40+, с повышенными рисками аутоиммунных, сердечно-сосудистых, онкологических заболеваний, с уже накопленными соматическими мутациями в клетках, нужно быть крайне осторожными. Людей, работающих в группах профессионального риска, возможно, и надо провакцинировать, но только после тщательного сбора анамнеза и обследования.
Антитела к вирусу простого герпеса 1 и 2 типов lgM, HSV IgM колич.
Описание
Антитела к вирусу простого герпеса 1 и 2 типов lgM, HSV IgM количественный — определение антител lgM к вирусу простого герпеса 1 и 2 типов, показателя острой фазы инфекции.
Антитела класса IgM начинают вырабатываться через 4–6 дней с момента инфицирования и достигают максимального значения на 15–20 сутки, остаются в организме человека недолго, около 1–2 месяцев. У 10–30% людей с реактивацией старой инфекции также могут быть обнаружены антитела класса IgM.
Вирус простого герпеса (ВПГ, Herpes simplex), или герпес, бывает двух видов: вирус простого герпеса первого типа (ВПГ-1) и вирус простого герпеса второго типа (ВПГ-2). Обе формы, ВПГ-1 и ВПГ-2, высококонтагиозны.
Основные пути передачи герпеса:
ВПГ-2— относится к числу инфекций, передаваемых половым путем, которые могут вызвать генитальный герпес.
Распространяется, главным образом, половым путем и при кожном контакте.
Общим свойством перечисленных вирусов является постоянное присутствие в организме человека, с момента инфицирования. Вирус может находиться в «спящем» или активном состоянии и не покидает организм даже под воздействием лекарственных препаратов. Манифестное проявление любой герпетической инфекции свидетельствует о снижении иммунитета.
ВГП-2 (генитальный герпес) поражает, преимущественно, покровные ткани (эпителий) шейки матки у женщин и полового члена у мужчин, вызывая боль, зуд, появление прозрачных на половых органах скоплений мелких болезненных пузырьков. Вскоре они лопаются, оставляя мелкие язвочки.
У мужчин пузыри образуются чаще всего на половом члене, иногда в мочеиспускательном канале и прямой кишке. У женщин — обычно на половых губах, реже — на шейке матки или в анальной области. Через 1–3 недели заболевание как бы проходит. Но вирус проникает в нервные волокна и продолжает существовать, затаившись в крестцовом отделе спинного мозга. У многих больных генитальный герпес даёт рецидивы болезни. Они возникают с различной частотой — от одного раза в месяц до одного раза в несколько лет. Их провоцируют другие болезни, неприятности, и даже просто перегревание на солнце. Однако при оральных контактах возможно поражение покровной ткани губ и ротовой полости.
У беременных: вирус может проникнуть через плаценту в плод и вызвать у него врождённые дефекты. Герпес может вызвать также самопроизвольный аборт или преждевременные роды. Но особенно вероятна опасность заражения плода в процессе родов, при прохождении через шейку матки и влагалище при первичной или рецидивирующей генитальной инфекции у матери. Такое заражение на 50% повышает смертность новорожденных или развитие у них тяжёлых повреждений головного мозга или глаз. При этом определённый риск инфицирования плода существует даже в тех случаях, когда у матери ко времени родов отсутствуют какие-либо симптомы генитального герпеса. Ребенок может заразиться и после рождения, если у матери или у отца имеются поражения, во рту, или получить вирус с материнским молоком.
Антитела при герпесвирусной инфекции
ВГП-2 связан с раком шейки матки и раком влагалища, а также повышает восприимчивость к ВИЧ-инфекции, вызывающей СПИД! В ответ на инфицирование ВПГ иммунной системой вырабатываются обеспечивающие иммунный ответ специфические иммуноглобулины классов М (IgM).
Диагностическое значение при первичной инфекции вирусом герпеса имеет выявление IgM и четырехкратное увеличение титров специфических иммуноглобулинов G (IgG) в парных сыворотках крови, полученных от больного с интервалом в 10–12 дней. Рецидивирующий герпес обычно протекает на фоне высоких показателей IgG, свидетельствующих о постоянной антигенной стимуляции организма. Появление IgM у таких пациентов является признаком обострения болезни.
HSV и TORCH
HSV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка. В идеальном случае, женщине за 2–3 месяца до планируемой беременности необходимо пройти лабораторное обследование на TORCH-инфекции. В таком случае, будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Интерпретация результатов
Единицы измерения: УЕ*
Положительный результат будет сопровождаться дополнительным комментарием с указанием коэффициента позитивности пробы (КП*):
Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?
Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?
Автор
Редакторы
Революционный метод лечения злокачественных опухолей, известный как неклеточная иммунотерапия ингибиторами контрольных точек иммунного ответа, — один из ведущих предметов исследования в онкологии. Несмотря на потенциально высокую эффективность, имеет ряд проблем, решение которых станет толчком не только к его активному развитию, но и широкому применению в клинической практике — в отношении всех без исключения локализаций злокачественных новообразований, независимо от стадии. Однако подвластно ли это человеческому разуму в наши дни?
История открытия контрольных точек иммунного ответа
Онкоиммунология — медицинская наука, изучающая закономерности взаимодействия иммунной системы с опухолью.
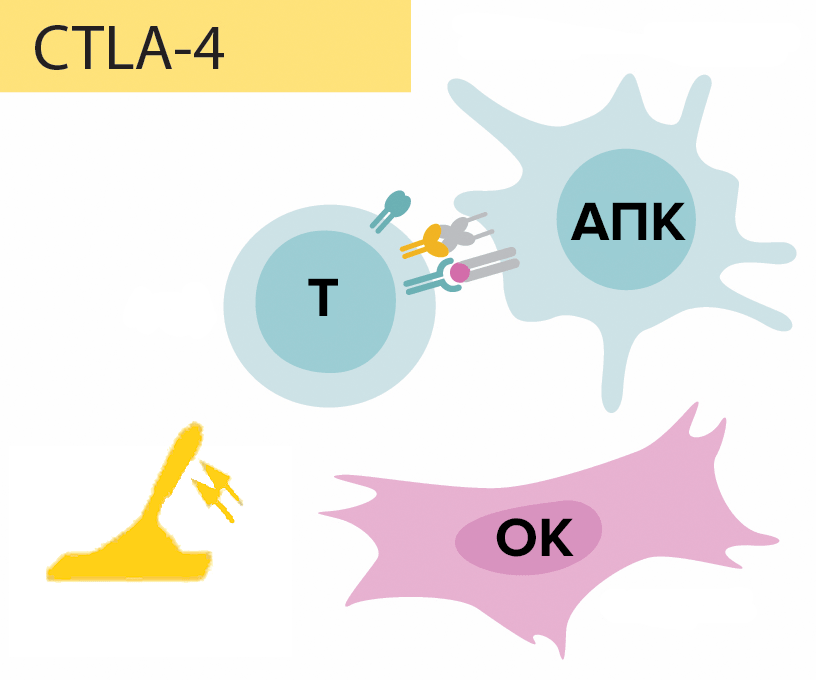
Рисунок 1. Схема функционирования молекулы CTLA-4. Сформированный иммунологический синапс активирует «наивный» цитотоксический Т-лимфоцит (Т-киллер), и на его мембране выставляется молекула CTLA-4. Она передает Т-киллеру ингибирующий сигнал (механизм досконально не изучен), иначе говоря, действует подобно рычагу. В результате «наивный» цитотоксический Т-лимфоцит утрачивает способность к образованию специфичных клонов с последующей их дифференцировкой в рабочие (эффекторные) Т-киллеры, которые элиминируют опухолевые антигены.
Помимо этого важны костимулирующие и корецепторные взаимодействия мембранных белков антигенпрезентирующей клетки и «наивного» Т-лимфоцита, способствующие его активации. Мембранными белками-стимуляторами антигенпрезентирующей клетки являются белки CD80/86, белками Т-лимфоцитов — CD28. Молекула CTLA-4 передает ингибирующий сигнал цитотоксическому Т-лимфоциту, тем самым подавляя иммунологическую реактивность в начальной фазе иммунного ответа — индуктивной. Она состоит из следующих этапов:
Индуктивная фаза иммунного ответа реализуется в течение первых 5–7 суток с момента попадания чужеродной молекулы в организм.
Важно понимать, что процесс иммунного ответа слагается из двух фаз, второй из которых является эффекторная фаза, в которой происходит элиминация (удаление, уничтожение) чужеродного антигена из организма и формирование иммунологической памяти. Это отличает адаптивный иммунитет от врожденного. Иммунологическая память — феномен, при котором антигенспецифические клоны Т- либо B-клеток — клетки памяти, которые ранее контактировали с тем или иным чужеродным антигеном, — запоминают его, и при повторном внедрении его в организм ускоренно и усиленно элиминируют (уничтожают) его. Например, течение вирусной либо бактериальной инфекции изначально может быть средней тяжести, или тяжелым и длительным. Если формируется стойкий иммунитет к ней, то в случае повторного инфицирования (повторном контакте с каким-либо из данных антигенов) ее течение более легкое и короткое, так как антиген (патоген — вирус или бактерия) элиминируется в два раза быстрее, чем при первом контакте с ним.
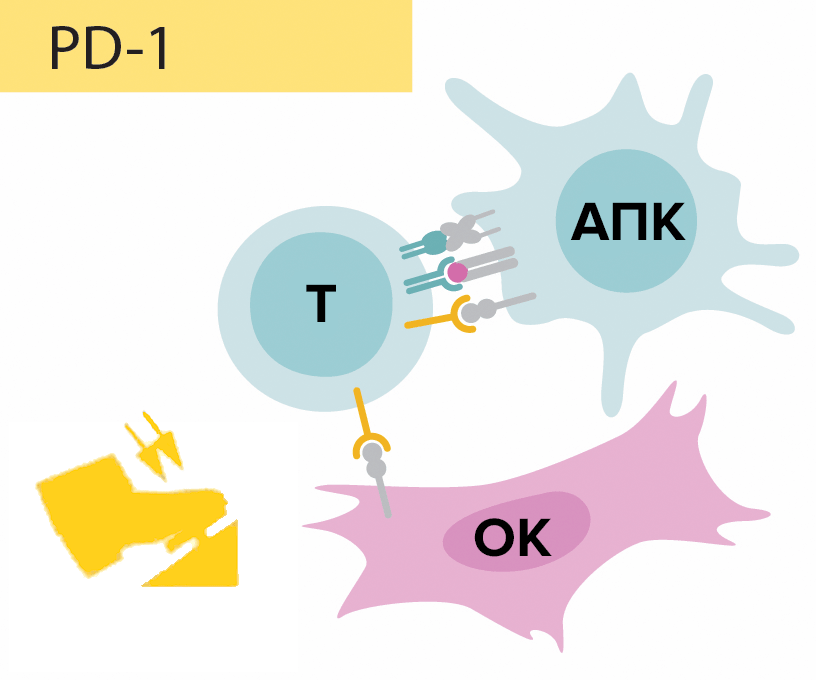
Японский иммунолог Тасуку Хондзё (рис. 2), профессор университета Киото, и его команда, проведя исследования также на мышиных моделях, обнаружили еще одну молекулу — белок PD-1, экспонируемый на мембране активированных Т-лимфоцитов, в то время как опухолевые клетки выставляют на своей мембране белки PD-L1 и PD-L2, являющиеся лигандами белка PD-1. Образовавшийся сигнальный путь PD-1/PD-L1, PD-L2 (рис. 3) вдвойне стимулирует апоптоз активированных Т-киллеров, что препятствует дальнейшему осуществлению иммунного ответа, иначе говоря, подавляет иммунный ответ в эффекторной фазе [1]. Если же сигнальный каскад не сработает, то иммунная система будет атаковать собственные здоровые ткани организма, что приведет к развитию аутоиммунных заболеваний. Этим и значимы контрольные точки иммунного ответа — они обеспечивают адекватность функционирования иммунной системы, регулируя процесс иммунного ответа (в отличие от Т-регуляторных клеток они не оказывают влияние на клоны Т-лимфоцитов), тем самым препятствуя развитию аутоиммунных процессов.
Рисунок 2. Тасуку Хондзё (слева) и Джеймс Эллисон (справа), лауреаты Нобелевской премии по физиологии и медицине 2018 года
Рисунок 3. Схема функционирования сигнального пути PD-1/PD-L1, PD-L2. Белок PD-1 (англ. programmed cell death protein-1) — в переводе с английского «белок запрограммированной клеточной гибели», ограничивающий продолжительность жизни Т-лимфоцитов с целью предотвращения образования Т-клеточной лимфомы. Согласно исследованиям Тасуку Хондзё и его команды, опухолевые клетки экспонируют такой же белок, являющийся лигандом белка PD-1 Т-лимфоцитов. Белок PD-1 связывается со своим лигандом, происходит двойная стимуляция апоптоза в эффекторных (рабочих) цитотоксических Т-лимфоцитах, в результате чего элиминация опухолевого антигена (уничтожение опухолевой клетки) становится невозможной.
На основе этих выдающихся исследований разработан новый класс препаратов гуманизированных моноклональных антител [2]. Они были получены в конце 80-х годов XX века путем замены в составе антигена белков иммунизированной мыши белками человека [2]. Связываясь с молекулами CTLA-4 и PD-1 на поверхности злокачественно трансформированных клеток, эти антитела ингибируют контрольные точки иммунного ответа и тем самым способствуют уничтожению злокачественной опухоли собственными защитными силами организма. Первые представители этого класса препаратов — ипилимумаб (антагонист CTLA-4; рис. 4), ниволумаб, пембролизумаб (ингибитор PD-1; рис. 5) — в ходе клинических испытаний оказались эффективными в отношении меланомы и немелкоклеточного рака легкого.
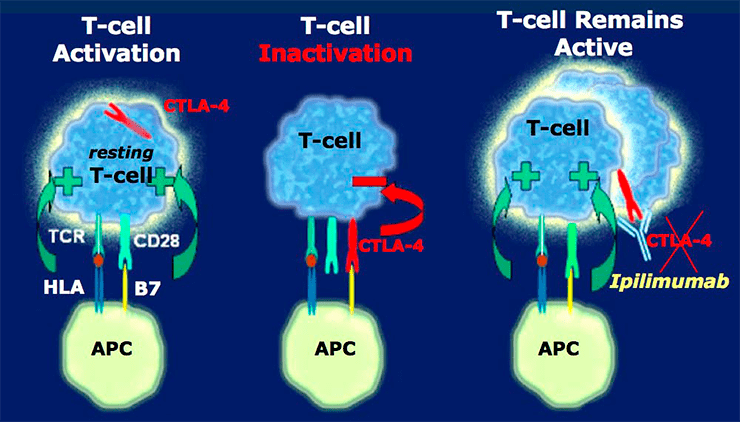
Рисунок 4. Фармакодинамика ипилимумаба. Ипилимумаб (торговое название «Ервой») — противоопухолевый препарат, представляющий собой антитело, антигеном для которого является контрольная точка CTLA-4. Образовавшийся иммунный комплекс «антиген + антитело» — CTLA-4 + ипилимумаб — блокирует ингибирующий сигнал с Т-лимфоцита, получаемый им от CTLA-4, и запускается механизм иммунного ответа.
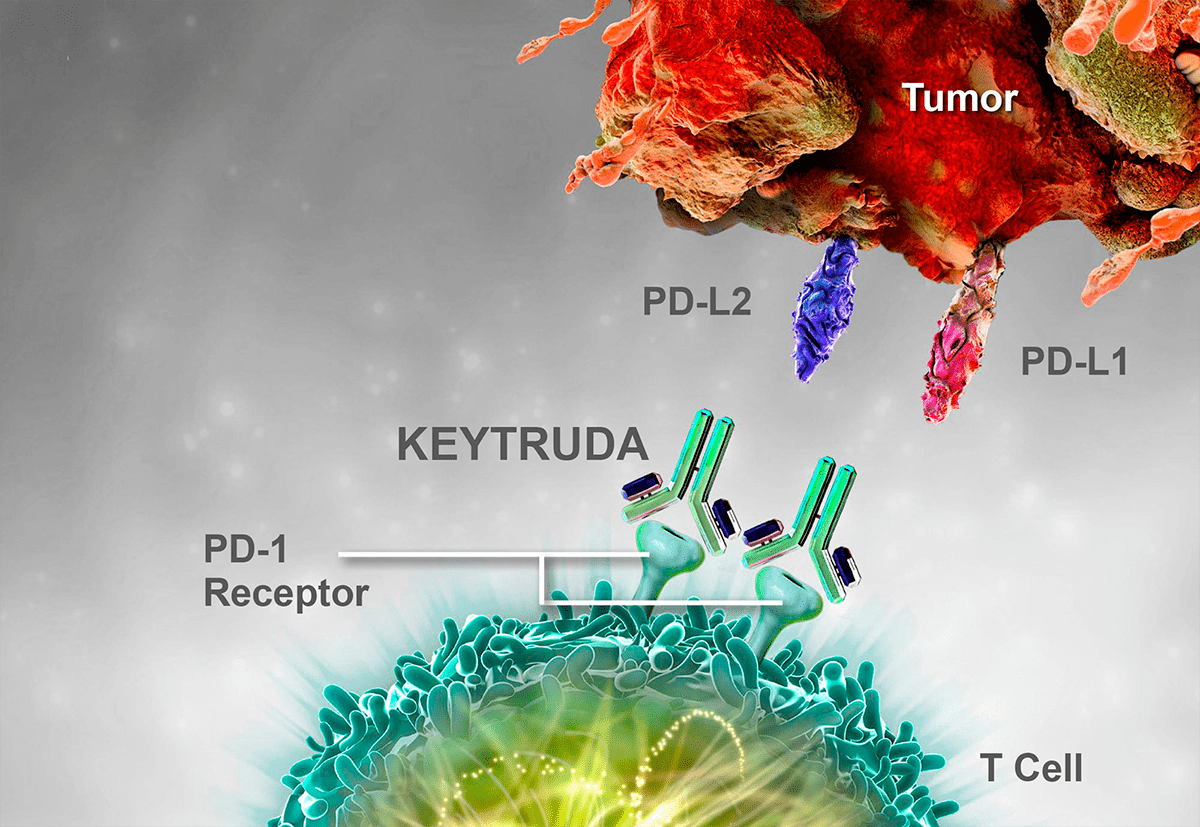
Рисунок 5. Фармакодинамика пембролизумаба. Пембролизумаб (торговое название «Кейтруда») — противоопухолевый препарат, представляющий собой антитело к рецептору белка PD-1 Т-лимфоцитов. Иммунный комплекс PD-1 + пембролизумаб препятствует образованию сигнального каскада PD-1/PD-L1, PD-L2, а именно двойной стимуляции апоптоза Т-киллера, и он (Т-киллер) элиминирует опухолевый антиген, иначе говоря, уничтожает опухолевую клетку, и формируется иммунологическая память.
Меланома — злокачественная опухоль кожи, реже слизистых оболочек (полости рта, чаще всего десны, влагалища, прямой кишки), сетчатки глаза, — образуется из пигментных клеток — меланоцитов. Меланома кожи является одной из наиболее опасных злокачественных опухолей, поскольку метастазирует стремительно: ответная реакция организма оказывается весьма слабой (в том числе и со стороны иммунной системы) а распространение — обширное, поражаются практически все органы и ткани организма-хозяина.
Немелкоклеточный рак легкого — гистологическое название злокачественной опухоли легкого. Такое название опухоль получила исходя из того, что при окраске среза биоптата легкого, в нем не обнаруживались мелкоклеточные элементы. Различают две локализации первичной опухоли: центральный рак — локализуется в области бронха крупного калибра, отходящего от трахеи, или периферический рак — локализуется в области бронхов мелкого калибра либо бронхиол, отдаленных от трахеи. Клиническая симптоматика центрального рака легкого проявляется раньше периферического вследствие ускоренного развития дыхательной недостаточности, что является непосредственной причиной смерти при раке легкого как крупноклеточном, так и мелкоклеточном, аденокарциноме легкого и т.д.
Выдающийся успех неклеточной иммунотерапии
Экспериментальную терапию меланомы провели в 2015 году с грандиозным успехом. Испытуемым был 39-й Президент США Джимми Картер, который, в почтенном возрасте узнав о смертельном диагнозе — четвертой стадии меланомы с отдаленными метастазами в головной мозг, — публично попрощался с народом, при этом тайно дав согласие на экспериментальное лечение пембролизумабом. На тот момент стандартом лечения онкологических заболеваний в развитых странах была химиотерапия препаратами, непосредственно влияющими на пролиферацию клеток. Такие лекарства высокотоксичны и имеют значительное количество побочных эффектов, поскольку оказывает влияние на все быстро делящиеся клетки. В связи с этим разрабатывалась таргетная терапия, которая постепенно вытесняла стандартную химиотерапию.
В результате контрольное МРТ-сканирование не выявило в ткани мозга Картера метастатических очагов меланомы [3].
Проблемы неклеточной иммунотерапии
Иммунотерапия ингибиторами контрольных точек иммунного ответа, несомненно, одно из наиболее прогрессивных и активно развивающихся направлений таргетной терапии рака. Однако в чем кроется причина избирательного действия препаратов антител на злокачественные новообразования?
Во-первых, исходя из того, что данный вид таргетной терапии находится на ранней стадии развития, далеко не все препараты испытаны на всех без исключения видах злокачественных опухолей, следовательно, недостаточно данных об их фармакодинамике и побочных эффектах.
Во-вторых, злокачественная опухоль способна «ускользать» от иммунологического надзора еще несколькими путями, в которых не задействованы иммунные чекпойнты:
Рисунок 6. Андреа Шитинджер, доцент кафедры иммунологии и патогенеза микроорганизмов, ассистент программы иммунологии в онкологическом центре Мемориал Слоан Кеттеринг
Изучением проблем неклеточной иммунотерапии также занимались ученые из Института изучения рака в Лондоне (Великобритания), в том числе и Андреа Шитинджер (рис. 6), доцент кафедры иммунологии и патогенеза микроорганизмов, ассистент программы иммунологии в онкологическом центре Мемориал Слоан Кеттеринг.
Тимоциты — незрелые клетки тимуса (вилочковой железы), предшественники «наивных» Т-лимфоцитов.
В заключение следует сказать, что как бы стремительно не развивалась онкология как наука, сложно что-либо прогнозировать в лечении онкологических заболеваний. Их исход практически во всем зависит от потенциала организма пациента, что, к сожалению, на данном этапе предсказать невозможно.