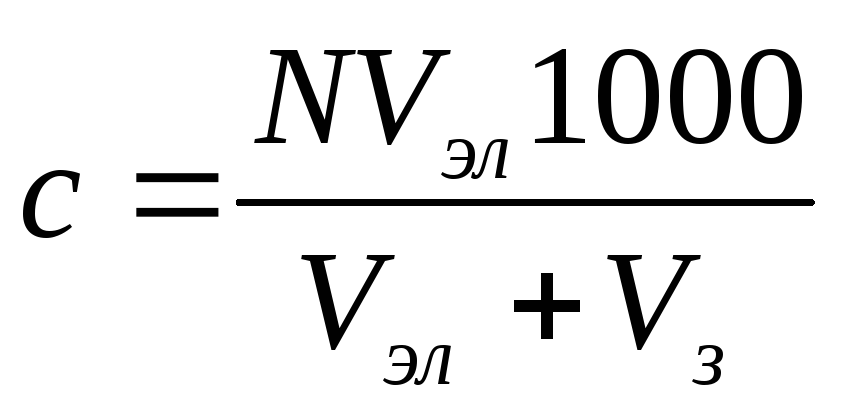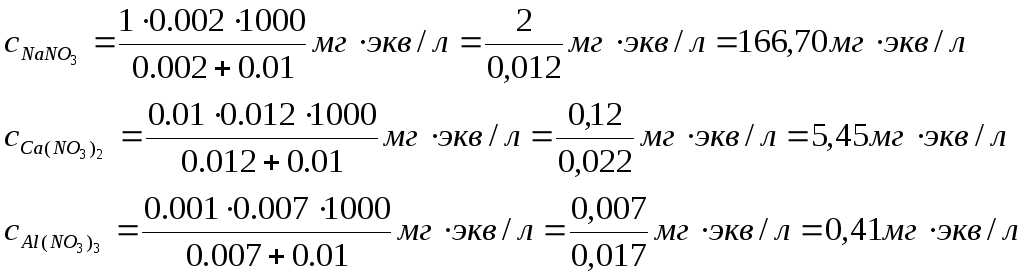что такое порог коагуляции
КОАГУЛЯ́ЦИЯ
Том 14. Москва, 2009, стр. 357
Скопировать библиографическую ссылку:
КОАГУЛЯ́ЦИЯ (от лат. coagulatio – сгущение, свёртывание), слипание частиц дисперсной фазы с образованием более крупных агрегатов, в результате которого дисперсная система самопроизвольно переходит в состояние с более низкой свободной энергией. Слипание частиц происходит под действием сил молекулярного притяжения при их соударении в процессе броуновского движения или при направленном перемещении в силовом поле. Взаимодействие между первичными частицами в коагуляте может осуществляться непосредственно или через тонкую прослойку дисперсионной среды. В зависимости от соотношения плотностей дисперсной фазы и дисперсионной среды К. может привести к седиментации и выпадению осадка или к всплыванию крупных агрегатов – образованию хлопьев, сливок на поверхности раздела дисперсионная среда – воздух. Вид К., при которой частицы дисперсной фазы образуют рыхлые хлопьевидные агрегаты – флокулы, называют флокуляцией (от лат. flocculi – хлопья). В ряде случаев в результате К. может возникнуть пространственная структура во всём объёме дисперсионной среды без расслоения системы (см. в ст. Структурообразование ). При малой прочности коагулятов возможен их распад до первичных частиц, называемый пептизацией.
Что такое порог коагуляции
Разработка и внедрение программ, направленных на защиту окружающей среды и сохранение флоры и фауны водоемов, проходят в каждом регионе. Предприятия, осуществляющие слив сточных вод в естественные водоемы, несут бремя ответственности, а соблюдение ими правил организации стоков, очистки и обеззараживания загрязненной и бывшей в использовании воды контролируются на правительственном уровне. Именно поэтому вопросу выбора наиболее эффективной, безопасной и надежной системы очистки сточных вод уделяется особое внимание.
Метод коагуляции – новое направление в очищении и обеззараживании сточных вод. Сегодня существует несколько методов очищения загрязненных сточных вод, среди которых особую популярность получил коагуляционный метод очистки воды, относящийся к категории химических, не представляющий угрозы природе. Коагуляция воды направлена на качественную очистку подвергающихся обработке и переработке жидкостей, которые используются на промышленных объектах. Проведенное очищение и обеззараживание загрязненной воды позволяет вторично ее использовать или осуществлять сброс в реки, не нанося вред окружающей среде, живой флоре и фауне, что особенно важно сегодня, когда вопросам экологии и сохранения природных ресурсов уделяется столько внимания. Основная задача системы очистки стоков – удаление загрязнений, для которых подбирается строго определенный коагулянт для очистки воды с целенаправленным действием. Коагуляция позволяет эффективно очистить сточные воды с использованием специальных реагентов, нахождение в воде которых впоследствии не приведет к нарушению микрофлоры природного водоема, куда идет слив сточных вод предприятия.
Важнейшие экспериментальные факты, способные служить базой для построения теории коагуляции базируются на многообразии причин, вызывающих коагуляцию, на коагулирующем действии электролитов, на влиянии величины заряда иона-коагулятора [1–6].
Установленные закономерности коагуляции нашли свое выражение в правиле Шульце-Гарди, высказанном еще в конце XIX века [1–6].
В ходе развития представлений об устойчивости и механизмах коагуляции гидрофобных коллоидов растворами электролитов возникло много теорий, которые пытались объяснить три вопроса [1–5]:
1) почему коагуляция наступает при определенной концентрации электролита-коагулятора;
2) почему при этом основную роль играет концентрация иона, несущего заряд, противоположный заряду частицы;
3) почему влияние заряда иона-коагулятора подчиняется закономерности, выраженной правилом Шульце-Гарди.
Все теории коагуляции в основном подразделяются на адсорбционные и электростатические [1–6]. Современная физическая теория устойчивости и коагуляции коллоидных систем была развита Б.В. Дерягиным и Л.Д. Ландау (1937), Э. Фервеем и Я. Овербеком (1941). В соответствии с первыми буквами фамилий авторов теория носит название ДЛФО. Согласно этой теории, между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкивания. Состояние системы зависит от баланса энергии притяжения и энергии отталкивания. Преобладание энергии отталкивания приводит к устойчивости системы. Преобладание энергии притяжения вызывает нарушение агрегативной устойчивости, т.е. коагуляцию [1, 5, 6].
Коагуляция сложный процесс, который зависит как от природы золя, так и от природы коагулирующих электролитов. Настоящая работа посвящена изучению закономерностей и механизма коагуляции под действием индифферентных электролитов на примере коллоидной системы – золя Fe(OH)3.
Васильевым С.Е. выполнена экспериментальная часть работы и изучен механизм коагуляции.
Коагуляция гидрофобных золей. Факторы, вызывающие коагуляцию
Лиофобные дисперсные системы (золи, суспензии, эмульсии) агрегативно неустойчивы, поскольку обладают избытком поверхностной энергии Гиббса. Процесс укрупнения частиц (коагуляция) протекает самопроизвольно, так как он ведет к уменьшению удельной поверхности и снижению поверхностной энергии Гиббса. Коагуляция представляет собой процесс слипания (или слияния) частиц дисперсной фазы при потере системой агрегативной устойчивости [1–6].
При коагуляции изменяются физико-химические свойства систем: появляется мутность, снижается осмотическое давление, изменяются электрическая проводимость и характер вязкости. На изменении физико-химических свойств основаны методы наблюдения и изучения процесса коагуляции.
Фактором, вызывающим коагуляцию, может быть любой агент, нарушающий агрегативную устойчивость системы, например изменение температуры (сильное нагревание или охлаждение вплоть до замораживания), механическое воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам), действие света и различного рода излучений, действие электрических зарядов. Однако наиболее важным фактором является действие электролитов. Электролиты, добавляемые к золям, чрезвычайно быстро и резко влияют на толщину ДЭС и на z-потенциал, являющийся одним из главных факторов устойчивости гидрофобных коллоидных систем.
Коагуляция под действием электролитов. Правило Шульце-Гарди
Наблюдения Г. Шульце (1882) показали, что коагулирующей способностью обладает один из ионов добавляемого электролита (ион-коагулятор). Коагулирующая способность иона-коагулятора возрастает с увеличением его заряда (правило Шульце). Несколько позже М.Гарди (1900) нашел, что заряд коагулирующего иона всегда противоположен заряду коллоидной частицы (правило Гарди). Следовательно, коагуляцию отрицательного золя вызывают катионы добавленного электролита. Для золя с положительно заряженными частицами ионами-коагуляторами являются анионы [1–6].
Закономерности, найденные Шульце и Гарди и подтвержденные многочисленными исследователями, известны как правило Шульце-Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности).
Порогом коагуляции (g) называют наименьшее количество электролита, необходимое для коагуляции 1 м3 золя. Его выражают в ммоль/л или моль/л.
Для расчета порога коагуляции достаточно умножить концентрацию электролита с (кмоль/м3) на объем его раствора, вызвавшего коагуляцию, V (м3), и произведение разделить на взятый объем золя W (м3):
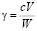
Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
Фактором, вызывающим коагуляцию, может быть любое внешнее воздействие, нарушающее агрегативную устойчивость системы. Кроме изменения температуры в его роли может выступать механическое воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам), действие света и различного рода других излучений, действие электрических разрядов. Однако наиболее эффективным способом является добавление в золь электролитов. Они быстро и резко влияют на толщину ДЭС и величину ζ-потенциала частицы.
Многочисленные исследования показали, что добавление в золь практически любого электролита вызывает уменьшение его устойчивости. Однако с заметной скоростью коагуляция золя будет происходить, если концентрация добавляемого электролита в растворе достигает строго определенной величины.
Та минимальная концентрация электролита в коллоидном растворе, которая вызывает протекание в нем явной коагуляции, называется порогом коагуляции данного электролита. Она измеряется в ммоль/дм 3 или в моль/м 3 и обозначается СП или γ.
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают VK: VK = 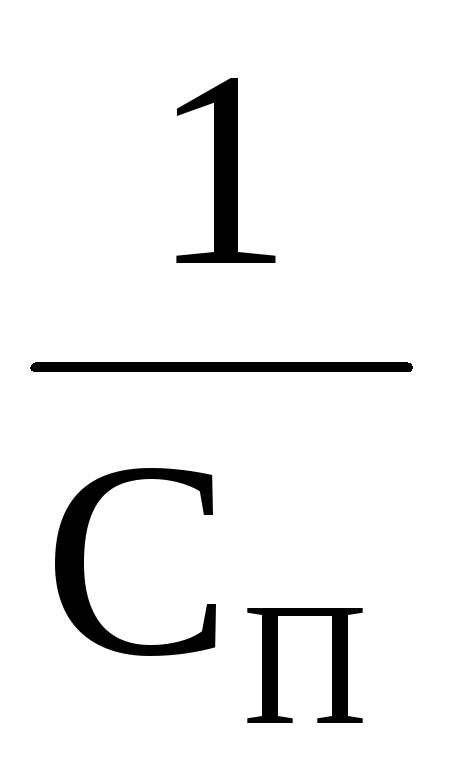
Порог коагуляции обычно определяют визуально и опытным путем, поэтому его величина может зависеть от ряда субъективных факторов. Например, от момента его фиксирования после внесения электролита, от метода наблюдения, от концентрации исследуемого золя и др. Поэтому все это необходимо учитывать, особенно, если проводится сравнительный анализ воздействия одного и того же электролита на разные золи или разных электролитов на один и тот же золь.
Опытным путем было установлено, что коагулирующее воздействие на коллоидный раствор оказывают не весь электролит, а только те его ионы, знак заряда которых противоположен заряду гранулы (или совпадает со знаком заряда потенциалопределяющих ионов) мицеллы.
Так, коагуляцию золя с отрицательно заряженными гранулами вызывают катионами электролита, а золя с положительно заряженными гранулами – его анионами.
Очень часто порог коагуляции и коагулирующую способность определяют не по концентрации всего электролита в растворе, а только его коагулирующего иона.
В 1882 г. Г. Шульц, а несколько позже и М. Гарди показали, что коагулирующая способность ионов электролита напрямую зависит от величины их заряда. Причем, с увеличением величины заряда иона на единицу его коагулирующая способность возрастает в 10 и более раз. Такая закономерность получила название правило Шульца-Гарди и носит приближенный характер. Это связано с тем, что, кроме величины заряда, на коагулирующую способность иона оказывает влияние и ряд других факторов: природа иона, его радиус и способность к сольватации (гидратации для водных растворов).
У ионов с одинаковой величиной заряда коагулирующая способность возрастает с увеличением их радиуса и уменьшением степени сольватации. По данному признаку ионы располагают в так называемые лиотропные ряды Гофмейстера:
увеличение коагулирующей способности ионов электролита
Таким образом, коагулирующая способность ионов электролита в растворе напрямую связана с их способностью к адсорбции на твердой поверхности.
В зависимости от механизма действия различают 2 вида коагуляции золей электролита: концентрационнуюинейтрализационную.
Концентрационная коагуляциянаблюдается при увеличении содержания в золе электролита, не вступающего в химическое взаимодействие с компонентами двойного электрического слоя мицеллы. Такие электролиты называютсяиндифферентными. Их ионы не способны достраивать кристаллическую решетку агрегата и не могут реагировать с потенциалопределяющими ионами, образуя нерастворимые соединения. При увеличении концентрации такого электролита в растворе диффузный слой мицеллы сжимается из-за перехода ее противоионов и коагулирующих ионов электролита в адсорбционный слой. Одновременно с этим процессом уменьшается и электрокинетический потенциал гранулы (но не поверхностный потенциал).
Наблюдения показали, что для большинства коллоидных систем явная коагуляция наступает, если значение ζ-потенциала достигает одного и того же критического значения: ≈ 0,029-0,03 В.
В идеале при добавлении электролита ζ-потенциал гранулы может уменьшаться до нуля. Такое состояние коллоидной системы называется изоэлектрическим. В этом случае у коллоидных частиц отсутствует и диффузный слой. Такие системы являются максимально неустойчивыми.
При нейтрализационной коагуляцииионы прибавляемого электролита способны взаимодействовать с потенциалопределяющими ионами агрегата, образуя на его поверхности нерастворимые соединения. В этом случае наряду с ζ-потенциалом уменьшается и общий (поверхностный или электротермодинамический) потенциал частицы.
Если электролит в коллоидный раствор вводят не сразу, а небольшими порциями через определенные промежутки времени, может наблюдаться явление привыкания.Привыканиемназывается повышение устойчивости золя к коагулирующему действию электролита в случае уменьшения скорости его поступления. Этот факт учитывают в медицине при внутривенных инъекциях больших объемов растворов лекарственных веществ.
При смешивании двух устойчивых коллоидных растворов с разноименно заряженными гранулами нередко происходит образование осадка, называемое взаимной коагуляциейзолей.
Коагуляция золей. Порог коагуляции электролитов
Коагуляция — это процесс укрупнения дисперсных частиц за счет их взаимодействия и объединения в агрегаты. Мелкие (первичные) частицы в таких агрегатах соединены силами межмолекулярного взаимодействия. Слипание однородных частиц называется гомокоагуляцией, а разнородных—гетерокоагуляцией. Вещества, способные вызвать коагуляцию частиц называют в общем случае коагуляторами, а в водоподготовке—коагулянтами или гидролизующимися коагулянтами. Последние не только вызывают коагуляцию частиц загрязнений, но и образуют, гидролизуясь, малорастворимые продукты, способные объединяться в крупные хлопья.
Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и основных свойств: дисперсности, равномерного распределения частиц дисперсной фазы в объеме дисперсной среды и характера взаимодействия между частицами.
Коагуляция под действием электролитов подчиняется правилу Шульце и Гарди, которое формулируется следующим образом: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы: коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора. Соотношение коагулирующей способности одно-, двух- и трехвалентных ионов приблизительно равно 1 : 30 : 1000.
Критическое значение концентрации, при котором данный электролит вызывает коагуляцию, называют порогом коагуляции и обозначают Ск (моль/л или ммоль/л).
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают Vk =Сk -1 . Коагулирующая способность выражает число объемов золя, скоагулированного 1 моль (или 1 ммоль) иона-коагулятора.
Пример 1. Вычисление порога коагуляции электролита с учетом его концентрации. В каждую из трех колб налито по 0,01 л золя хлорида серебра. Для коагуляции золя в первую колбу добавлено 0,002 л 1 н. NаNО3 во вторую — 0,012 л 0,01 н. Са(NО3)2, а в третью — 0,007л 0,001 н. А1(NО3)3. Вычислите пороги коагуляции электролитов и определите знак заряда частиц золя.
Решение. Минимальное количество Электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, называется порогом коагуляции с. Порог коагуляции принято выражать в миллимолях (ммоль) или миллиграмм-эквивалентах (мг-экв) электролита на 1 л золя.
Порог коагуляции можно вычислить по формуле
где N — концентрация электролита, г-экв/л; Vэл — объем электролита, л;
Вычисляем пороги коагуляции добавляемых электролитов;
Пример 2. Вычисление порога коагуляции электролита с учетом заряда иона-коагулятора. Порог коагуляции раствора КNО3 для золя гидроксида алюминия, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитайте порог коагуляции К3[Fе(СN)6] для этого золя.
Решение. Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. Коагулирующая способность иона определяется его зарядом: чем больше заряд иона, тем больше его коагулирующая способность. Значения порогов коагуляции электролитов с одно-, двух- и трехзарядными ионами относятся как числа 729 : 11 : 1. Следовательно, порог коагуляции К3(Fе(СN)6] будет в 729 раз меньше, чем у КNО3, т. е. Скз[Fе(СN)6] = 60/729 = 0,082 ммоль/л.
201. Пороги коагуляции золя электролитами оказались равными (мг-экв/л): CNaNOз = 250,0, CMg(NOз)2= 20,0, CFe(NOз)з = 0,5. Какие ионы электролитов являются коагулирующими? Как заряжены частицы золя?
202. Вычислите порог коагуляции раствора сульфата натрия, если добавление 0,003 л 0,1 н. Na2SO4 вызывает коагуляцию 0,015 л золя.
203. Как расположатся пороги коагуляции в ряду CrCl3, Ва(NО3)2, K2SO4 для золя кремниевой кислоты, частицы которого заряжены отрицательно?
204. Какой объем 0,0002М Fе(NО3)3 требуется для коагуляции 0,025 л золя сульфида мышьяка, если порог коагуляции СFе(NОз)з, = 0,067 мг-экв/л?
205. В три колбы налито по 0,1 л золя гидроксида железа. Для того чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,01 л 1 н. NH4C1, в другую —0,063 л 0,01 н. Na2SO4, в третью —0,037 л 0,001 н. Nа3РO4. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
206. Золь гидроксида меди получен при сливании 0,1 л 0,05 н. NaOH и 0,25 л 0,001 н. Сu(NО3)2. Какой из прибавленных электролитов : КВг, Ва(NО3)2, К2СгO4, MgSO4, А1С13 — имеет наименьший порог коагуляции?
207. Золь сульфида кадмия получен смешиванием равных объемов растворов Na2S и Сd(NО3)2. Пороги коагуляции для различных электролитов имеют следующие значения (мг-экв/л); С(Cа(NO3)2) = 265; C(NaCl) = 250, C(MgCl2) = 290, C(Na3PO4) = 0,4; C(Na2SO4) =15, C(AlCl3)=300. Какой из электролитов: Na2S или Сd(NО3)2—взят в избытке для приготовления золя?
208. Коагуляция золя иодида серебра, частицы которого заряжены отрицательно, вызывается катионами добавляемых электролитов. Порог коагуляции LiNО3 для этого золя равен 165 ммоль/л. Вычислите порог коагуляции Ва(NО3)2 и А1(NO3)3 для этого золя.
209. Как изменится порог коагуляции электролита для золя бромида серебра, частицы которого заряжены положительно, если для коагуляции 0,1 л золя вместо 0,0015 л 0,1 н. К2SО4 взят раствор Fе(NO3)3?
210. Для коагуляции 0,05 л золя сульфида мышьяка можно добавить один из следующих растворов электролитов: 0,005 л 2 н. NaCl; 0,005 л 0,03 н. Na2SO4; 0,004 л 0,0005 н. Na4[Fe(CN)6]. У какого из приведенных электролитов наименьший порог коагуляции?
211. Порог коагуляции АlСl3 для золя оксида мышьяка равен 0,093 мг-экв/л. Какой концентрации нужно взять раствор А1С13, чтобы 0,0008 л его хватило для коагуляции 0,125 л золя?
212. Вычислите порог коагуляции раствора сульфата натрия, если добавление 0,006 л 0,2 н. Na2SO4 вызывает коагуляцию 0,015 л золя.
213. Какой объем 0,0004М Fе(NО3)3 требуется для коагуляции 0,025 л золя гидроксида меди, если порог коагуляции СFе(NОз)з, = 0,067 мг-экв/л?
214. В три колбы налито по 0,1 л золя гидроксида алюминия. Для того чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,02 л 2 н. NH4C1, в другую —0,032 л 0,005 н. Na2SO4, в третью —0,064 л 0,002 н. Nа3РO4. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
215. Золь гидроксида никеля получен при сливании 0,1 л 0,05 н. NaOH и 0,25 л 0,001 н. Ni(NО3)2. Какой из прибавленных электролитов : NaВг, Ва(NО3)2, К2СгO4, MgSO4, А1С13 — имеет наименьший порог коагуляции?
216. Золь сульфида свинца получен смешиванием равных объемов растворов Na2S и Pb(NО3)2. Пороги коагуляции для различных электролитов имеют следующие значения (мг-экв/л); С(Cа(NO3)2) = 265; C(NaCl) = 250, C(MgCl2) = 290, C(Na3PO4) = 0,4; C(Na2SO4) =15, C(AlCl3)=300. Какой из электролитов: Na2S или Pb(NО3)2—взят в избытке для приготовления золя?
217. Коагуляция золя хлорида серебра, частицы которого заряжены отрицательно, вызывается катионами добавляемых электролитов. Порог коагуляции LiNО3 для этого золя равен 165 ммоль/л. Вычислите порог коагуляции Ва(NО3)2 и А1(NO3)3 для этого золя.
218. Как изменится порог коагуляции электролита для золя иодида серебра, частицы которого заряжены положительно, если для коагуляции 1 л золя вместо 0,015 л 0,1 н. К2SО4 взят раствор Fе(NO3)3?
219. Для коагуляции 0,01 л золя сульфида мышьяка можно добавить один из следующих растворов электролитов: 0,001 л 2 н. NaCl; 0,001 л 0,03 н. Na2SO4; 0,0008 л 0,0005 н. Na4[Fe(CN)6]. У какого из приведенных электролитов наименьший порог коагуляции?
220. Порог коагуляции АlСl3 для золя оксида мышьяка равен 0,093 мг-экв/л. Какой концентрации нужно взять раствор А1С13, чтобы 0,004 л его хватило для коагуляции 0,53 л золя?
Коагуляция коллоидных систем электролитами. Порог коагуляции. Правило Шульца-Гарди. Критическое значение электрокинетического потенциала.
1. Все без исключения сильные электролиты при определенной концентрации могут вызвать коагуляцию коллоидного раствора.
2. Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион электролита называют ионом-коагулятором.
3. Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции.
Порог коагуляции (γ, Скр) – некоторая минимальная (критическая) концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя:

где 
4. Влияние заряда (валентности) иона коагулятора (правило Шульце – Гарди). Коагулирующая способность электролита возрастает с увеличением валентности иона-коагулятора.

где 
5. Коагулирующая сила ионов-коагуляторов одной и той же валентности возрастает с увеличением радиуса иона-коагулятора (лиотропные ряды).
Критическое значение электрокинетического потенциала, при котором энергетический барьер исчезает и начинается коагуляция. Значение критического потенциала типичных лиофобных золей лежит в пределах от 30 до 70 мв.
Билет 10 Кинетическая и агрегативная устойчивость колл систем. Молекулярные и ионные стабилизаторы. Механизм их действия. Приведите примы стабилизации колл систем.
Устойчивость дисперсной системы – неизменность во времени ее основных параметров: дисперсности и равновесного распределения дисперсной фазы в дисперсионной среде.
Агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивлению их слипанию и тем самым удерживать определенную степень дисперсности (способность сохранять размер дисперсной фазы).
Седиментационная устойчивость – устойчивость дисперсной фазы по отношению к силе тяжести (способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды).
Факторы стабилизации дисперсных систем.
Различают следующие факторы стабилизации или устойчивости дисперсных систем: электростатический (термодинамический), связаны с образованием двойного электрического слоя (ДЭС) на поверхности частиц. ДЭС приводит не только к появлению зарядов, но и понижению поверхностной энергии (поверхностного натяжения) на границе раздела; адсорбционно – сольватационный (термодинам.), состоящий в снижении поверхностной энергии при адсорбции стабилизатора и молекул дисперсной среды на поверхности частиц; энтропийный(термодин.), проявл-ся в стремлении сист. к равномер. распред-ю частиц по объему; структурно – механический (термодинамический и кинетический), заключающийся в образовании слоев ПАВ и ВМС на поверхности частиц. Благодаря переплетению молекул ПАВ на поверхности частиц, образуются высоковязкая стабилизирующая прослойка, которая препятствует слипанию частиц.Стабилизация реальных дисперсных систем обеспечивается, как правило, действием нескольких факторов одновременно. Каждому фактору стабилизации подбирают метод его стабилизации. Например, электростатический фактор чувствителен к введению электролитов.
Адсорбция. Виды адсорбции. Изотерма, изобара, изостера, изопика адсорбции. Эмпирическое уравнение Фрейндлиха для изотермы адсорбции. Анализ уравнения. Графическое определение констант уравнения Фрейндлиха.
Эмпирическое уравнение Фрейндлиха для адсорбции имеет вид:
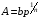
где А – удельная адсорбция; р – равновесное давление; b и n – константы, определяемые опытным путем.
Константы уравнения Фрейндлиха из опытных данных определяют графически. Для этого уравнение логарифмируют:
Изотерма адсорбции в координатах линейной формы уравнения Фрейндлиха

Строят линейную зависимость в координатах lgA–lg p.
Экстраполяция зависимости до оси ординат дает отрезок, равный lgb, тангенс угла наклона прямой равен:

Влияние поверхностных явлений на образование зародыша новый фазы при фазовых переходах.
Образование новых фаз связано с изменением агрегатного состояния однокомпонентной системы с протеканием хим реакций или с пониж растворимости одного из компонентов при изменении T, P и состава системы. Прежде чем образуется новая фаза, всегда образуется зародыш, рост которого определяется поверхностными явлениями.
Билет 11 Смачивание. Краевой угол. Лиофильность, лиофобность поверхностей. Влияние на смачивание условий образований поверхностей, присутствия ПАВ и т.п. Теплота смачивания.
Смачивание – взаимодействие жидкости с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом (воздух).
Краевой угол смачивания и уравнение Юнга.
Лиофильность и лиофобность поверхностей.
Поверхности, для которых угол смачивания изменяется в диапазоне 9О° 8 / 21 8 9 10 11 12 13 14 15 16 17 18 > Следующая > >>
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.