что такое полиморфизм в химии примеры
ПОЛИМОРФИЗМ
С точки зрения термодинамики, полиморфные модификации обычно являются фазами, причем различают два типа П. Если каждая из двух модификаций устойчива в определенном интервале т-р и давлений, эти фазы наз. энантио-тропными. В принципе одна энантиотропная фаза должна переходить в другую при вполне определенных условиях, и переход должен осуществляться в любом направлении. Однако энантиотропные превращения м. б. настолько кинетически заторможены, что метастабильная модификация существует неограниченно долго. Напр., алмаз и мн. др. минералы метастабильны при атм. давлении и комнатной т-ре. Вместе с тем, нек-рые полиморфные переходы протекают настолько быстро, что можно визуально наблюдать растрескивание кристалла или движение границы раздела фаз.
Если одна из двух модификаций термодинамически неустойчива при всех т-рах ниже точки плавления, эти две модификации наз. монотропными (напр., модификации пропилбензола). В этом случае осуществим только односторонний переход метастабильной модификации в стабильную. Метастабильную фазу можно получить только из переохлажденной жидкости (или пара). При энантиотропии каждой из двух модификаций соответствует определенная область на диаграмме состояния; при монотропии такая область имеется лишь для устойчивой модификации. Интерпретация таких диаграмм состояния осуществляется с помощью кривых зависимости своб. энергии Fот т-ры при постоянном давлении. Поскольку при любой т-ре устойчива фаза с миним. своб. энергией, в случаях, показанных на рис. а и б, модификации I и II соотв. энантиотропны и монотропны (точки пересечения кривых отвечают равновесию модификаций между собой и с жидкой фазой).
Лит.: Физика и химия твердого состояния органических соединений, пер. с англ., М., 1967; Проблемы физики и химии твердого состояния органических соединений, пер. с англ., М., 1968; Верма А., Рам Кришна П., Полиморфизм и политипизм в кристаллах, пер. с англ., М., 1969; Бок и и Г. Б., Кристаллохимия, 3 изд., М., 1971; Изюмов Ю. А., Сыромятников В. Н., Фазовые переходы и симметрия кристаллов, М., 1984. П. М. Зоркий.
Полиморфизм кристаллов
Полиморфи́зм криста́ллов (от др.-греч. πολύμορφος «многообразный») — способность вещества существовать в различных кристаллических структурах, называемых полиморфными модификациями (их принято обозначать греческими буквами α, β, γ и т. д.)
Характерен для различных классов веществ. Полиморфизм для простых веществ называют аллотропией.
Частный случай полиморфизма, характерный для соединений со слоистой структурой — политипи́зм (политипи́я). Такие модификации, политипы, отличаются между собой лишь порядком чередования атомных слоёв.
Содержание
История открытия
Открыт в 1798 году М. Клапротом на примере карбоната кальция, для которого были обнаружены две модификации кальцит и арагонит.
Причины возникновения полиморфизма
Полиморфизм объясняется тем, что одни и те же атомы вещества могут образовывать различные устойчивые кристаллические решётки, соответствующие минимумам на поверхности энергии Гиббса. Стабильной модификации отвечает глобальный минимум, метастабильным — локальные минимумы. При повышении температуры более прочная кристаллическая решётка низкотемпературной модификации может характеризоваться меньшей энтропией за счёт того, что она менее восприимчива к возбуждению тепловых колебаний, поэтому другая модификация, характеризующаяся более крутой зависимостью энергии Гиббса от температуры, становится более выгодной.
Термодинамика и кинетика полиморфизма
При заданных условиях (температура, давление и др.) одна из модификаций является термодинамически стабильной, другие — метастабильными. При изменении условий может оказаться стабильной другая модификация. Условия, при которых стабильна каждая из модификаций, изображаются на фазовой диаграмме соответствующего вещества. Переход из метастабильной модификации в стабильную, выгодный термодинамически, не всегда можно наблюдать на практике, так как он зачастую связан с кинетическими затруднениями. Примером является алмаз, полиморфная модификация углерода, которая при нормальных условиях метастабильна, но существует неограниченно долго. Это объясняется тем, что для перестройки кристаллической решётки требуется преодолеть энергетический барьер. Во многих случаях удаётся закалить высокотемпературную модификацию до комнатной температуры. Не удаётся закалить высокотемпературную фазу в случае мартенситных превращений, характеризующихся бездиффузионным переходом.
Литература
См. также
Полезное
Смотреть что такое «Полиморфизм кристаллов» в других словарях:
Полиморфизм — В Викисловаре есть статья «полиморфизм» Полиморфизм (от греч. πολὺ много, и … Википедия
ПОЛИМОРФИЗМ (в минералогии) — ПОЛИМОРФИЗМ (от поли. (см. ПОЛИ. (часть сложных слов)) и греч. morphe форма), свойство некоторых веществ существовать в нескольких кристаллических фазах, отличающихся по симметрии структуры и по свойствам. Каждая из этих фаз, стабильная в… … Энциклопедический словарь
ПОЛИМОРФИЗМ — (от греч. polymorphos многообразный), способность нек рых в в существовать в состояниях с разл. атомно крист. структурой (см. КРИСТАЛЛОХИМИЯ). Каждое из таких состояний (термодинамич. фаз), наз. п о л и м о р ф н о й м о д и ф и к а ц и е й,… … Физическая энциклопедия
ПОЛИМОРФИЗМ — ПОЛИМОРФИЗМ, в минералогии существование вещества в двух (диморфных) или нескольких формах КРИСТАЛЛОВ с разной структурой. Полиморфизм происходит из за разницы температуры или давления, или и того, и другого, при отложении тех или иных пород.… … Научно-технический энциклопедический словарь
Полиморфизм (в физике) — Полиморфизм (от греч. polýmorphos ‒ многообразный) в физике, минералогии, химии, способность некоторых веществ существовать в состояниях с различной атомной кристаллической структурой. Каждое из таких состояний (термодинамических фаз), называется … Большая советская энциклопедия
ПОЛИМОРФИЗМ — (от греч. polymorphos многообразный), способность твердых в в и жидких кристаллов существовать в двух или неск. формах с разл. кристаллич. структурой и св вами при одном и том же хим. составе. Такие формы наз. полиморфными модификациями. Взаимные … Химическая энциклопедия
Полиморфизм в минералогии* — В начале текущего столетия Гаю установил закон, который гласил, что каждому химическому соединению в твердом состоянии соответствует одна определенная внешняя форма. Почти одновременно с этим начали накопляться факты, постепенно видоизменившие… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полиморфизм химический — В начале текущего столетия Гаю установил закон, который гласил, что каждому химическому соединению в твердом состоянии соответствует одна определенная внешняя форма. Почти одновременно с этим начали накопляться факты, постепенно видоизменившие… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полиморфизм — I Полиморфизм (от греч. polýmorphos многообразный) в физике, минералогии, химии, способность некоторых веществ существовать в состояниях с различной атомной кристаллической структурой. Каждое из таких состояний (термодинамических фаз),… … Большая советская энциклопедия
Генезис кристаллов — Кристаллы могут образоваться во всех тех случаях, когда частицы тела, способного кристаллизоваться, приведены в состояние удобоподвижности: когда это тело растворено, расплавлено или находится в парообразном состоянии. При испарении жидкости из… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Полиморфизм химический
Полезное
Смотреть что такое «Полиморфизм химический» в других словарях:
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Железо — (Ferrum) Металл железо, свойства металла, получение и применение Информация о металле железо, физические и химические свойства металла, добыча и применение железа Содержание Содержание Определение термина Этимология История железа Происхождение… … Энциклопедия инвестора
Клапрот Мартин Генрих — (Klaproth) (1743 1817), немецкий химик, иностранный член Петербургской АН (1805). Открыл уран и цирконий (1789), титан (1795), явление полиморфизма (1798). * * * КЛАПРОТ Мартин Генрих КЛАПРОТ (Klaproth) Мартин Генрих (1743 1817), немецкий химик,… … Энциклопедический словарь
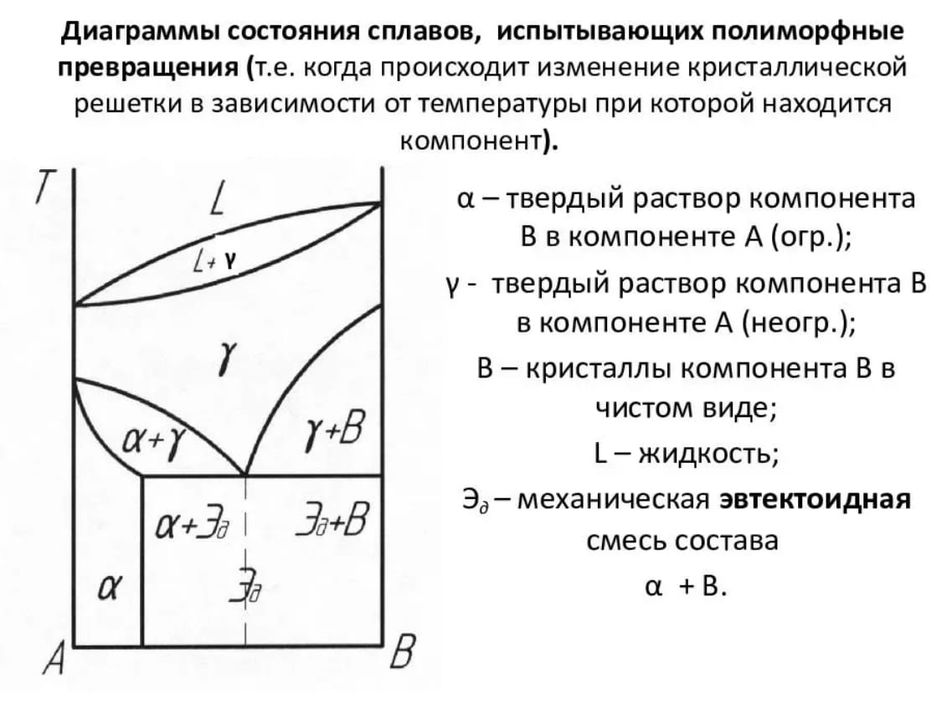
диаграмма состояния — [phase equilibrium diagram] геометрическое изображение фазовых равновесий при разных значениях термодинамических параметров: температуры, давления и концентраций компонентов в фазах. В случае систем, не содержащих газовую фазу, слабым влиянием… … Энциклопедический словарь по металлургии
Отряд Перепончатокрылые (Нутеnoptera) — Отряд перепончатокрылых насекомых насчитывает около 90 000 видов и по числу видов уступает лишь жукам и бабочкам. К этому отряду относятся как довольно примитивные пилильщики, ложногусеницы которых, похожие на гусениц бабочек, питаются… … Биологическая энциклопедия
Подкласс Открыточелюстные или Настоящие насекомые (Insectа Ectognatha) — Основные сведения о насекомых Из общего числа видов животных, населяющих Землю, на долю насекомых приходится около 70%. Число уже описанных видов приближается к миллиону, но ежегодно специалисты открывают и описывают все новые и… … Биологическая энциклопедия
ТВЁРДОЕ ТЕЛО — агрегатное состояние в ва, характеризующееся стабильностью формы и хар ром теплового движения атомов, к рые совершают малые колебания вокруг положений равновесия. Различают крист. и аморфные Т. т. Кристаллы характеризуются пространств.… … Физическая энциклопедия
Кровь — жидкая ткань, циркулирующая в кровеносной системе человека и животных; обеспечивает жизнедеятельность клеток и тканей и выполнение ими различных физиологических функций. Одна из основных функций К. транспорт газов (O2 от органов… … Большая советская энциклопедия
Владимир Алексеевич Дуров — (КИСС) (29 января 1950 г. ) российский физико химик, профессор МГУ им. М. В. Ломоносова. Окончил Химический факультет МГУ (1973 г.), кандидат химических наук (1978), доктор химических наук (1989), ученое звание профессора (1993). Автор более… … Википедия
главная > справочник > химическая энциклопедия:
Полиморфизм
Полиморфизм (от греч. polymorphos-многообразный), способность твердых веществ и жидких кристаллов существовать в двух или неск. формах с разл. кристаллич. структурой и свойствами при одном и том же хим. составе. Такие формы наз. полиморфными модификациями. Взаимные превращения полиморфных модификаций наз. полиморфными переходами. Полиморфизм простых веществ принято называть аллотропией, но понятие полиморфизма не относят к некристаллич. аллотропным формам (таким, как газообразные О 2 и О 3 ). Полиморфизм широко распространен в самых разнообразных классах веществ. Типичный пример полиморфных форм – модификации углерода. алмаз и лонсдейлит, в которых атомы объединены ковалентными связями в пространств. каркас; графит. в структуре которого имеются слои наиб. прочно связанных атомов; карбин. построенный из бесконечных линейных цепочек. Эти модификации резко различаются по свойствам. В случае молекулярных кристаллов (в частности, орг. веществ) полиморфизм проявляется в разл. упаковке молекул, имеющих одинаковую структурную ф-лу; здесь переход от одной модификации к другой осуществляется без разрыва ковалентных связей, но конформация молекул может существенно меняться (конформационный полиморфизм).
С точки зрения термодинамики. полиморфные модификации обычно являются фазами, причем различают два типа полиморфизма. Если каждая из двух модификаций устойчива в определенном интервале температур и давлений. эти фазы наз. энантиотропными. В принципе одна энантиотропная фаза должна переходить в другую при вполне определенных условиях, и переход должен осуществляться в любом направлении. Однако энантиотропные превращения м. б. настолько кинетически заторможены, что метастабильная модификация существует неограниченно долго. Напр., алмаз и мн. др. минералы метастабильны при атм. давлении и комнатной температуре. Вместе с тем, некоторые полиморфные переходы протекают настолько быстро, что можно визуально наблюдать растрескивание кристалла или движение границы раздела фаз.
Если одна из двух модификаций термодинамически неустойчива при всех температурах ниже точки плавления, эти две модификации наз. монотропными (напр., модификации пропилбензола). В этом случае осуществим только односторонний переход метастабильной модификации в стабильную. Метастабильную фазу можно получить только из переохлажденной жидкости (или пара). При энантиотропии каждой из двух модификаций соответствует определенная область на диаграмме состояния; при монотропии такая область имеется лишь для устойчивой модификации. Интерпретация таких диаграмм состояния осуществляется с помощью кривых зависимости своб. энергии F от температуры при постоянном давлении. Поскольку при любой температуре устойчива фаза с миним. своб. энергией, в случаях, показанных на рис. а и б, модификации I и II соотв. энантиотропны и монотропны (точки пересечения кривых отвечают равновесию модификаций между собой и с жидкой фазой).
Лит.: Физика и химия твердого состояния органических соединений, пер. с англ., М., 1967; Проблемы физики и химии твердого состояния органических соединений, пер. с англ., М., 1968; Верма А., Рам Кришна П., Полиморфизм и политипизм в кристаллах, пер. с англ., М., 1969; Бок и и Г. Б., Кристаллохимия, 3 изд., М., 1971; Изюмов Ю. А., Сыромятников В. Н., Фазовые переходы и симметрия кристаллов, М., 1984. © П.М. Зоркий.
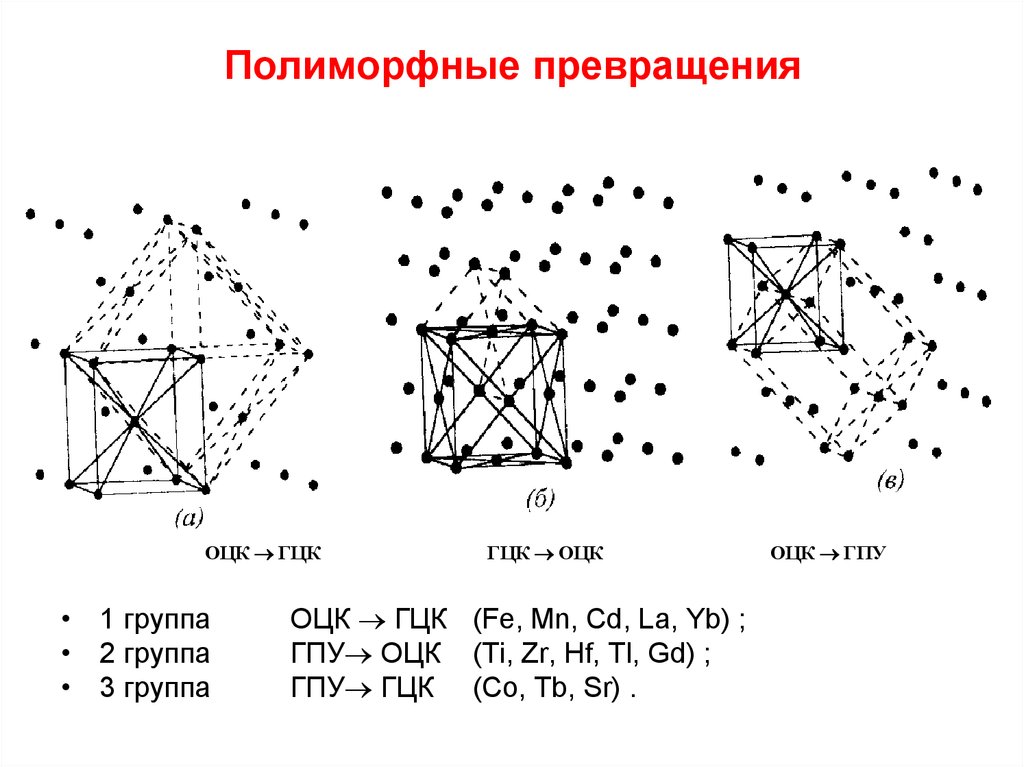
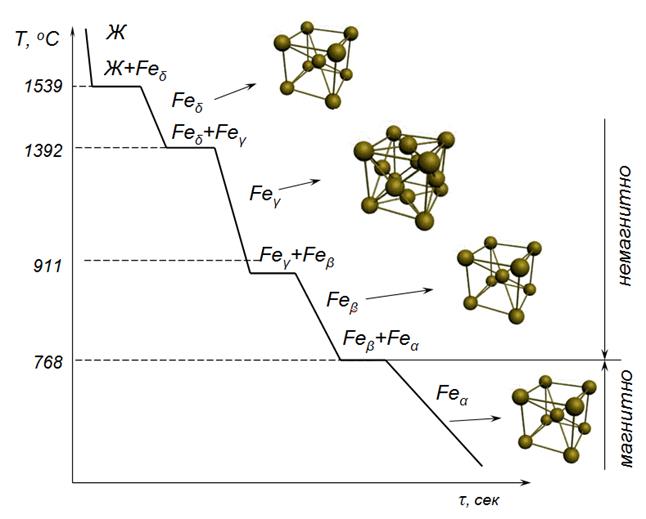
Механизм полиморфных превращений в металлах
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.