что такое пмд в медицине
Прогрессирующая мышечная дистрофия Дюшенна
Прогрессирующая мышечная дистрофия Дюшенна — наследуемая сцеплено с Х-хромосомой патология мышечной системы, проявляющаяся в первые 3-5 лет жизни и характеризующаяся быстро распространяющейся и усугубляющейся мышечной слабостью. Первоначально поражаются мышцы тазового пояса и бедер, затем — плеч и спины, постепенно наступает обездвиженность. Миодистрофия сопровождается скелетными деформациями и поражением сердца. Диагностика дистрофии Дюшенна включает неврологическое и кардиологическое обследование, определение уровня КФК, электромиографию, консультацию генетика, ДНК-анализ, биопсию мышц. Лечение симптоматическое. В связи со слабостью дыхательной мускулатуры на заключительном этапе заболевания требуется ИВЛ.
Общие сведения
Причины мышечной дистрофии Дюшенна
Развитие мышечной дистрофии Дюшенна связано с наличием мутации в 21-ом локусе короткого плеча Х-хромосомы в гене, кодирующем белок дистрофин. Около 70% случаев болезни вызваны дефектным геном дистрофина, полученным от матери — носительницы патологической мутации. Остальные 30% связаны с появлением свежих мутаций в яйцеклетках матери. В отличие от миодистрофии Беккера, при дистрофии Дюшенна генетические аберрации приводят к сдвигу рамки считывания ДНК и полному прекращению синтеза дистрофина, что и обуславливает более тяжелое течение патологии.
В норме входящий в сарколемму миоцитов дистрофин обеспечивает ее целостность и устойчивость к растяжению, возникающему при сократительной активности мышечных волокон. Отсутствие дистрофина влечет за собой нарушение целостности сарколеммы, разрушение миоцитов и их замещение жировой и соединительной тканью. Клинически этот процесс выражается прогрессирующим снижением способности мышц к сокращению, утратой мышечной силы и тонуса, атрофией мышц.
Симптомы мышечной дистрофии Дюшенна
Дебют миодистрофии Дюшенна приходится на период от 1 до 5 лет. Как правило, уже на 1-ом году жизни заметно некоторое отставание моторного развития ребенка. Отмечается задержка сроков начала сидения, самостоятельного вставания и ходьбы. Когда ребенок начинает ходить, он отличается неуклюжестью и большей, по сравнению со сверстниками, неустойчивостью; часто спотыкается.
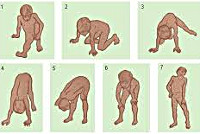
Мышечная слабость возникает на 3-4-ом годах жизни. Первоначально она выражается в патологически повышенной утомляемости при ходьбе по лестнице или на длинные расстояния. Со временем становится заметной типичная для миодистрофий утиная походка. Обращают на себя внимание особенности поведения ребенка — каждый раз, поднимаясь из положения сидя на корточках, он активно опирается руками о собственное тело, как бы взбираясь по нему как по лесенке (симптом Говерса).
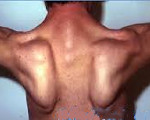
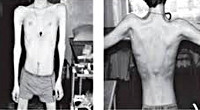
Мышечные атрофии начинаются с мышц бедер и тазового пояса. Для дистрофии Дюшенна характерно их быстрое восходящее распространение на плечевой пояс, мускулатуру спины и проксимальных отделов рук. Вследствие мышечных атрофий формируется «осиная» талия и отстоящие от спины «крыловидные» лопатки. Типичным симптомом выступает псевдогипертрофия икроножных мышц. Наблюдается выпадение сухожильных рефлексов: вначале — коленных, затем — рефлексов с трицепса и бицепса плеча. Ахилловы и карпорадиальные рефлексы могут длительное время быть сохранны. Со временем развиваются ретракции сухожилий и мышечные контрактуры.
Прогрессирующая мышечная дистрофия Дюшенна сопровождается нарушениями в костно-суставной системе. Характерны искривление позвоночника (кифоз, усиленный лордоз, сколиоз), деформации грудной клетки (килевидная или седловидная), деформации стоп. Сердечно-сосудистые расстройства обусловлены развитием кардиомиопатии и включают аритмию, лабильность артериального давления, глухость тонов сердца. У 50% больных фиксируются нейроэндокринные расстройства — адипозогенитальная дистрофия, синдром Иценко-Кушинга и др. Около 30% больных страдает олигофренией, как правило, ограничивающейся степенью дебильности. Могут отмечаться СДВГ, расстройства по типу аутизма, дислексия, нарушения краткосрочной памяти.
Уже к 7-10-летнему возрасту дистрофия Дюшенна приводит к выраженным двигательным ограничениям. К 12 годам больные, как правило, утрачивают способность ходить, а к возрасту 15 лет большинство пациентов полностью теряют возможность самостоятельных движений. Распространение дистрофического процесса на дыхательную мускулатуру приводит к прогрессирующему падению жизненной емкости легких (ЖЕЛ) и, в конечном итоге, невозможности совершать дыхательные движения.
Диагностика мышечной дистрофии Дюшенна
Установить диагноз миодистрофии Дюшенна помогает анамнез, неврологическое обследование, результаты электрофизиологического тестирования, определение креатинфосфокиназы (КФК) в биохимическом анализе крови, морфологическое и иммунохимическое исследование образцов мышечной ткани, генетическое консультирование и анализ ДНК. При этом дифференциальную диагностику следует проводить с другими миопатиями — метаболической, воспалительной, миодистрофией Беккера, мышечной дистрофией Дрейфуса, дистрофией Эрба-Рота, а также с полиневропатиями, полимиозитом, БАС.
Электронейро- и электромиография определяют сохранность проведения импульсов по нервным волокнам, пониженную амплитуду М-ответа, что свидетельствует о первично-мышечном типе поражения. Характерным является 30-50-кратный подъем уровня креатинфосфокиназы. На консультации генетика проводится генеалогическое исследование, позволяющее выявить наличие случаев миодистрофии Дюшенна в семье больного и определить женщин, являющихся носительницами мутантного гена дистрофина. Диагностика ДНК позволяет выявить аномалии в гене дистрофина. Следует учитывать, что невыявление мутации при ДНК-анализе не говорит о ее отсутствии, поскольку поиск точковых мутаций обычно не входит в задачи анализа из-за его большой длительности и трудоемкости.
В случаях, когда имеется клиническая картина миодистрофии, а анализ ДНК не выявил наличие мутации, показана биопсия мышц. Морфологическое исследование биоптата определяет разнокалиберность и некроз миоцитов, их замещение соединительнотканными элементами. Иммунохимический анализ говорит о полном отсутствии дистрофина в исследуемых мышечных волокнах.
Дополнительно осуществляется обследование костно-мышечной и сердечно-сосудистой систем — проводится консультация ортопеда, рентгенография позвоночника, обзорная рентгенография ОГК, консультация кардиолога, ЭКГ, эхокардиография. По показаниям рекомендуется консультация эндокринолога, пульмонолога и др. специалистов.
Лечение мышечной дистрофии Дюшенна
Терапия, применяемая в клинической практике, пока включает лишь необходимые симптоматические мероприятия. Для улучшения метаболизма мышечной ткани возможно назначение анаболических стероидов (метандиенона, нандролона деканоата), АТФ, актопротекторов (этилтиобензимидазола); для облегчения нервно-мышечной передачи — неостигмина. С целью минимизировать образование контрактур и продлить двигательную активность пациентов проводится ЛФК, массаж, физиотерапия.
Важное значение имеет контроль дыхательной функции и газового состава крови. При падении ЖЕЛ до 40% рекомендована искусственная вентиляция легких в период сна. В дальнейшем время ИВЛ растет пропорционально снижению ЖЕЛ. В начале ИВЛ может осуществляться при помощи масочного аппарата. Затем необходима трахеостомия, и ИВЛ проводится путем присоединения аппарата к трахеостомической трубке. Современные портативные аппараты ИВЛ работают на батареях и могут быть закреплены на инвалидной коляске.
Поиск эффективных способов лечения дистрофии Дюшенна — задача, над решением которой трудятся сегодня специалисты в области неврологии, биохимии, генной инженерии. Из перспективных разработок в этом направлении можно выделить лечение стволовыми клетками, активацию гена утрофина, являющегося наиболее близким аналогом дистрофина, технологию пропуска экзонов.
Прогноз и профилактика
Профилактические мероприятия направлены на выявление женщин-носительниц аномального гена дистрофина и предупреждение рождения у них больного ребенка. В рамках профилактических мер проводятся консультации генетика для планирующих беременность супружеских пар, консультации беременных и пренатальная ДНК-диагностика.
Прогрессирующая мышечная дистрофия Эрба-Рота
Прогрессирующая мышечная дистрофия Эрба-Рота — аутосомно-рецессивная наследственная миодистрофия, отличающаяся полиморфизмом клинических проявлений и вариативностью скорости прогрессирования симптомов. Может носить нисходящий характер, т. е. начинаться со слабости в проксимальных отделах рук, но чаще имеет стандартный восходящий тип распространения мышечных изменений. Диагностика осуществляется методами неврологического осмотра, электрофизиологического тестирования, генеалогического исследования и генетического анализа, по показаниям проводится гистологический анализ биоптата мышечной ткани. Лечение только симптоматическое, позволяющее лишь продлить двигательную активность пациентов. Итог заболевания — полная обездвиженность.
Общие сведения
Причины миодистрофии Эрба-Рота
Субстратом дистрофии Эрба-Рота являются патологические метаболические и структурные изменения в мышечной ткани (миопатия). Они возникают в результате генетических мутаций, приводящих к недостатку или полному прекращению синтеза белков, являющихся необходимыми структурными компонентами миоцитов. На сегодняшний день генетике известно не менее 9 хромосомных локусов, аберрации в которых приводят к развитию миодистрофии Эрба-Рота. Чаще всего наблюдаются мутации в локусах 15q15-q21.1, 13q.
Около 30% генных аномалий возникают de novo, остальные носят семейный характер. Наследуется мышечная дистрофия Эрба-Рота аутосомно-рецессивно. Болеют как мальчики, так и девочки. Патология проявляется, если ребенок получает аномальный ген от каждого из родителей. В случае, когда оба родителя выступают носителями аберрантного гена, но сами не болеют, вероятность развития миодистрофии у ребенка составляет 25%.
Симптомы миодистрофии Эрба-Рота
Прогрессирующая мышечная дистрофия Эрба-Рота манифестирует в среднем в возрасте 13-16 лет. Однако известны отдельные случаи дебюта болезни в раннем детском возрасте и в возрасте после 20 лет. Мышечная слабость и атрофии возникают в первую очередь в мускулатуре тазового пояса и проксимальных отделов ног. Отмечаются затруднения ходьбы по лестнице, подъема из положения присев на корточки. Типичен симптом Говерса — если пациент сидел на полу, то для того, чтобы подняться, он использует собственное тело как опору.
Со временем дистрофические изменения распространяются на мышечные группы туловища и рук. Такой тип распространения миодистрофии носит название восходящий. Он наиболее типичен для большинства наследственных мышечных дистрофий. Однако в некоторых случаях дистрофии Эрба-Рота наблюдается нисходящий тип распространения патологического процесса, когда мышечная слабость возникает вначале в руках, затем в тазовом поясе, а через несколько лет в мышцах ног.
Тотальная гипотрофия мышц туловища приводит к тому, что у пациентов начинают выступать лопатки (т. н. «крыловидные лопатки»), талия становиться очень тонкой (т. н. «осиная талия»), усиливается поясничный лордоз, живот выпячивается вперед. Характерен симптом свободных надплечий — при попытке приподнять больного вверх, удерживая его за подмышки, плечи пациента свободно движутся вверх и голова будто бы «проваливается» между ними. Поражение лицевых мышц влечет за собой гипомимию (т. н. «лицо сфинкса»), неполное закрытие век, выворачивание и утолщение губ.
Миодистрофия Эрба-Рота сопровождается ранним угасанием коленных рефлексов, а также сухожильных рефлексов с плечевого бицепса и трицепса. Чувствительная сфера не нарушена. Псевдогипертрофии не столь характерны, как при мышечной дистрофии Беккера. Могут наблюдаться ретракции сухожилий и мышечные контрактуры, но они выражены в меньшей степени, чем аналогичные проявления мышечной дистрофии Дрейфуса. Со временем атрофия и слабость дыхательных мышц приводит к появлению прогрессирующей дыхательной недостаточности, возникает опасность развития застойной пневмонии. Миодистрофический процесс в гладкой мускулатуре обуславливает снижение кишечной перистальтики с тенденцией к запорам. Поражение сердечной мышцы влечет за собой возникновение кардиомиопатии, нарушений ритма, сердечной недостаточности.
Диагностика миодистрофии Эрба-Рота
Миодистрофия Эрба-Рота диагностируется неврологом и генетиком при сопоставлении данных анамнеза (возраст дебюта заболевания, последовательность развития симптомов), неврологического статуса пациента, ЭФИ нервно-мышечной системы, генеалогических данных, результатов анализа ДНК и микроскопического исследования мышечной ткани. Дифференцировать миодистрофию Эрба-Рота приходится от других форм этого заболевания (прогрессирующей дистрофии Дюшенна, миодистрофии Дрейфуса и Беккера), дерматомиозита, полимиозита, бокового амиотрофического склероза, токсической миопатии и др.
При неврологическом осмотре обращает на себя внимание снижение мышечной силы в мускулатуре проксимальных отделов ног и рук, гипотония и гипотрофия указанных мышц, гипорефлексия или полное выпадение локтевых и коленных рефлексов, сохранность всех видов чувствительности. ЭМГ и ЭНГ свидетельствуют о первичном поражении мышечной ткани при сохранности проведения импульсов по нервным стволам.
Генеалогическое исследование подтверждает аутосомно-рецессивный характер наследования. Исследование ДНК может выявить наличие генных мутаций. Однако отрицательный результат исследования не опровергает диагноз, поскольку не всякая мутация может быть обнаружена. Отрицательный анализ ДНК является показанием к биопсии мышц. В биоптате обнаруживаются различные по толщине мышечные волокна, уменьшенное число мышечных ядер, некротические и склеротические изменения.
Резкое повышение уровня креатинфосфокиназы характерно для начального периода дистрофии Эрба-Рота, затем происходит постепенное понижение этого показателя вплоть до нормальных цифр. Обзорная рентгенография грудной клетки позволяет выявить расширение границ сердца, наличие воспалительных изменений легочной ткани. ЭКГ зачастую определяет аритмию и нарушения проводимости. При помощи УЗИ сердца можно диагностировать кардиомиопатию. Для оценки степени сердечных нарушений требуется консультация кардиолога, при подозрении на пневмонию — консультация пульмонолога.
Лечение миодистрофии Эрба-Рота
Этиопатогенетическая терапия пока не разработана. Симптоматическое лечение направлено на как можно более длительное сохранение двигательной способности пациента. С этой целью применяют медикаментозные курсы, включающие АТФ, витамины Е и группы В, тиоктовую кислоту и др. Занятия лечебной физкультурой должны проводиться ежедневно и включать упражнения на все группы мышц. Регулярно назначаются курсы массажа и физиопроцедуры.
При поражении сердечной мышцы рекомендован инозин, сердечные гликозиды, антиаритмики. При развитии контрактур может потребоваться ортопедическое лечение. Выраженное снижение жизненной емкости легких из-за атрофии дыхательных мышц служит показанием к ИВЛ.
Прогноз и профилактика
Мышечная дистрофия Эрба-Рота может иметь различную тяжесть и скорость прогрессирования, что бывает выражено даже в пределах одной семьи. Описаны тяжелые дюшенноподобные варианты заболевания с ранним летальным исходом от дыхательной недостаточности, инфекционных поражений легких или сердечной недостаточности. В относительно легких вариантах миодистрофия может протекать без поражения сердечной мышцы, обездвиженность больных наступает лишь к 50-летнему возрасту. Профилактикой является своевременное генетическое консультирование семейных пар, планирующих зачатие ребенка; исключение близкородственных браков, в которых оба супруга могут стать носителями патологического гена.
Прогрессирующие мышечные дистрофии
Прогрессирующие мышечные дистрофии (ПМД) — гетерогенная группа наследственных заболеваний, характеризующихся прогрессирующей мышечной слабостью и атрофией скелетных мышц.
КЛИНИЧЕСКАЯ КАРТИНА
СИМПТОМЫ
При ПМД Дюшенна, Беккера, конечностно-поясных формах проявляется наиболее выраженная слабость в пояснично-подвздошных мышцах, мышцах бёдер, дельтовидных, дву- и трёхглавых мышцах плеча. Менее выражена слабость в дистальных мышцах конечностей. Лицевые мышцы остаются сохранными. Наряду с мышечной слабостью постепенно развиваются гипотрофии поражённых мышц вплоть до атрофии на поздних стадиях. При этом соседние мышцы могут быть полностью клинически интактны.
ЛЕЧЕНИЕ
Лечение должно производиться исключительно врачом-неврологом. Самолечение недопустимо. В настоящий момент радикального лечения ПМД не существует. Цель лечения — поддержание мышечной силы, предупреждение развития контрактур, деформаций суставов.
Немедикаментозное лечение
Чрезмерная физическая нагрузка, как и недостаточная, приводит к нарастанию мышечной слабости. Ежедневная ЛФК позволяет поддерживать мышечный тонус и препятствует развитию контрактур. Комплекс ЛФК обязательно должен включать активные и пассивные упражнения, упражнения на растяжку/предупреждение контрактур и дыхательную гимнастику. Активный массаж с разминанием мышц может усиливать мышечную слабость и утомляемость, поэтому рекомендуют щадящий массаж. Физиотерапевтическое лечение больные переносят по-разному: некоторые не ощущают улучшений или даже жалуются на усиление мышечной слабости.
Хирургическое лечение
В некоторых случаях возможно хирургическое лечение контрактур, однако при этом необходимо помнить о возможности увеличения мышечной слабости за время восстановительного лечения (вплоть до потери способности к ходьбе). В ряде случаев необходима имплантация кардиостимулятора.
МОИ 03 Невролог в Волгограде
К.М.Н. Борзенко Сергей Яковлевич. Невролог
Волгоград тел. сот. : 89023871619
Определение
Прогрессирующие мышечные дистрофии
— являются группой наследственных заболеваний, причина — генный дефект, который ведет к первичному поражению мышц, имеют неуклонно прогрессирующее течение.
В настоящее время известны основы прогрессирующих мышечных дистрофий, особенно типа Дюшенна, там ген расположен на коротком плече Х-хромосомы (Х21). Мутация приводит к полному отсутствию белка дистрофина (продукта этого гена). У здоровых дистрофии находится в больших количествах в мышцах и в ткани мозга. Отсутствие дистрофина нарушает целостность сарколеммы мышцы, что ведет к потере внутриклеточных компонентов, повышенному входу кальция и, как следствие, к гибели миофибрилл. Дефицит дистрофина в ткани головного мозга у больных прогрессирующей мышечной дистрофией Дюшенна может быть причиной олигофрении. Кодирующий дистрофии ген является дефектным и при дистрофии Беккера.
Мышечная дистрофия прогрессирующая — течение и прогноз
Определяются генетическим фактором, а следовательно, клиническими особенностями. Применение ДНК-диагностики дает возможность прогноза течения и исходов заболевания в каждом конкретном случае. Сведения о примерных сроках начала, продолжительности заболевания при наиболее значимых клинических формах миодистрофий приведены выше. В целом формы ПМД с доминантным типом наследования протекают благоприятнее, позднее манифестируют, чем с рецессивным.
Целесообразно выделять стадии течения миодистрофического процесса (Бадалян Л. О., 1974):
I стадия — с умеренно выраженными двигательными нарушениями (больные могут ходить, выполнять легкую работу, слабость выявляется при нагрузке);
II стадия — с выраженными двигательными затруднениями при ходьбе, подъеме по лестнице, при выполнении физической
работы;
III стадия — паралитическая: грубые контрактуры, деформации, самостоятельное передвижение невозможно.
Важное социальное значение имеют темп прогрессирования заболевания и возраст больного к его началу. Известно, что больные с ПМД Ландузи-Дежерина, Беккера, при позднем начале формы Эрба-Рота часто могут до начала болезни получить образование, специальность, что во многом определяет их реабилитационныи потенциал, позволяет уменьшить степень социальной недостаточности.
Можно говорить о вариантах течения патологического процесса:
1) неблагоприятный вариант — обездвиженность через 5— 10 лет от начала болезни, быстрое нарастание степени нарушения
жизнедеятельности, тяжести инвалидности;
2) средний темп прогрессирования — через 10—15 лет имеются выраженные двигательные нарушения, прогноз в отношении
возможности самообслуживания плохой;
3) медленный темп прогрессирования — через 10—15 лет от
начала болезни нет выраженных двигательных нарушений, больной свободно передвигается, трудовой прогноз на ближайшие годы относительно благоприятен, возможна частичная трудовая адаптация, иногда оправдано профессиональное обучение.
Мышечная дистрофия — принципы лечения:
Показания к госпитализации: а) необходимость уточнения диагноза, определения формы ПМД или непрогрессирующей ми-опатии, разработки схемы лечения; б) для очередного курса поддерживающей терапии (желательно 1—2 раза в год).
Терапевтические возможности весьма ограничены. Л. П. Гринио и Б. В. Агафонов (1997) выделяют: 1) лечение на клиниче¬ском уровне: терапевтические мероприятия общеукрепляющего характера, хирургические вмешательства, ортопедическая и социальная помощь; 2) лечение с учетом выявленного метаболического дефекта: введение недостающего субстрата, удаление или инактивация токсических продуктов метаболизма, введение ингибиторов, кофакторов витаминов, недостающего белка; 3) трансплантацию органа: введение миобластов или эмбриональной ткани; 4) генную инженерию. Большинство из предложенных метдов находятся в стадии разработки. Это, в частности, относится к трансплантации фетальных тканей человека (эмбриональных мышц и др.).
Лечение должно быть постоянным. Его цель — замедлить про-грессирование болезни и социальную дезадаптацию больного. Медикаментозная терапия направлена на коррекцию нарушений обмена, кислородного обеспечения, энергетического дисбаланса в мышце. При кардиомиопатии — рибоксин, кокарбоксилаза, калия оротат. На нарушение белкового обмена положительно влияют аминокислоты (глутаминовая, метионин), липидного — эссенциале. Используются церебролизин, анаболические гормоны (только в I стадии болезни). Улучшение кислородного обеспечения осуществляется сосудорасширяющими, вазоактивными препаратами (инстенон, актовегин и др.), оксигенобаротерапией. Для компенсации нарушений энергетических процессов назначают АТФ, бемитил, цитохром С; для улучшения проведения нервного импульса «±
антихолинэстеразные препараты (оксазил, галантамин). Положительно оценивается лечение препаратом «энкад»
Противопоказанные виды и условия труда
1) Все виды интенсивного физического труда, работы с вынужденным положением тела, с длительным напряжением определенной группы мышц, с предписанным темпом (на конвейере, в бригаде), водительские профессии’, 2) работы, связанные с воздействием токсических веществ, вибрации, радиации и др.
Трудоспособные больные
1. С доброкачественным медленно прогрессирующим течением
заболевания, легким, иногда умеренным нарушением двигательных функций, в основном рационально трудоустроенные в профессиях интеллектуального, административно-хозяйственного типа.
2. Те же больные, способные трудиться в облегченных условиях, которые могут быть предоставлены по заключению КЭК
(дополнительные перерывы в работе, исключение ночных смен, командировок, неблагоприятных санитарно-гигиенических факторов и т. п.).
Мышечная дистрофия прогрессирующая и показание направления для освидетельствования на группу инвалидности во МСЭ:
1. В возрасте до 16 лет, когда ребенок при наличии медицинских показаний может быть признан инвалидом.
2. Умеренное или выраженное нарушение двигательных функций, ограничивающее способность к самостоятельному передви¬
жению, самообслуживанию или трудовой деятельности.
3. У работающих больных невозможность продолжать работу по специальности в связи с прогрессирующим течением заболевания, стойкой декомпенсацией, длительной временной нетрудоспособностью.
Критерии инвалидности
1. При определении в возрасте до 16 лет: а) частичное нарушение жизнедеятельности и социальная недостаточность как проявление наследственного заболевания (определяется на 5 лет);
б) выраженное прогрессирующее нарушение двигательной функции конечностей (в связи с ограничением способности к самостоятельному передвижению первой, второй степени) или олигофрения, быстро прогрессирующее течение заболевания в случае ПМД
Дюшенна (определяется на срок до достижения 16 лет).
2. При определении после 16 лет:
I группа инвалидности: значительно выраженные распространенные мышечные атрофии (развернутая стадия генерализации), множественные
контрактуры, деформации в связи с неспособностью к самостоятельному передвижению, полной зависимостью от других лиц или неспособностью к самообслуживанию;
II группа инвалидности: распространенные выраженные мышечные атрофии, выраженные нарушения двигательных функций, быстрое прогрессирование при раннем начале заболевания (в связи с ограничением способности к передвижению второй степени, самообслуживанию второй степени, к трудовой деятельности второй-третьей степени);
III группа инвалидности: умеренные локальные мышечные атрофии, легкие и умеренные двигательные нарушения, медленный темп прогрессирования, позднее начало заболевания, при снижении квалификации, необходимости значительного сокращения объема
работы, профобучения и рационального трудоустройства (по критериям ограничения способности к самостоятельному передвижению, обучению и трудовой деятельности первой степени).
Инвалидность определяется бессрочно (после наблюдения не менее 5 лет) больным с выраженным нарушением двигательных функций, прогрессирующим течением заболевания, при неэффективности мер реабилитации.
Причины инвалидности: 1) инвалидность с детства; 2) общее заболевание и инвалидность вследствие заболевания, полученного в период военной службы (при поздних формах миодистрофий).