что такое первичная структура белка кратко
Белки
теория по биологии 🌿 цитология
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма.
Строение белков
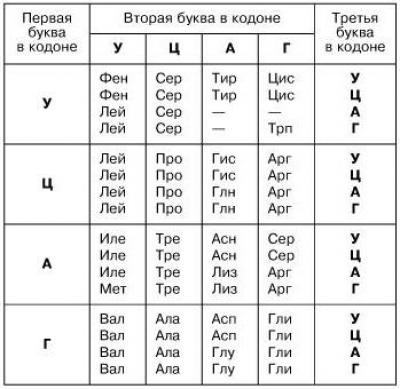
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот:
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
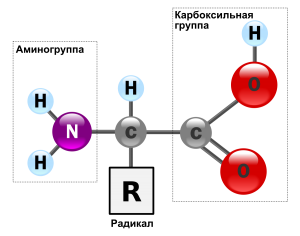
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом — аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей. Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей. Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки, в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
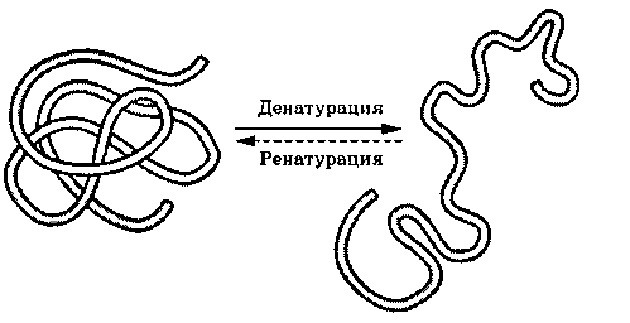
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится. Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует). Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
Денатурация и ренатурация
Функции белков
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
Ферменты – катализаторы (= ускорители химических реакций) белковой природы. С ферментами происходит тесное знакомство в разделе «пищеварение». Есть одно важное правило, которое нужно обязательно запомнить: все ферменты – белки, но не все белки – ферменты.
Белки-транспортеры осуществляют перенос веществ через мембрану клетки. Очень наглядным примером транспорта белками является белок-переносчик гемоглобин, благодаря которому мы дышим. В мышцах существует аналог этого белка – миоглобин (приставка мио- означает «сокращение», тем самым называя месторасположение белка).
Изучая иммунитет, ученики и студенты знакомятся с антителами – специфическими белками крови, которые вырабатываются иммунными клетками лимфоцитами для борьбы с чужеродными организмами или вредными соединениями. Так антитела сражаются за нас, когда мы хватаем где-то микробов, так же эти белки воюют, когда человеку переливают кровь неподходящей группы или пересаживают орган, который его организм отторгает. Переливание крови неподходящей группы может привести к летальному исходу, так как произойдет агглютинация – склеивание эритроцитов.
Кроме оборонительной и атакующей функции во благо защиты организма, есть и латающая. При порезе и кровопотере молекулы белка тромбина объединяются для того, чтобы закрыть поврежденный сосуд, а тем временем, тонкие нити белка фибрина переплетаются на поверхности раны, образуя тоненькую пленочку. Если порез был несерьезным, то кровотечение успешно остановлено.
Некоторые белки являются гормонами. Они отвечают за регуляцию физиологических процессов организма. Наиболее известным примером белкового гормона является инсулин.
Как и углеводы с жирами, белки тоже могут быть расщеплены для получения энергии. Однако, чаще всего, аминокислоты, полученные в результате распада белка, снова используются организмом для построения других белков. Это делает для экономии энергии и биологического материала, ведь в случае повторного использования, не нужно тратиться на синтез новых соединений. При расщеплении 1 г белка высвобождается 17,6 кДж энергии.
Задание EB11693 Установите соответствие между классами органических веществ и выполняемыми ими функциями в клетке.
| ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА | ВЕЩЕСТВА |
A) запасание энергии B) хранение генетической информации Д) входит в состав клеточных стенок и мембран Е) реализация генетической информации (синтез белка) 2) нуклеиновые кислоты (ДНК, РНК) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г | Д | Е |
Для начала вспомним какие вообще есть классы органических веществ в клетке.
Это белки, жиры, углеводы и нуклеиновые кислоты. Белки, жиры и углеводы являются источниками энергии, но у них есть и более локальные функции:
| Белки | Жиры | Углеводы | Нуклеиновые кислоты |
| Структурная | + | + | |
| Энергетическая | + | + | + |
| Защитная | + | + | |
| Ферментативная | + | ||
| Двигательная | + | ||
| Транспортная | + | ||
| Регуляторная | + | ||
| Рецепторная | + | ||
| Хранение и передача ген.информации | + | ||
| Биосинтез белка | + |
Выберем вначале то,что относится к нуклеиновым кислотам: биосинтез белка и хранение генетической информации.
PS: сигнальная и рецепторная функция — одно и то же.
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
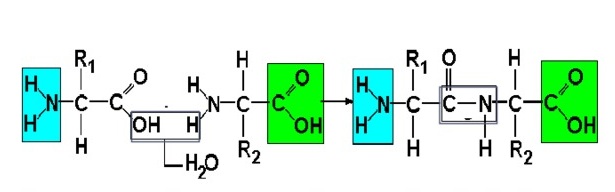
На данной схеме изображена реакция между двумя аминокислотами, что известно из вопроса. Между ними действуют пептидные связи.
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Состав и структура белков
Вопрос 1. Какие вещества называются белками или протеинами?
Белки (протеины) — это гетерополимеры, состоящие из 20 различных мономеров — природных альфа-аминокислот. Белки — нерегулярные полимеры.
Общее строение аминокислоты может быть представлено следующим образом:
R—С(NH2)—СООН. Все аминокислоты имеют аминогруппу (—МН2) и карбоксильную группу (—СООН) и различаются строением и свойствами радикалов. Аминокислоты в белке связаны пептидной
связью —N(Н)—С(=О), поэтому белки ещё называют пептидами.
Вопрос 2. Что такое первичная структура белка?
В молекуле белка аминокислоты связаны друг с другом пептидной связью между атомами углерода и азота. В строении молекулы белка различают первичную структуру — последовательность аминокислотных остатков.
Вопрос 3. Как образуются вторичная, третичная и четвертичная структуры белка?
Вторичная структура белка — как правило, это спиральная структура (альфа-спираль), которая удерживается множеством водородных связей, возникающих между находящимся близко друг от друга С=О и NН-группами. Другой тип вторичной структуры — это бета-слой, или складчатый слой; это две параллельные полипептидные цепи, связанные водородными связями, перпендикулярными цепям.
Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая компактную глобулу. Она поддерживается ионными, водородными и дисульфидными (S=S) связями, а также гидрофобными взаимодействиями.
Четвертичная структура белка образуется при взаимодействии нескольких глобул, которые объединяются в комплекс (например, молекула гемоглобина состоит из четырех таких субъединиц).
Вопрос 4. Что такое денатурация белка?
Утрата белковой молекулой своей структуры называется денатурацией; она может быть вызвана повышением температуры, обезвоживанием, облучением и т.д. Если при денатурации первичная структура не нарушается, то при восстановлении нормальных условий полностью воссоздается структура белка. Если же действие фактора нарастает, разрушается и первичная структура белка — полипептидная цепь. Это уже необратимый процесс — восстановить структуру белок не может. Например, при высокой температуре (выше 42oС) в организме человека многие белки денатурируют необратимо.
Вопрос 5. По какому признаку белки делятся на простые и сложные?
Простые белки (протеины) состоят исключительно из аминокислот (альбумины, глобулины, кератин, коллаген, гистон и другие). В состав сложных белков могут входить другие органические вещества: углеводы (тогда они называются гликопротеидами), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды), фосфорная кислота (фосфопротеиды), при сочетании белка с каким-либо окрашенным веществом образуются так называемые хромопротеиды. Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков (эритроцитов).
Белки как молекулы. Состав, структура и функции белков. Урок 10
Белки выполняют ведущую роль в жизни организмов, преобладая в них и количественно. В теле животных они составляют 40-50% сухой массы, в растениях – 20-35%. Это самая разнообразная группа молекул – как химически, так и функционально. Состав и структура белков определяет огромное разнообразие их функций в клетке: их так много, что невозможно перечислить и описать их все. Однако можно сгруппировать эти функции в следующие восемь категорий. Но этот список также будет неполным.
Функции белков
Белки – это полимеры
Белки, или протеины – это нерегулярные (не имеющие определённой закономерности в последовательности мономеров) полимеры, состоящие из мономеров, называемые аминокислотами. Протеины, в состав молекул которых входит от пятидесяти до нескольких тысяч остатков аминокислот, называются белками. Молекулы с меньшим количеством мономеров именуются пептидами.

Белок состоит из одной или нескольких длинных неразветвлённых цепей. Каждая цепь называется полипептидом и состоит из аминокислот, скреплённых пептидными связями. Термины «белок» и «полипептид» часто используются свободно, что может вызывать путаницу. Для белка, который включает только одну полипептидную цепь, оба термина являются синонимами.
В природе существуют около 500 аминокислот. В образовании белков обычно (но не всегда) участвуют только 20 из них – их называют белокобразующими. Порядок соединения мономеров в белке определяет его структуру и функции. Многие учёные считают, что аминокислоты были первыми органическими молекулами, появившимися на Земле. Возможно, океаны, которые существовали в начале истории нашей планеты, содержали большое их разнообразие.

Автотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофов источником аминокислот являются продукты питания. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми.
Другие же, так называемые незаменимые аминокислоты, не могут быть собраны в организме и поэтому должны постоянно поступать в него в составе белков пищи. Протеины, содержащие остатки всех незаменимых аминокислот, называются полноценными. Неполноценные белки – это те, в составе которых отсутствуют остатки тех или иных незаменимых аминокислот.
Незаменимыми аминокислотами для человека являются: триптофан, лизин, валин, изолейцин, треонин, фенилаланин, метионин и лейцин. Для детей незаменимыми являются также аргинин и гистидин.
Полипептидные цепи могут быть очень длинными и включать самые разные комбинации аминокислотных остатков. Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислот.

Deposition authors: Wang, S., Trumble, W.R., Liao, H., Wesson, C.R., Dunker, A.K., Kang, C., CC BY 3.0
Состав аминокислот
Аминокислоты, как следует из их названия, содержат основную аминогруппу (— NH2), а также кислотную карбоксильную группу (—COOH), обе они связаны с центральным атомом углерода. Углерод дополнительно скреплен с водородом и функциональной белковой группой, называемой радикалом (R). Эти компоненты полностью заполняют все связи центрального атома углерода.

Автор: User:X-romix
Уникальный характер каждой аминокислоты определяется природой группы радикала. Обратите внимание, что если группа радикала не содержит атома водорода (Н), как в глицине, то аминокислота хиральна и может существовать в форме двух энантиомеров: d или L. В белках живых систем содержатся обычно α (L)-аминокислоты, а β (d)-аминокислоты встречаются крайне редко.
Существуют также основные аминокислоты (более чем с одной аминогруппой) и кислые аминокислоты (более чем с одной карбоксильной группой). Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка.
В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы. Все 20 аминокислот сгруппированы в пять химических классов, основанных на группе их радикала.
Каждая аминокислота влияет на форму белка по-разному, в зависимости от химической природы боковых групп. Например, части белковой цепи с многочисленными неполярными аминокислотами сворачиваются внутрь своей цепи путём гидрофобного исключения.
Белки и пептидные связи

Наличие как основной, так и кислотной групп обусловливает амфотерность (проявление как кислотных, так и основных свойств) и высокую реакционную способность аминокислот.
При соединении двух аминокислот образуется дипептид. На одном конце молекулы дипептида находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
Новаторская работа Фредерика Сангера в начале 1950-х годов доказала, что каждый вид белка имеет определённую аминокислотную последовательность. Для отщепления аминокислот он использовал химические методы, после этого определял их. Сангер преуспел в расшифровке аминокислотной последовательности инсулина. Он продемонстрировал, что все молекулы инсулина имеют одинаковый состав аминокислот.
Уровни структурной организации белков
Форма белка определяет его функцию. Один из способов изучить что-то столь же маленькое как белок – посмотреть на него при помощи коротковолнового излучения, которое представлено рентгеновскими лучами. Рентгеновские лучи пропускают через белок для получения дифракции его узора. Эта картинка кропотливо анализируется и позволяет исследователю построить трёхмерное изображение молекулы с положением каждого её атома. Первым белком, проанализированным таким образом, был миоглобин; вскоре такому же анализу был подвергнут связанный с ним белок гемоглобин.
Когда было изучено достаточное количество протеинов, стал очевиден общий принцип их строения: в каждом исследованном белке все внутренние аминокислоты, такие как лейцин, валин и фенилаланин, неполярны. Тенденция воды к исключению неполярных молекул буквально толкает такие части цепи аминокислот внутрь протеина. Неполярные аминокислоты вынуждены тесно контактировать друг с другом, оставляя мало свободного места внутри молекулы. Полярные и заряженные аминокислоты концентрируются на поверхности белка, за исключением немногих, играющих ключевые функциональные роли.
Структура белков, как правило, описывается как иерархия четырёх уровней: первичного, вторичного, третичного и четвертичного. Мы рассмотрим эту точку зрения, а затем интегрируем её с более современным подходом, вытекающим из расширяющихся знаний о белковой структуре.

Первичная структура белков
Первичная структура белка – это его аминокислотная последовательность, т. е. это цепочка из множества аминокислотных остатков, соединённых пептидными связями. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие формы молекулы.
Группы радикалов, которыми отличаются аминокислоты, не играют роли в пептидной цепи белков и протеин может включать любую последовательность аминокислот. Так как любая из 20 аминокислот может появиться в любом месте, белок, содержащий 100 мономеров, может образовать любую из 20 100 различных аминокислотных последовательностей. Это важное свойство белков позволяет им быть разнообразными, но каждый из них функционирует только при определённой аминокислотной последовательности.
Вторичная структура белка
Боковые и пептидные группы полипептидных цепей могут образовывать водородные связи. Вторичная структура белка возникает в результате связывания атомов водорода NH-групп и кислорода CO-групп. Полипептидная цепь при этом спирально закручивается. Водородные связи слабые, но благодаря их большому числу они обеспечивают стабильность этой структуры. Спиральную конфигурацию имеют, например, молекулы кератина, миозина и коллагена.
Водородные связи пептидов могут образовываться с водой. Если связей с водой будет слишком много, белки не смогут приобрести глобулярной структуры. Лайнус Полинг предположил, что пептидные группы могут взаимодействовать друг с другом, если пептид свёрнут в спираль, которую он назвал α-спиралью. Этот вид регулярного взаимодействия в пептиде формирует его вторичную структуру.

Другая форма вторичной структуры формируется между зонами пептида, расположенными в один ряд, в результате чего получается плоская молекула, собранная в складки, называемая β-листом. Части белка могут быть либо параллельными, либо антипараллельными – в зависимости от того, являются ли смежные участки пептида ориентированными в одном или в противоположном направлении.
Эти два вида вторичной структуры создают зоны белка – цилиндрические (α-спирали) и плоские (β-листы). Конечная структура белка может включать области каждого типа вторичной структуры. Например ДНК-связывающие белки обычно имеют области α-спирали, которые могут лежать поперёк ДНК и взаимодействовать непосредственно с основаниями ДНК. Белки порины, образующие отверстия в мембранах, состоят из β-листов. В гемоглобине α и β-структуры (глобины) имеют в молекуле свои зоны.

Третичная структура белков
Окончательная структура химически связанных белков называется третичной. Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих в водной среде между разными группами атомов белковой молекулы вторичной структуры.
У некоторых белков важную роль в образовании третичной структуры играют S – S связи (дисульфидные) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Её имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
Третичная структура стабилизируется рядом сил, в том числе:
На стадии третичной структуры по форме молекул белки можно разделить на две группы:
Четвертичная структура белка
Когда два или более полипептида связываются с образованием функционального белка, отдельные его цепи называются субъединицами. Расположение этих субъединиц и есть четвертичная структура. Субъединицы в таких белках чаще всего неполярны, поэтому они не связаны химически и отвечают за отдельные виды деятельности. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил.
Четвертичная структура характерна для белка гемоглобина. Вспомните, что гемоглобин состоит из двух α-цепей и двух β-цепей, а ещё в его состав входит небелковый компонент – гем.
Субъединицы располагаются в их окончательной четвертичной структуре. Это конечная структура некоторых, но не всех белков. У протеинов, которые состоят только из одной полипептидной цепи, например у фермента лизоцима, конечной структурой является третичная.
Мотивы и домены – структурные элементы белков
Ручное определение последовательности аминокислот в белке – трудоёмкая работа. Эту ситуацию изменило открытие способности хранения информации о белке молекулой ДНК. Первоначально геном человека был расшифрован вручную. Появление технологий следующего поколения привело к заметному ускорению секвенирования.
Сегодня расшифрованы более 40 000 бактериальных геномов и почти 8 000 геномов эукариот, в том числе 80 последовательностей генов млекопитающих. Так как состав ДНК имеет непосредственное отношение к последовательности аминокислот в белках, у биологов теперь есть огромная база данных строения протеинов.
Новая информация заставила задуматься о логике генетического кода и основных закономерностях структуры белка. Исследователи до сих пор рассматривают иерархическую систему из четырёх уровней как важную, но в лексикон биологов вошли и новые термины: мотив укладки и белковый домен.
Мотив укладки белковых молекул
Когда биологи обнаружили третичную структуру белка (ещё более трудоёмкая работа, чем определение последовательности аминокислот в цепи), они заметили сходные элементы, расположенные в непохожих белках. Подобные структуры называются мотивами, а иногда «сверхсекундными структурами». Термин «мотив» заимствован из искусства и относится к тематическому повторяющемуся элементу в музыке или дизайне.
Один общий мотив β-α-β образует так называемую «складку Россмана» у большого количества протеинов. Вторым часто встречающимся мотивом является β-баррель, который представляет собой β-лист, сложенный по кругу, чтобы сформировать трубку. Третий тип мотива – спираль-поворот-спираль, состоит из двух α-спиралей, разделённых изгибом. Его используют белки для связывания с молекулой ДНК.
Логику структуры мотивов укладки исследователи до сих пор не могут понять. Вероятно, если аминокислоты являются буквами в языке белков, то мотивы представляют собой повторяющиеся слова или фразы. Мотивы укладки помогли определить неизвестные функции белков, а база данных белковых мотивов используется для поиска новых неизвестных протеинов.
Мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков.
Белковые домены
Домены – это функциональные единицы в виде глобулы внутри более крупной структуры белков. Их можно рассматривать как субструктуры внутри третичной структуры белка. В языке белков это «абзацы». Большинство белков состоит из нескольких доменов, которые выполняют различные части функций протеинов.
Во многих структурах эти домены могут быть физически разделены. Например, так устроены факторы транскрипции – белки, которые связываются с ДНК и инициируют построение РНК по комплементарной ей ДНК. Было выяснено, что если ДНК-связывающие области поменять местами с факторами транскрипции, специфичность фактора может быть изменена без изменения его способности стимулировать транскрипцию. Эксперименты по замене доменов были проведены со многими факторами транскрипции, и они указывают, что активационные и ДНК-связывающие домены действуют отдельно.
Эти образования также могут помогать протеинам складываться. По мере того, как полипептидная цепь приобретает свою структуру, домены принимают правильную форму. Это действие может быть продемонстрировано экспериментально. Искусственное продуцирование фрагмента полипептида, который образует домен в интактном белке, показывает, что фрагмент складывается, чтобы сформировать такую же структуру, как у прототипа.
Процесс складывания, белки-шапероны
Первоначально биохимики думали, что новоиспечённые белки сворачиваются спонтанно, пробуя различные конфигурации, как гидрофобные взаимодействия с водой толкают неполярные аминокислоты внутрь белков до тех пор, пока не будет достигнута их окончательная структура. Оказалось, что эта точка зрения слишком проста. Цепи протеинов могут быть сложены многими способами, поэтому пробы и ошибки заняли бы слишком много времени. По мере того как первичная цепь складывается, приобретая финальную структуру, неполярные «липкие» внутренние участки во время промежуточных стадий обнажаются. Если эти промежуточные формы поместить в пробирку со средой, идентичной той, что внутри клетки, они прилипают к другим, и нежелательные белки-партнёры образуют клейкую массу.
Как клетки избегают того, чтобы их белки слипались в массу? Ответ на вопрос появился во время изучения необычных мутаций, которые спасают бактериальные клетки от размножения внутри них вирусов. При этом белки вирусов, произведённые внутри клетки, не могут сложиться как следует. Дальнейшее исследование помогло выяснить, что клетки содержат белки-шапероны, помогающие другим белкам складываться правильно.

В настоящее время молекулярные биологи выявили массу белков, действующих как шапероны. Это большой класс полимеров, который можно разделить на подклассы. Представители шаперонов были найдены в каждом исследуемом организме. Некоторые из них, называемые тепловыми шоковыми белками, вырабатывается в ответ на повышение температуры тела. Высокие температуры служат фактором денатурации белков, шоковые белки-шопероны помогают белкам правильно сворачиваться и в такой ситуации.
Один из хорошо изученных классов этих белков, названных шаперонинами, был изучен у кишечной палочки (Escherichia coli). У мутантов при инактивации шаперонинов 30% бактериального белка не складывались должным образом. Шаперонины собираются в комплекс, напоминающий цилиндрический контейнер. Белки могут заходить в этот контейнер, и даже неправильно сложенные молекулы складываются там заново.
Исследователи склонны думать о белках как о фиксированных структурах, но это не относится к шаперонинам. Их гибкость поразительна. Видимо, это нужно им для выполнения своих функций. Клетки используют эти белки для складывания некоторых молекул протеинов и восстановления их неправильной структуры.
Денатурация инактивирует белки
Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определённом диапазоне кислотности среды.
Если условия, окружающие белок, изменяются, то он может частично потерять свою структуру или полностью развернуться. Этот процесс называется денатурацией. Белки могут быть денатурированы, когда рН, температура или ионная концентрация окружающего раствора изменена. Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структуры.
Денатурированные белки как правило биологически неактивны. Это особенно значимо в отношении ферментов: так как почти каждая химическая реакция происходит при их помощи, жизненно важно, чтобы они функционировали нормально.
До появления морозильников и холодильников единственным способом предохранения продуктов от размножения в них микроорганизмов было хранение их внутри раствора, содержащего высокую концентрацию соли или уксуса, которые денатурировали ферменты микроорганизмов и предотвращали их рост.
Большинство ферментов функционирует в очень узком диапазоне условий окружающей среды. У каждого энзима этот диапазон специфичен. Ферменты крови, которые работают при рН около 7,4, быстро денатурируют в кислой среде желудка. И наоборот, протеолитические ферменты желудка, работающие при рН=2 или менее, разбираются в основной среде крови. Аналогично у организмов, живущих вблизи океанических гидротермальных источников, есть ферменты, которые хорошо работают только в экстремальных температурах (до 100°С). Эти организмы не могут выжить в более прохладных водах, потому что их энзимы не функционируют должным образом при относительно низких температурах.
Если нормальные показатели окружающего раствора восстанавливаются, небольшой белок, не потерявший первичной структуры, может восстановиться. Этот процесс называется ренатурацией, он происходит благодаря взаимодействию неполярных аминокислот и воды. Первоначально этот процесс был установлен для энзима рибонуклеазы, его ренатурация привела к выводу, что первичная структура определяет третичную структуру белка. Более сложные белки редко складываются вновь из-за их сложной окончательной структуры. Их денатурация носит необратимый характер.
Важно отличать денатурацию от диссоциации. Субъединицы белков с четвертичной структурой могут быть диссоциированы (разделены) без потери своей индивидуальной третичной структуры. Например, молекула гемоглобина может диссоциировать на 4 молекулы (2 α-глобина и 2 β-глобина) без денатурации свёрнутых глобиновых белков. Они легко восстанавливают свою четвертичную структуру из четырёх субъединиц.