что такое патогенность микроорганизмов
Патогенные микроорганизмы и их основные характеристики
Инфекция – сложный биологический процесс, возникающий в результате проникновения патогенных микробов в организм и нарушения постоянства его внутренней среды. Возникновение инфекции зависит от нескольких факторов: степени патогенности (вирулентности) микроба, состояния макроорганизма и условий внешней среды.
Патогенность – это способность микроба определенного вида при соответствующих условиях вызывать характерное для него инфекционное заболевание. Следовательно, патогенность есть видовой признак.
Токсичность – способность патогенного микроба вырабатывать и выделять ядовитые вещества, вредно действующие на организм. Токсины бывают двух видов – экзотоксины и эндотоксины.
Экзотоксины – выделяются в окружающую среду при жизни микробов в организме или на искусственных питательных средах, а также в пищевых продуктах. Они очень ядовиты. Например, 0,005 мл жидкого столбнячного токсина или 0,0000001 мл ботулинического токсина убивает морскую свинку. Микробы, способные образовывать токсины, получили название токсигенных Под влиянием нагревания и света экзотоксины легко разрушаются, а под действием некоторых химических веществ теряют токсичность. Эндотоксины прочно связаны с телом микробной клетки и освобождаются только после ее гибели и разрушения. Они весьма устойчивы при действии высоких температур и не разрушаются даже после нескольких часов кипячения. Ядовитое действие многих бактерийных экзотоксинов связано с ферментами – лецитиназой (разрушает эритроциты), коллагеназой, гиалуронидазой (расщепляет гиалуроновую кислоту) и рядом других ферментов, которые производят в организме разрушение жизненно важных соединений. Условленно также, что некоторые патогенные бактерии (дифтерийные стафилококки и стрептококки) продуцируют фермент дезоксирибонуклеазу В процессе жизнедеятельности патогенные микробы выделяют и другие вещества, обусловливающие их вирулентность.
Пути внедрения патогенных микробов в организм
Место проникновения патогенных микробов в организм называется входными воротами инфекции. В естественных условиях заражение происходит через пищеварительный тракт (алиментарный путь), когда в пищу или в воду попадают патогенные микроорганизмы. Болезнетворное начало может проникать через поврежденные, а при некоторых инфекционных болезнях (бруцеллез) и неповрежденные слизистые оболочки рта, носа, глаз, мочеполовых путей и кожу. Судьба патогенных микробов, попавших в организм, может быть различной – в зависимости от состояния организма и вирулентности возбудителя. Некоторые микробы, попав с током крови в определенные органы, оседают (задерживаются) в их тканях, размножаются в них, выделяют токсины и вызывают заболевание. Например, возбудитель туберкулеза в легочной ткани. Любая инфекционная болезнь, независимо от клинических признаков и локализации микроба в организме, представляет собой заболевание всего организма. Если патогенные микробы проникли в кровеносные сосуды и начинают размножаться в крови, то они очень быстро проникают во все внутренние органы и ткани. Такую форму инфекции называют септицемией. Она характеризуется быстротой и злокачественностью течения и нередко заканчивается смертельным исходом. Когда микробы находятся в крови временно и не размножаются в ней, а посредством ее только переносятся в другие чувствительные ткани и органы, где затем уже размножаются, инфекцию принято называть бактериемией. Иногда микробы, проникнув в организм, остаются только в поврежденной ткани и, размножаясь выделяют токсины. Последние, проникая в кровь, вызывают общее тяжелое отравление (столбняк, злокачественный отек). Такой процесс называется токсемией. Пути выделения патогенных микробов из организма также различны: со слюной, мокротой, мочой, калом, молоком, выделениями из родовых путей.
Условия возникновения инфекций и значение состояния организма в этом процессе
Для возникновения инфекционного процесса требуется минимально заражающая доза микроба; однако чем больше проникло в организм микробов, тем скорее развивается болезнь. Чем вирулентнее микроб, тем быстрее наступают все клинические признаки болезни. Имеют значение и ворота инфекций. Например, после введения в легкие морской свинки 1 – 2 туберкулезных микробов может возникнуть заболевание, а чтобы вызвать заболевание путем подкожной инъекции микробов, надо ввести не меньше 800 живых туберкулезных палочек.
Одно из необходимых условий для возникновения заболевания – восприимчивость организма к данной инъекции очень восприимчивы, а к другим устойчивы. Например, крупный рогатый скот не заражается сапом лошадей, а чума свиней совершенно неопасно в смысле заражения для человека. Исключительно важное значение для возникновения инфекционного процесса имеет состояние организма. И.И.Мечников писал: «Болезнь, помимо внешних причин – микробов, обязана своим происхождением еще и внутренним условиям самого организма. Болезнь наступает тогда, когда эти внутренние причины оказываются бес сильными помешать развитию болезнетворных микробов; когда они, наоборот, успешно борются с микробами, то организм оказывается невосприимчивым. Проникновение патогенного микроба в чувствительный организм вовсе не обязательно вызывает соответствующее заболевание». Устойчивость организма против инфекции снижается при плохом питании. Влияет также простудный фактор, перегревание, радиация, отравление алкоголем и пр. Течение инфекционного заболевания Инфекционный процесс проявляется не сразу после внедрения патогенного микроба в организм, а спустя некоторый срок. Время от внедрения микробов в организм до появления первых клинических признаков заболевание называют скрытым, или инкубационным, периодом. Продолжительность его определяется вирулентностью и количеством внедрившихся микробов, воротами инфекции, состоянием организма и окружающими условиями. За период инкубации внедрившиеся микробы размножаются, производят качественные биологические изменения в организме, в результате чего появляются клинические признаки. По длительности течения инфекции бывают острые, кратковременно протекающие (ящур, холера, сибирская язва и многие др.). Большинство инфекций относится к острым. Инфекционные болезни людей и животных могут наблюдаться в виде единичных случаев, именуемых спорадическими. Когда инфекция быстро распространяется среди людей и охватывает населенные пункты значительной территории, такое распространение инфекции принято называть – эпидемия, соответственно инфекция среди животных – эпизоотия. Инфекционные болезни по природе отличаются от других заболеваний следующими свойствами: наличием живого возбудителя, заразительностью (передаются от больных здоровым), инкубационным периодом, иммунитетом (невосприимчивостью) переболевших. Последний наступает не всегда.Источники и пути распространения инфекции Основной источник и переносчик заразного начала – больной организм. От больного могут заражаться люди, животные. Зараженная почва может быть источником заражения. Болезни, при которых заражение происходит в результате попадания патогенных микробов из почвы, получили название почвенных инфекций (сибирская язва, газовая гангрена и др.)
Автор: Тайша Әсем Шарафиқызы
ГП на ПХВ Областная инфекционная больница
бактериологическая лаборатория –бак лаборантка
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
Патогенные микроорганизмы
Человека, животных и растения с миром микроорганизмов связывают сложные и весьма разнообразные взаимоотношения.
Исключительно важное значение имеют взаимоотношения с группой патогенных микробов. Патогенными называют микроорганизмы, способные вызывать заболевания.
Наибольший интерес представляют возбудители заболеваний человека и животных, поскольку они во многих случаях являются общими.
Среди патогенных видов имеются как паразиты, всегда развивающиеся за счет других животных организмов, так и сапрофиты. Последние обычно имеют переходные свойства и лишь при особо благоприятствующих условиях могут приобретать черты паразитов. Примером может служить сапрофитная кишечная палочка, при известных условиях способная вызвать воспалительные процессы в почках, мочевом пузыре и других органах. Некоторые сапрофиты относятся к патогенным, так как среди продуктов их жизнедеятельности имеются такие, которые воспринимаются человеком как токсины — яды.
Каждый вид болезнетворных микроорганизмов способен вызывать только определенное заболевание с характерными признаками и особенностями течения. Это свойство носит название специфичности. Специфичность инфекционного процесса — важный признак, проявляющийся в локализации возбудителей, избирательности поражения органов и тканей, особенностях течения болезни, механизме выделения микробов из организма хозяина, формировании у последнего иммунитета.
Под патогенностью понимается вообще способность определенного микроорганизма при соответствующих условиях вызывать специфическое болезненное состояние организма. Патогенность является видовым признаком болезнетворных микробов. Она приобретена, по-видимому, в результате длительного приспособления к развитию в организме хозяина.
Отдельные разновидности одного и того же патогенного вида микробов могут обладать различным по силе болезнетворным действием. Оно зависит от способности проникать в организм, размножаться в нем и вызывать патологические изменения. Степень болезнетворности патогенного микроба называют вирулентностью. Если микроб принадлежит к патогенному виду, то его называют патогенным и в том случае, когда он в силу каких-либо причин в данный момент не способен вызвать заболевание, утратил свою вирулентность или степень его вирулентности снизилась.
Таким образом, вирулентность является меняющимся признаком, служащим мерой патогенности. Вирулентность патогенного микроба можно повысить, создавая для него наиболее благоприятные условия или, например, последовательно заражая целый ряд восприимчивых животных. Наоборот, создавая возбудителю неблагоприятные условия, можно снизить его вирулентность или совсем лишить его вирулентности. Прибавление различных химических веществ, вредно действующих на микроорганизм, воздействие неблагоприятной температуры способствует понижению вирулентности микробов.
Искусственное снижение вирулентности болезнетворных микроорганизмов используется при получении вакцин для профилактики многих заразных заболеваний.
Для более определенной характеристики используют DCL (доза безусловно смертельная), вызывающую 100%-ную гибель животных.
В процессе жизнедеятельности патогенных микробов образуются вещества, обладающие очень высокой степенью ядовитости, — токсины. Непосредственной причиной болезненного состояния организма при развитии или нахождении в нем патогенных микробов является присутствие этих ядов — токсинов. Различают экзо- и эндотоксины.
Экзотоксины выделяются в окружающую среду при жизни микробов. Они обладают большой ядовитостью по отношению к животному организму. Например, 0,005 мл жидкого столбнячного токсина, или 0,0000001 мл ботулинического жидкого токсина, убивают морскую свинку.
Под влиянием нагревания и света экзотоксины легко разрушаются, а под действием некоторых химических веществ, например, формалина, теряют свою токсичность. Токсигенность не является обязательным свойством. Все токсигенные микроорганизмы могут развиваться, не продуцируя токсины. Экзотоксины имеют белковую природу, а некоторые из них обладают свойствами ферментов. Они. избирательно действуют на отдельные органы и ткани. Столбнячный токсин, например, поражает нервные клетки, регулирующие двигательные функции, дифтерийный — надпочечники и мышцу сердца. Действие экзотоксинов сказывается очень быстро — уже через несколько часов после попадания в организм. Однако есть и термостабильные экзотоксины — стафилококковый, ботулинический. Они выдерживают кипячение в течение нескольких минут, не разрушаясь, не разрушаются и под влиянием ферментов желудочно-кишечного тракта.
Эндотоксины — это токсины, прочно связанные с телом микробной клетки и освобождающиеся только после ее гибели и разрушения. Они менее токсичны, весьма устойчивы к действию высоких температур, не теряют своей токсичности даже при кипячении. Эти токсины характерны для возбудителей брюшного тифа, паратифов.
Медицинские интернет-конференции
Языки
ПАТОГЕННОСТЬ МИКРООРГАНИЗМОВ
Бойко М.В.1, Калинина Е.Н.1, Бойко А.А.2
Резюме
Резюме: Рассматриваются различные подходы при решении вопроса о патогенности возможного этиологического агента инфекционного заболевания.
Summary: Different approaches for solving the issue of the possible pathogenicity of the etiological agent of infectious disease.
Ключевые слова
Обзор
Обзор.
В инфектологии ключевым является понятие патогенности микроорганизмов. В Большой медицинской энциклопедии предлагается следующая формулировка этого понятия: «Патогенность микроорганизмов (греч. pathos страдание, болезнь + gennao создавать, производить; син.болезнетворность) — способность микроорганизмов приживаться в тканях организма хозяина, размножаться в них, вызывая патологические изменения» [1].
Однако данное понятие нуждается в дополнительных уточнениях с фенотипической, генетической, экологической и эпидемиологической точек зрения. Вместе с тем Фролов А.Ф. и Зарицкий А.М (1993) предложили одно из самых полных и удачных определений патогенности микроорганизмов: «Патогенность – это видовая генетически детерминированная потенциальная способность микроорганизма вызывать у определенного хозяина (человека, животного, растения) инфекционную болезнь при естественных для данного микроба условиях заражения» [2].
Понятие патогенность микроорганизмов является ключевым при определении этиологического агента, вызвавшего инфекционное заболевание. Во многих случаях нет необходимости доказывать патогенность возбудителя для человека, если выполняются условия, описанные в определении патогенности. Данный подход вполне оправдан в случае заведомо патогенного вида микроорганизмов (например, один из видов шигелл или при установлении диагноза грипп или ВИЧ-инфекция). В методических указаниях МУ 3.4.3008-12 «Порядок эпидемиологической и лабораторной диагностики особо-опасных, «новых» и «возвращающихся» инфекционных болезней» подчеркивается, что для «установления подтвержденного случая болезни в случае на известный ПБА» следует исходить из правила «При получении положительного результата бактериологического (вирусологического) анализа – выделение возбудителя из клинического материала и его идентификации и/или в случае выявления в крови больного специфических антител (Ig M в диагностическом титре и /или сероконверсия IgG) выдают ответ – «Подтвержденный случай заболевания» [3].
В описанных случаях для установления адекватного диагноза нет необходимости определять у выделенного микроорганизма наличие факторов патогенности. В случае, когда клиническая картина заболевания обусловлена определенным фактором, которым обладает микроорганизм, простого выделения возбудителя из клинического материала уже не достаточно. Для обоснования заключения об этиологической причине заболевания, требуется дополнительное выявление факторов патогенности у конкретного штамма.
Наиболее наглядно это утверждение иллюстрируется примером с возбудителем дифтерии. Так выделения Corynebacterium diphtheriae не достаточно для признания этого возбудителя причиной развития заболевания, поскольку, штаммы не способные продуцировать дифтерийный токсин (экзотоксин) не вызывают дифтерийную инфекцию. Именно токсин играет ведущую роль в патогенезе и клинической картине заболевания. Лица, от которых выделены нетоксигенные C.diphtheriae, кроме того, и не могут явиться источником инфекции. Для признания выделенного возбудителя патогенным требуется оценить способность изолированного штамма к продукции дифтерийного токсина [4, 5]. Только в этом случае можно говорить как об этиологии заболевания, так и о планировании противоэпидемических и профилактических мероприятий.
Однако в случае с V.cholerae этот путь уже не выглядит столь безупречным. Поскольку хорошо известно, что от совершенно здоровых людей выделяли токсигенные штаммы, а от лиц с ярко выраженной холерной клиникой изолировали гипотоксигенные штаммы, когда по всем канонам такой клиники быть не должно [6, 7].
Наиболее сложно выявить этиологический агент инфекционного заболевания в случае условно-патогенной микрофлоры, которая вызывает заболевание в случае инфицирования человека массивной дозой возбудителя, способной преодолеть защитные барьеры организма и/или в случае дефектов защитных барьеров. Последнее может быть связано с недоразвитостью естественных защитных механизмов у новорожденных, с их инволюцией у пожилых или в результате ослабления защитных барьеров, например, при антибактериальной терапии, хирургических вмешательствах и др. В данном случае признание выделенного микроорганизма этиологическим агентом заболевания основывается на оценке количества предполагаемого возбудителя в 1 г. Клинического материала. Например, в случае условно-патогенных энтеробактерий диагноз подтверждается выделением одного и тогоже микроорганизма из предполагаемого пищевого продукта в количестве не менее 10 5 в 1 г и из выделений больных в количестве 10 7 – 10 8 в 1 г испражнений [5].
Другим примером является то, что для постановки диагноза микоплазмоза недостаточно обнаружения в исследуемых пробах Ureaplasma spp. и M. Hominis. Необходима количественная оценка обсемененности материала микоплазми. Считается, что клинически значимый титр для данных бактерий, при котором требуется антибиотикотерапия, составляет 10 4 КОЕ/мл. Это обусловлено тем, что микоплазмы в количестве 10 3 КОЕ/мл и менее могут обнаруживаться у здоровых людей [8].
Этот количественный критерий определяется как состоянием макроорганизма, так и свойствами возбудителя, например, способностью к персистенции в организме хозяина.
Был описан подход по определению реализации патогенных свойств возбудителя на основе количественного изучения как патогенных, так и персистентных свойств микроорганизмов.
Таким образом, существуют разнообразные подходы к определению патогенности микроорганизмов и установлению этиологической значимости инфекционного агента, учитывающие особенности биологических свойств микрофлоры, способной вызвать заболевание человека.
Литература
3. Порядок эпидемиологической и лабораторной диагностики особо-опасных, «новых» и «возвращающихся» инфекционных болезней. Методические указанияя МУ 3.4.3008-12 [Электронный ресурс] / Москва, 2012. Url:http://files.stroinf.ru/data2/1/4293784/4293784576.htm (дата обращения 27.02.2017).
4. Лабораторная диагностика дифтерийной инфекции. МУК 4.2.3065-13. 4.2. методы контроля. биологические и микробиологические факторы. Методические указания. [Электронный ресурс] URL:http://docs.cntd.ru/document/1200106907 (дата обращения 27.02.2017).
5. Руководство по эпидемиологии инфекционных болезней. / Под ред. АМН СССР В.И.Покровского., М. «Медицина», 1993.,Т.2., 463 с.
6. Уралева В.С., Гулида М.М. Характеристика протеазной активности штаммов и мутантов Vibrio cholerae с различными биологическими свойствами // Журн. микробиологии, эпидемиологии и иммунобиологии.- 1988. N 9. С.7-10.
7. Урбанович Л.Я., Саппо С.Г., Колесник В.С. О факторах патогенности Vibrio cholerae // Журн. микробиологии, эпидемиологии и иммунобиологии.- 1988. N 9. С.105-109.
8. Заручейнова О.В. Методы лабораторной диагностики урогенитальных инфекций, ассоциированных с Mycoplasma hominis и Ureaplasma spp.// Инфекия и иммунитет.- 2014. Т.4., № 4. С.331-338.
9. Бойко А.В. Факторы патогенности некоторых вибрионов и аэромонад // Журн.микробио-логии, эпидемиологии и иммунобиологии. 2000. №6. С.104-108.
10. Бойко А.В. Микробиологические и экологические аспекты паразитизма вибриофлоры и аэромонад. Автореф. … доктора мед. наук. Челябинск, 1998. 40с.
Публикации в СМИ
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
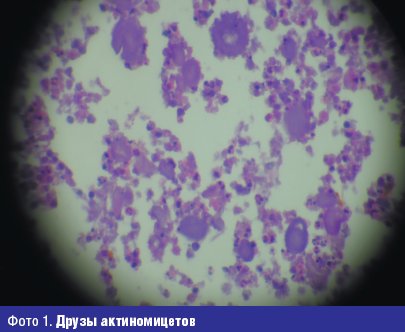
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
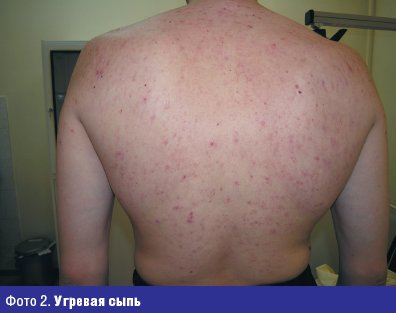
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
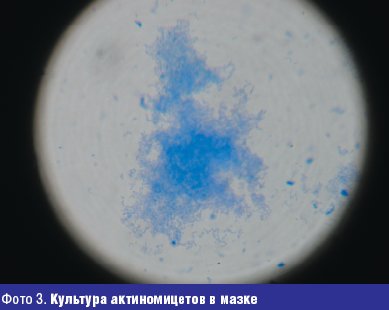
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.
Код вставки на сайт
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.