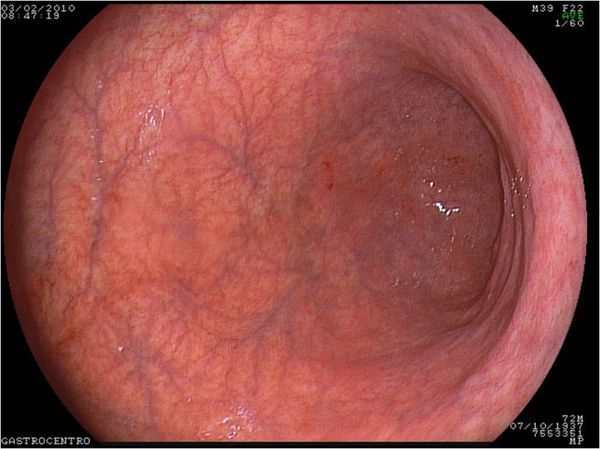
что такое папулезная гастропатия антрального отдела желудка
Гастропатия: причины, виды, симптомы
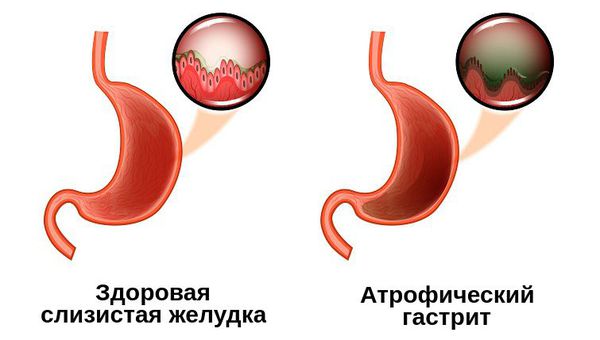
Пациенты часто путают гастрит и гастропатию, между тем – это совершенно разные понятия. Если при гастрите определяются явные признаки воспалённого состояния слизистой оболочки желудка, то гастропатия – группа различных заболеваний желудка, характеризующихся повреждениями его эпителия, сосудистой системы. Воспаления при гастропатии также возможны, но они носят совершенно незначительный характер.
Каждый второй житель планеты страдает нарушениями органов пищеварения, а в возрасте старше 50 лет их больше 60%. Из-за гормональных проблем гастропатия среди женщин диагностируется немного чаще чем среди мужчин. По распространенности же у детей гастропатия занимает второе место после респираторных инфекций.
Причинами возникновения гастропатии могут быть как внешние так и внутренние причины. Наиболее частые из них:
Среди факторов риска:
Отметим также, что любое игнорирование проблем со здоровьем чреваты серьёзными рисками для развития гастропатий.
На начальных стадиях гастропатии симптомы, как правило, отсутствуют. Первые признаки могут скрыть симптомы, характерные для других заболеваний и патологий – это обстоятельство способствует развитию заболевания. В дальнейшем же гастропатия проявит себя тяжестью в желудке, изжогой, отрыжкой, тошнотой, иногда рвотой, метеоризмом.
В грудном и детском возрасте гастропатия чаще всего проявляет себя в острой форме и характеризуется внезапным появлением и быстрым течением. «Спусковым крючком» для развития заболевания может стать переход на искусственное вскармливание, воздействие пищевых аллергенов, лекарственные препараты, испорченные продукты и молочные смеси. Заболевание проявляется общим недомоганием, беспокойством, болями в области желудка и пупка, отсутствием аппетита, тошнотой, рвотой, поносом. Острая стадия может перейти в хроническую, для которой характерны «голодные» боли, чувство распирания и переполнения желудка. Хроническая стадия может стать сопровождать ребёнка продолжительный отрезок его жизни.
В зависимости от того, насколько повреждены эпителиальные клетки внутренней поверхности желудка, от того как негативные факторы повлияли на ткани желудка, различают следующие виды заболевания, из которых чаще всего встречаются:
Помимо перечисленных существует еще более десятка вида гастропатий: атрофическая, антральная, катаральная, гиперпластическая, гипертрофическая, диффузная, рефлюкс-гастропатия, портальная, ассоциированная, экссудативная (болезнь Менетрие), зернистая, лимфоидная, рекативная, язвенная, уремическая, индуцированная.
Встречается и смешанная гастропатия, возникающая в результате развития сразу нескольких ее форм.
При диагностике гастропатий, медики используют несколько классификаций заболевания. Как уже упоминалось ранее, гастропатия может иметь острую и хроническую формы. По степени развития гастропатию классифицируют по степеням, где:
Стадии заболевания определяются характером протекания, длительностью болезни, эффективностью лечения, состоянием внутренней поверхности желудка:
Несвоевременно выявленая гастропатий, позднее начало ее леченияможет вызвать целую группу осложнений, выражающихся в нарушении пищеварения из-за недостаточной выработки желудочного сока и пепсина, застойных явлений в антральном отделе желудка. Последствиями может стать развитие В12-дефицитной анемии вследствие нарушения всасывания желудком полезных веществ, образование опухолей, вплоть до злокачественных, желудочное кровотечение.
Диагностика гастропатии проводится гастроэнтерологом.
При подозрении на гастропатию проводят гистологический анализ путём исследование взятого образца ткани (биоптата). Для этого с участков видимых повреждений и здоровых, соседствующих с ними, отдельно берётся материал. Такой анализ позволяет определить некоторые виды хронического гастрита или установить характер новообразований. Для определения состояния слизистой применяются два вида теста: на кислотность (внутрижелудочная РН-метрия) и на соотношение пепсиногена I и пепсиногена II в плазме – проферментов, вырабатываемых фундальными железами желудка. Также проводится анализ на наличие бактерии хеликобактер пилори, возможно и биохимическое генетическое исследование. Стандартной является процедура проведение общего и биохимического анализа крови, анализ мочи (для определение уровня уропепсина) и кала (копрограмма).
При диагностике гастроскопии также выполняют УЗИ органов брюшной полости.
Напоминаем: поставить точный диагноз, назначить лечение может только квалифицированный специалист!
Записаться на прием к гастроэнтерологу в Профессорскую клинику (ул Дружбы, 15а) можно по единому телефону в Перми 206-07-67, или воспользовавшись сервисом «Запись на прием» на нашем сайте. При необходимости, специалист назначит необходимые лабораторные и инструментальные диагностические процедуры, большинство из которых можно также выполнить в Профессорской клинике
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 22 года.
Определение болезни. Причины заболевания
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Краткое содержание статьи — в видео:
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Основными функциями желудка являются:
При значительном снижении синтеза и отсутствии соляной кислоты возникают следующие местные проявления :
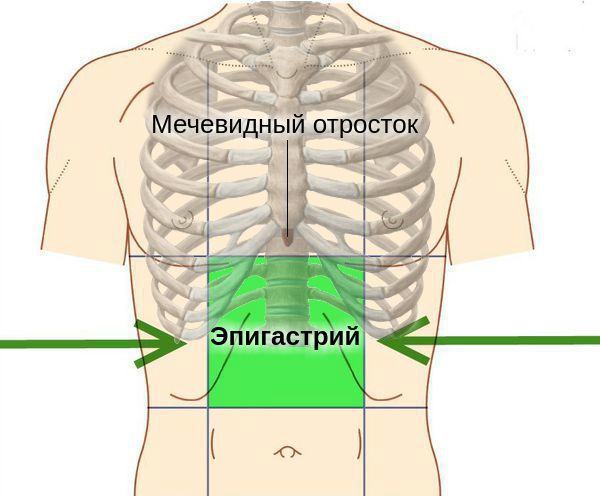
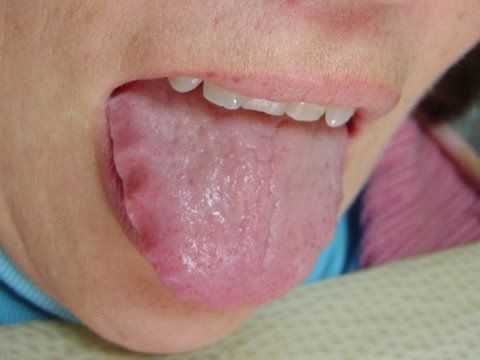
У людей с атрофическим гастритом отмечается «лакированный» язык, при обострениях язык увеличивается (видны отпечатки зубов), он обложен густым белым налётом. При пальпации (прощупывании) области желудка болезненность обычно отсутствует, но иногда возникает слабо выраженная разлитая болезненность в эпигастральной области.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Симптомы общих расстройств:
Клинические симптомы гастрита нельзя сопоставить с гистологическими изменениями. Атрофический гастрит развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. Считается, что на первых этапах умеренно выраженного атрофического гастрита клиника малосимптомная, стёртая и не имеет специфических проявлений. Но на дальнейших стадиях появляются симптомы, связанные с моторной и секреторной недостаточность желудка.
Патогенез атрофического гастрита
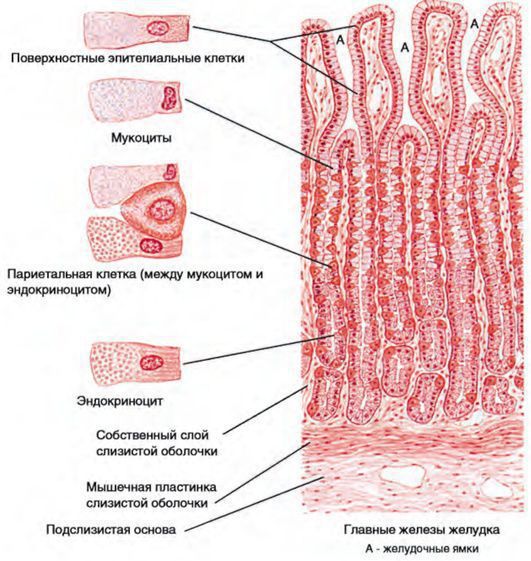
Эпителий слизистой оболочки желудка двухслойный:
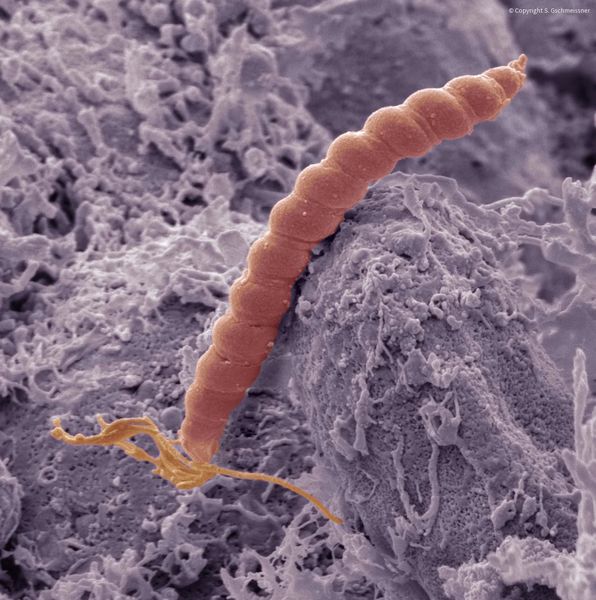
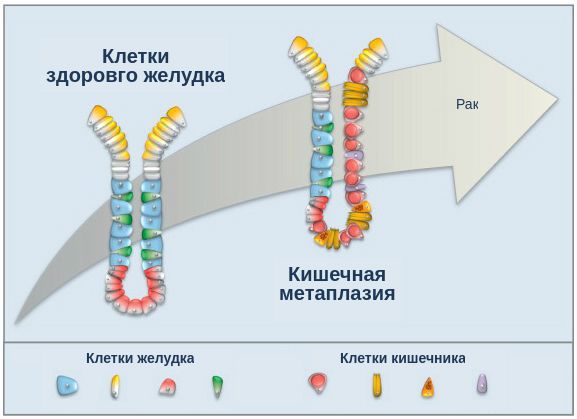
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
Повреждение слизистой оболочки желудка при аутоиммунном гастрите реализуется через другой механизм: нарушение иммунитета приводит к образованию антител, повреждению ткани желудка иммунными комплексами. Чаще всего антитела вырабатываются к фактору Касла, который отвечает за всасывание витамина В12, и G-клеткам. Из-за этого постепенно снижается кислотность желудка, изменяется структура слизистой, снижается выработка соляной кислоты. В желудке нарушается всасывание железа и витаминов, развивается В12-дефицитная анемия. При этом заболевании в 90 % случаев выявляются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и к Н + /К +- АТФазе, в 60 % случаев — антитела к фактору Касла.
Классификация и стадии развития атрофического гастрита
Сиднейская классификация гастритов
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
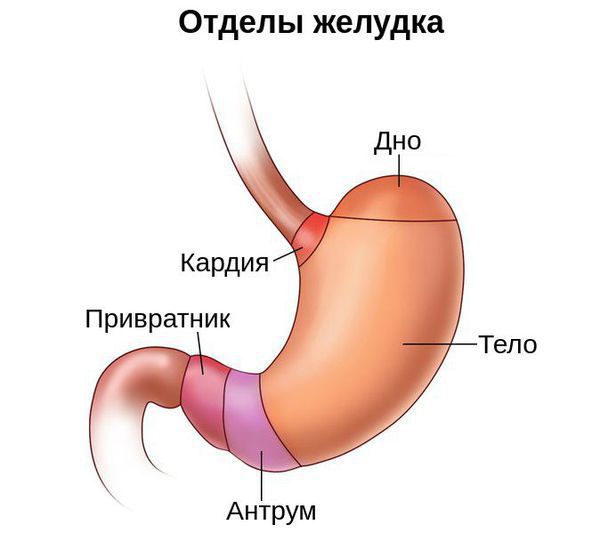
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
Морфологическая классификация гастрита широко применяется в практике, т. к. именно гистологические характеристики процесса помогают определить прогноз и тактику лечения пациента. Для этого используют визуально-аналоговую шкалу. Она позволяет оценить морфологическую картину слизистой желудка по:
Степень атрофии также оценивается по визуально-аналоговой шкале, изображённой на схеме ниже. По выраженности атрофии и её виду выделяют три категории изменений слизистой оболочки желудка:
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Развитие болезни проходит определённые стадии:
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
Хронический химикоиндуцированный или желчный рефлюкс-гастрит объединяет большую группу больных, включая:
Цель лечения — нормализовать моторику желудочно-кишечного тракта и связывание желчных кислот.
Тактика лечения зависит от основной причины гастрита:
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori. При выявлении инфекции после проведения терапии необходимо повторное лечение.
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
НЕСТЕРОИДНАЯ ГАСТРОПАТИЯ
В настоящее время в практике лечения пациентов, страдающих различными заболеваниями (костно-мышечной системы и соединительной ткани, так называемыми «ревматическими» заболеваниями, остеохондрозом, остеоартритом, анкилозирующим спондилитом, подагрой и др.
В настоящее время в практике лечения пациентов, страдающих различными заболеваниями (костно-мышечной системы и соединительной ткани, так называемыми «ревматическими» заболеваниями, остеохондрозом, остеоартритом, анкилозирующим спондилитом, подагрой и др.), широко применяются нестероидные противовоспалительные препараты (НПВП).
Один из этих препаратов — ацетилсалициловая кислота (АСК), использующаяся для снижения температуры и улучшения общего состояния больных при многих заболеваниях (с профилактическими целями препарат часто назначают при ишемической болезни сердца). Известны другие положительные качества АСК, обусловливающие ее применение в терапии тех или иных заболеваний. В частности, известно, что даже нерегулярный прием АСК [9] снижает на 90% частоту развития рака пищевода, ассоциируемого с воздействием различных химических веществ. Систематический прием АСК в дозировках, обычно рекомендуемых для профилактики сердечно-сосудистых заболеваний, уменьшает риск развития рака толстой и прямой кишки [5]. Однако этот положительный эффект АСК проявляется лишь спустя 10 и более лет после начала приема этого препарата. Известны наблюдения некоторых исследователей [6], свидетельствующие о том, что применение НПВП в течение более 5 лет уменьшает риск развития колоректальных аденом [7], что подтверждает гипотезу об определенном протективном действии НПВП.
Среди существенных причин широкого применения НПВП в лечении больных можно назвать большую распространенность многих заболеваний (неврита, невралгий различного генеза, болезни Бехтерева, артроза, ревматоидного артрита, остеохондроза и др.) и высокую эффективность применения НПВП в терапии этих недугов (в качестве симптоматических средств, без которых нередко невозможно успешное лечение больных). Многие люди часто принимают НПВП [15] без какого-либо медицинского контроля. Некоторые исследователи [4] полагают, что без рецепта НПВП применяются в 7 раз чаще, чем по назначению врача; особой популярностью пользуется у больных АСК. Это в первую очередь относится к людям пожилого и старческого возраста (более 40–45%).
НПВП-гастропатия (нестероидная гастропатия). Специфический синдром, обычно ассоциируемый с лечением больных НПВП, — НПВП-гастропатия, преимущественно проявляющаяся поражением желудка (чаще его антрального отдела), несколько реже — двенадцатиперстной кишки с появлением эритемы, эрозий и/или язв [1], в последние годы все больше привлекает внимание исследователей.
Основные факторы риска появления НПВП-гастропатии — пожилой возраст, язвенная болезнь в анамнезе, мужской пол. Определенное значение в возникновении НПВП-гастропатии отводится и таким факторам, как продолжительность приема больными НПВП, одновременное лечение больных несколькими НПВП, увеличение их дозировок. Прослеживается наличие значительной «зависимости» [5] между приемом НПВП и последующей экстренной госпитализацией больных по поводу заболеваний верхнего отдела желудочно-кишечного тракта. При этом чаще всего в стационары поступают женщины; и их доля по сравнению с мужчинами с возрастом повышается.
Патогенетические аспекты НПВП-гастропатии. В настоящее время известно, что НПВП ингибируют фермент циклооксигеназу (ЦОГ), следствием этого является блокада синтеза простагландинов слизистой оболочки желудочно-кишечного тракта. Этот фермент имеет два изомера — ЦОГ-1 и ЦОГ-2. Считается, что ЦОГ-1 — фермент, регулирующий синтез простагландинов, участвующих в цитопротекции, регуляции сосудистого тонуса и других процессах; этот фермент способствует также образованию простациклина, который и обеспечивает цитопротективные свойства слизистой оболочки желудка. ЦОГ-2 — фермент, более связанный с синтезом простагландинов в зоне воспаления, — влияет на активацию воспалительного процесса. Противовоспалительное действие НПВП зависит от ингибирования ЦОГ-2, появление побочных эффектов — от ингибирования ЦОГ-1.
В настоящее время известно более 35 наименований различных НПВП. Некоторые различия в химической структуре НПВП не влияют на основной механизм их действия. Для всех НПВП характерна способность ингибировать синтез простагландинов, основными физиологическими эффектами которых являются: стимуляция секреции защитных гидрокарбонатов и слизи, активация пролиферации клеток в процессах нормальной регенерации и усиление местного кровотока в слизистой оболочке. НПВП способны оказывать патологическое действие (различное по глубине поражения) на состояние слизистой оболочки желудка и двенадцатиперстной кишки. В частности, по данным некоторых исследователей [11], среди НПВП, согласно результатам систематического обзора эпидемиологических исследований: ибупрофен (бруфен) ассоциируется с более низким риском по сравнению с диклофенаком (ортофеном, вольтареном); азапропазон, толметин, кетопрофен и пироксикам имеют более высокий риск появления желудочно-кишечных осложнений, в то время как индометацин (метиндол), напроксен занимают промежуточное положение. Однако повышение дозировки одного из этих препаратов (в частности, ибупрофена) приводит к более частым осложнениям.
Влияние различных НПВП на образование язв и эрозий в желудке и двенадцатиперстной кишке зависит от степени их ингибирующего действия на тот или другой изомер. В появлении язв и эрозий играют роль и другие факторы, способствующие их образованию (нарушение равновесия между факторами агрессии и защиты, включая уменьшение выработки слизи и бикарбонатов, снижение интенсивности кровотока и т. д.). К основным факторам агрессии чаще всего относят воздействие соляной кислоты, пепсина, фосфолипидов, ряда лекарственных веществ (в том числе и НПВП), алкоголя, табака и др.; к факторам защиты — выделение слизистой оболочкой желудка слизи и бикарбонатов, кровоснабжение и др.
Эрозии желудка и двенадцатиперстной кишки, связанные с приемом НПВП, часто не проявляются какой-либо клинической симптоматикой либо у больных отмечаются лишь незначительно выраженные, временами возникающие боли в эпигастральной области и/или диспепсические расстройства, которым пациенты нередко не придают значения, и поэтому не обращаются за медицинской помощью.
В ряде случаев больные настолько привыкают к своим незначительным по интенсивности болям в животе и дискомфорту, что при обращении в поликлинику по поводу своего основного заболевания даже не сообщают о них лечащему врачу (основное заболевание беспокоит больных значительно больше). Очевидно, поэтому у больных, обращающихся в амбулаторно-поликлинические учреждения для обследования и лечения по поводу основного заболевания, часто не удается выявить клинические симптомы, считающиеся характерными для заболеваний верхних отделов желудочно-кишечного тракта. По-видимому, это объясняется также тем, что НПВП уменьшают интенсивность симптомов желудочно-кишечных поражений благодаря их местному и общему обезболивающему действию.
Между наличием и выраженностью очаговых патологических поражений желудка и двенадцатиперстной кишки (эрозии и язвы), ассоциированных с лечением НПВП, и симптомами этих заболеваний не установлено точной корреляции. У 45–55% больных с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки отсутствуют какие-либо симптомы, свидетельствующие о поражении этих органов. У значительной части пациентов, принимающих НПВП, возможны боли в эпигастральной и/или пилородуоденальной области и/или диспепсические расстройства при отсутствии каких-либо очаговых патологических изменений в желудке и двенадцатиперстной кишке.
Обследование пациентов, принимающих НПВП и поступающих в стационар для дальнейшего лечения, показало, что у больных, предъявляющих жалобы на боли в животе и/или диспепсические расстройства, боли в эпигастральной области отмечаются в 75% случаев; наиболее распространенные диспепсические симптомы — изжога (44,2%), тошнота (37,2%) и отрыжка (35,7%), реже — рвота (5,7%) [2].
Наиболее часто встречающиеся и опасные проявления НПВП-гастропатии — образование язв желудка и двенадцатиперстной кишки (последние развиваются в 2 раза реже); их появление, наряду с прогрессированием болезни, может привести к кровотечениям, пенетрации и перфорации язв, стенозированию двенадцатиперстной кишки и желудка, которые возможны в 1–2% случаев [14]. Сравнительно часто первыми клиническими симптомами наличия у больного эрозивно-язвенных поражений желудка и двенадцатиперстной кишки являются появление незначительных или обильных кровотечений, слабость, потливость, бледность кожных покровов, рвота и мелена. В значительной степени, по-видимому, это обусловлено обезболивающим эффектом самих НПВП. Значительно реже у пациентов с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки, ассоциированными с НПВП, отмечаются интенсивные боли в эпигастральной области и диспепсические расстройства. Чаще всего они развиваются у больных с глубокими язвами.
По некоторым наблюдениям [3], желудочно-кишечные кровотечения развиваются более чем у половины больных, принимающих НПВП. По мнению других исследователей [16], применение НПВП в лечении больных напрямую связано с частотой возникновения кровотечений из верхних отделов желудочно-кишечного тракта.
Есть также сведения [17], что длительная терапия АСК связана с существенным увеличением частоты желудочно-кишечных кровотечений. Очевидных доказательств того, что сокращение дозы АСК или применение модифицированных лекарственных форм может уменьшить частоту появления желудочно-кишечных кровотечений, не существует. Неоднократно предпринимались попытки создать НПВП, которые не оказывали бы столь выраженного повреждающего воздействия на слизистую оболочку желудочно-кишечного тракта. Так, большие надежды были связаны с созданием, в частности, АСК с энтеросолюбильным покрытием и в буферной форме. Однако оказалось [12], что прием даже малых доз такой формы АСК повышает риск возникновения массивных желудочно-кишечных кровотечений. Предположение, что эти формы менее опасны по сравнению с обычной АСК, является, по-видимому, ошибочным.
Прием НПВП и пожилой возраст, по наблюдениям других исследователей [18], являются факторами риска появления кровотечений из язв желудка, в отличие от «изолированной» инфекции Helicobacter pylori (НР). При использовании НПВП в пожилом возрасте существует повышенный риск возникновения кровотечений из язв желудка, ассоциированных с инфекцией НР, что свидетельствует о возможной взаимосвязи этих факторов. Однако в пожилом и старческом возрасте вероятность появления кровотечений и перфораций возрастает. Развитию кровотечения у таких больных могут способствовать сопутствующие заболевания сердечно-сосудистой системы и печени, одновременно проводящееся лечение кортикостероидными препаратами и антикоагулянтами.
По нашим наблюдениям, появление кровотечений у больных, в лечении которых используются НПВП, возможно в различные сроки от начала систематического приема нестероидных противовоспалительных препаратов по поводу основного заболевания, нередко даже и при небольших дозах этих препаратов независимо от состояния кислотообразующей функции желудка и обсемененности НP слизистой оболочки желудка. Наибольший риск возникновения кровотечений отмечается в первый месяц лечения больных НПВП, несколько меньший — позднее (в течение первого года). Затем организм больных как-то «приспосабливается» и вероятность появления кровотечений уменьшается (почему так происходит, до сих пор остается неясно). По-видимому, слизистая оболочка желудка и двенадцатиперстной кишки у части больных может приобретать некоторую устойчивость к повреждающему действию НПВП.
О большей устойчивости слизистой оболочки желудка и двенадцатиперстной кишки к повреждающему действию НПВП, по мере увеличения сроков их приема больными, в определенной степени свидетельствуют следующие факты [2].
Терапия язв желудка и двенадцатиперстной кишки, ассоциированных с НПВП
Наблюдения показывают, что в последние годы для проведения лечения больных с НПВП-гастропатией в гастроэнтерологические стационары поступают в основном больные с язвами желудка и реже — с язвами двенадцатиперстной кишки, ассоциируемыми с НПВП.
Перед назначением НПВП (особенно первичным) по поводу основного заболевания необходимо выяснить наличие или отсутствие в анамнезе язвенной болезни. Это заболевание является относительным противопоказанием к назначению НПВП. В сомнительных случаях показано эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки (ЭГДС) (Pentax, EXERA, Olimpus). Выявление язвы или рубцово-язвенной деформации желудка и двенадцатиперстной кишки (с учетом данных анамнеза заболевания) по результатам проведения ЭГДС и/или рентгенологического исследования (до лечения больных НПВП) свидетельствует о наличии у пациента язвенной болезни.
НПВП целесообразно назначать после приема пищи, по возможности исключая их совместное применение с другими препаратами, оказывающими патологическое воздействие на слизистую оболочку пищеварительного тракта. Показания к эндоскопическому исследованию верхних отделов желудочно-кишечного тракта, включая пищевод:
При выявлении очаговых поражений пищевода, желудка и двенадцатиперстной кишки, включая и рефлюкс-эзофагит, до начала лечения проводится контрольное эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки (Pentax, EXERA, Olimpus). Контрольные эндоскопические исследования у больных, которых начали систематически лечить НПВП, целесообразно проводить в следующие сроки: через месяц от начала приема НПВП, в последующем 1 раз в год. Выявление при эндоскопическом исследовании эрозий и язв желудка и двенадцатиперстной кишки на фоне лечения больных НПВП требует уточнения тактики лечения больных (с учетом наличия и основного заболевания).
Опыт показывает, что в лечении больных с НПВП-гастропатией положительные результаты при лечении основного заболевания, а также частота появления возможных побочных эффектов и осложнений в значительной степени зависят от дозировки этих препаратов, сроков их применения и индивидуальной переносимости больными. Использование в лечении больных НПВП в меньших дозировках уменьшает вероятность появления побочных эффектов и осложнений.
Обычно при лечении больных с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки, ассоциированными с НПВП, когда больные вынуждены продолжать принимать НПВП, исходят из двух принципов:
Пациентам с язвой желудка или двенадцатиперстной кишки или имевшим в анамнезе язвенную болезнь, а также больным пожилого и старческого возраста НПВП показаны лишь в тех случаях, когда другие варианты терапии оказываются неэффективны. При возникновении у больных, получающих НПВП, эрозий и язв желудка и двенадцатиперстной кишки, если это возможно, целесообразно отменить эти препараты и назначить «противоязвенное» лечение. В тех случаях, когда нельзя отменить НПВП, целесообразно, если позволяет состояние больных, уменьшить дозировку этих средств или перевести больных на менее «ульцерогенные» препараты. В последнее время с этой целью нередко предлагается использовать парацетамол (далерон, калпол, санидол, эффералган).
Для устранения клинических проявлений, считающихся характерными для поражений желудка и двенадцатиперстной кишки, и заживления эрозий, а также профилактики их появления в настоящее время предлагаются различные препараты: наиболее часто — мизопростол (сайтотек), антагонисты Н2-гистаминовых рецепторов (ранитидин, фамотидин) и ингибиторы протонного насоса (омепразол, рабепразол, эзомепразол), антацидные препараты (алмагель нео, фосфалюгель, тальцид, маалокс, ренни, магалфил и др.).
О целесообразности применения мизопростола, антагонистов Н2-гистаминовых рецепторов и ингибиторов протонного насоса в терапии эрозивно-язвенных поражений желудка и двенадцатиперстной кишки свидетельствуют следующие факты. Мизопростол подавляет выделение кислоты и пепсина желудком, увеличивает количество слизи и плотность слизистого геля, повышает выделение бикарбонатов и улучшает кровоснабжение в слизистой оболочке желудка, способствует восстановлению клеток слизистой оболочки желудка и снижает обратную диффузию ионов водорода, что является одним из цитозащитных свойств мизопростола. Ингибиторы протонного насоса и антагонисты Н2-гистаминовых рецепторов ингибируют кислотообразование в желудке и обладают некоторым цитопротективным действием.
Не рекомендуется прием мизопростола, как и других медикаментозных препаратов, одновременно с антацидными препаратами (последние значительно снижают концентрацию мизопростола в плазме).
Обычно эти препараты назначаются в виде монотерапии и в обычных терапевтических дозировках: мизопростол по 200 мкг 4 раза в день, ранитидин (ацидекс, ацилок, гистак, зантак, зоран, ранитин) по 150 мг 2 раза в день или фамотидин (гастросидин, квамател, ульфамид, ульцеран, фамонит, фамоцид) по 20 мг 2 раза в день (или соответственно 1 раз в сутки по 300 мг или 40 мг), омепразол (лосек, омизак и др.), рабепразол (париет) или эзомепразол (нексиум) также соответственно по 20 мг 2 раза в день. В период заживления язв желудка и двенадцатиперстной кишки эффективность ингибиторов протонного насоса в этих дозировках несколько выше.
Преимущество антагонистов Н2-гистаминовых рецепторов и ингибиторов протонного насоса перед мизопростолом (сайтотеком), по нашим наблюдениям, заключается в более быстром устранении болей в эпигастральной и/или в пилородуоденальной области и изжоги, а также в лучшей переносимости этих препаратов больными. При приеме мизопростола часть больных отмечают чувство кратковременного жжения за грудиной (по ходу пищевода) и в подложечной области.
Как показали наши наблюдения, в лечении больных с язвами желудка и двенадцатиперстной кишки, ассоциированными с НПВП, положительный эффект оказывают и дженерики омепразола (лосек, омизак, гастрозол, омез, омитокс, ультоп).
Приводимые в литературе сведения об эффективности того или иного препарата в лечении больных с эрозиями и язвами желудка и двенадцатиперстной кишки, ассоциированными с НПВП, обычно основаны на результатах терапии больных указанными выше «стандартными» дозировками этих препаратов. Увеличение дозировки фамотидина до 40 мг 2 раза в сутки, как показали наши наблюдения, позволяет повысить эффективность лечения таких больных. У большей части пациентов такая дозировка фамотидина не только способствует заживлению, но и помогает предотвратить возникновение язв и эрозий, ассоциированных с НПВП.
Наличие интенсивных болей в эпигастральной области, диспепсических расстройств и/или больших по размерам язв желудка и двенадцатиперстной кишки, по нашим наблюдениям, служит показанием к комплексному медикаментозному лечению больных — сочетанному применению мизопростола с антагонистами Н2-гистаминовых рецепторов, антацидами или с ингибиторами протонного насоса (в терапевтических дозировках). Наши наблюдения [1] позволили установить, что мизопростол (сайтотек) по 400 мкг 4 раза в сутки в сочетании с ранитидином по 300 мг или фамотидином (квамателом) по 40 мг 1 раз в сутки более эффективен в терапии язв желудка и двенадцатиперстной кишки, ассоциированных с НПВП, по сравнению с мизопростолом в той же дозировке в сочетании с ранитидином, назначаемым по 150 мг 1 раз в сутки. При отсутствии выраженных болей в эпигастральной области (и при небольших по размерам язвах желудка и двенадцатиперстной кишки) можно ограничиться применением антагонистов Н2-гистаминовых рецепторов, ингибиторов протонного насоса, мизопростола в терапевтических дозировках, антацидных препаратов.
Антацидные препараты (алмагель нео, фосфалюгель, тальцид, маалокс, ренни, магалфил и др.) достаточно давно применяются в лечении пациентов, страдающих различными гастроэнтерологическими заболеваниями. Некоторые из антацидных препаратов (в частности, содержащих гидроокись алюминия, например алмагель нео) обладают и цитопротективным действием, которое заключается в усилении секреции слизи и синтеза простагландинов.
Несомненное достоинство антацидных препаратов — быстрое устранение (снижение интенсивности) изжоги (жжения) за грудиной и/или в эпигастральной области и других желудочно-кишечных симптомов, вызванных собственно заболеванием, по поводу которого проводится лечение, приемом лекарственных препаратов и интоксикацией. Чаще всего антацидные препараты назначаются в следующих случаях: при так называемой терапии «по требованию» для быстрого устранения (снижения интенсивности) симптомов диспепсии, прежде всего изжоги и боли (в любое время суток); при курсовом лечении за 30 — 40 мин до или через 30 — 60 мин после приема пищи (при необходимости и перед сном) в виде монотерапии или в комплексном лечении, в сочетании прежде всего с прокинетиками и/или с Н2-блокаторами гистаминовых рецепторов (частота и продолжительность приема антацидных препаратов определяются общим состоянием больного).
Известно, что антацидные препараты обладают адсорбирующей способностью, благодаря этому возможно снижение активности и биодоступности некоторых медикаментозных препаратов, принимаемых пациентом (например, Н2-блокаторов гистаминовых рецепторов, нестероидных противовоспалительных препаратов, антибиотиков и т. д.). Поэтому при назначении антацидных препаратов в сочетании с другими средствами целесообразно рекомендовать больным соблюдать временной интервал между приемом антацидных препаратов и приемом других средств (около 2–2,5 ч), т. е. указывать время приема больными конкретных препаратов в течение суток.
НПВП и Helicobacter pylori. Периодически обсуждается вопрос о целесообразности/нецелесообразности проведения эрадикационной терапии НР. Существуют противоречивые мнения о целесообразности проведения антихеликобактерной терапии при лечении больных с язвами желудка и двенадцатиперстной кишки, ассоциированными с НПВП. Возможно, наличие нейтрофилов в слизистой оболочке желудка [19] повышает частоту возникновения язв у больных, длительно принимающих НПВП (наличие корреляции между нейтрофилами и НР). С учетом этого факта можно полагать, что у части больных эрадикация НР может предупреждать возникновение язв, вызванных приемом НПВП.
Появление на фоне лечения НПВП симптомов диспепсии, считающихся характерными для поражений верхних отделов желудочно-кишечного тракта, иногда связывают с условиями и образом жизни, с наличием у пациента НР, полагая, что у таких больных прием нестероидных противовоспалительных препаратов сопряжен с высоким риском появления различных осложнений. Согласно другим сведениям, эрадикация НР не дает преимуществ в лечении больных, длительно принимающих НПВП, даже наоборот — удлиняет период заживления язв. В частности, по некоторым данным [10], эрадикация НР больным, имеющим (или имевшим прежде) пептические язвы и/или диспепсические расстройства и продолжающим принимать в течение длительного времени НПВП, затрудняет заживление язв желудка и не влияет на частоту возникновения пептических язв или диспепсических расстройств, возникающих к исходу 6 мес. По-видимому, это обусловлено тем, что НР и НПВП являются независимыми факторами риска возникновения язв желудка и двенадцатиперстной кишки.
Возможно, такое расхождение во мнениях связано с тем, что исследователи не делают различий между больными, принимающими НПВП. По нашему мнению, язвы у больных, принимающих НПВП, можно условно разделить на две категории:
Само по себе возникновение эрозий и язв лишь стереотипный ответ организма на различные воздействия; по существу, способность организма человека в процессе эволюции вырабатывать минимум ответов на разные воздействия помогла ему выжить (впрочем, как и всему животному и растительному миру).
Наши наблюдения за больными, принимавшими (принимающими) НПВП, у которых выявлены язвы желудка или двенадцатиперстной кишки, показали следующее. Проведение 7–10-дневной эрадикационной терапии (с последующим лечением базисным препаратом в течение 2,5–3 нед) в терапии пациентов, у которых выявлены язвы желудка или двенадцатиперстной кишки, оправдано в тех случаях, когда у больных в анамнезе имеется язвенная болезнь, а последнее обследование с использованием не менее 2–3 методов показало, кроме того, обсемененность НР слизистой оболочки желудка.
В настоящее время нередко выдвигается гипотеза, что эрадикация НР уменьшает частоту появления язв желудка и двенадцатиперстной кишки, ассоциированных с НПВП, если она была проведена до начала лечения больных НПВП.
Профилактика поражений желудка и двенадцатиперстной кишки, ассоциированных с НПВП
Вопросы надежной профилактики поражений желудка и двенадцатиперстной кишки, возникающих при лечении больных НПВП, остаются предметом дискуссий. Общепринятой точки зрения на то, какие лекарственные препараты, назначаемые одновременно с НПВП (антагонисты Н2-гистаминовых рецепторов, ингибиторы протонного насоса или мизопростол) с учетом их эффективности и экономичности, длительности курсов лечения, дозировок НПВП, конкретных заболеваний, целесообразно применять у больных, к сожалению, нет. Поэтому предпринимаются попытки разработать наиболее оптимальные варианты профилактического лечения больных. Установлено [13], что мизопростол у большей части больных более эффективно предотвращает развитие язв желудка, вызванных приемом НПВП; мизопростол и антагонисты Н2-гистаминовых рецепторов с успехом используются для профилактики возникновения язв двенадцатиперстной кишки у большинства больных.
Ингибиторы протонного насоса, по нашим наблюдениям, несколько более эффективно предотвращают появление язв желудка и двенадцатиперстной кишки, ассоциированных с НПВП. Одно из существенных преимуществ антагонистов Н2-гистаминовых рецепторов не только перед мизопростолом, но и перед ингибиторами протонного насоса — это меньшая стоимость.
К сожалению, уже через 6 мес [8] рецидивы язв возникают в 3,5% случаев. Поэтому после заживления язв желудка и двенадцатиперстной кишки, ассоциированных с НПВП, больным, которые вынуждены принимать по поводу основного заболевания НПВП, целесообразно (по возможности) назначать менее «ульцерогенные» НПВП; следует также дополнительно рекомендовать проводить профилактические курсы лечения антагонистами Н2-рецепторов гистамина, мизопростолом или ингибиторами протонного насоса (омепразол, рабепразол и эзомепразол) пациентам с язвами желудка и двенадцатиперстной кишки, независимо от наличия или отсутствия у них в анамнезе данных заболеваний. Нецелесообразно снижать терапевтические дозировки этих медикаментозных препаратов. Так, уменьшение дозировки омепразола даже до 20 мг/сут (при проведении профилактического лечения больных) снижает эффективность препарата.
Не менее важно при выборе того или иного варианта лечения больных в стационарных или амбулаторно-поликлинических условиях, а также при проведении профилактических мероприятий учитывать наличие в аптечной сети выбранных врачом препаратов, финансовые возможности стационара или конкретного больного.
Сроки повторного проведения профилактических курсов лечения пациентов, принимающих НПВП, определяются общим состоянием больных, наличием или отсутствием симптомов, которые считаются характерными для заболеваний органов желудочно-кишечного тракта, результатами динамических эндоскопических исследований желудка и двенадцатиперстной кишки.
По вопросам литературы обращайтесь в редакцию.
Ю. В. Васильев, доктор медицинских наук, профессор
ЦНИИГ, Москва