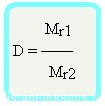
что такое относительная плотность по воздуху
Химия, Биология, подготовка к ГИА и ЕГЭ
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 г\моль • D
Mr(вещества)=29 г\моль • 1.448 = 42 г\моль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 г\моль · 0.8571=36 г\моль
x=Mr(Cx)\Ar(C)=36 г\моль ÷ 12 г\моль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 г\моль · 0.1429=6 г\моль
x=Mr(Hy)\Ar(H)=6 г\моль ÷ 1 г\моль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 г\моль ·1.05=42 г\моль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y\2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V\22,4 л\моль = 33.6\22.4=1.5
Соотношение х : y\2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
Наше вещество — C3H6 — пропен
Еще на эту тему:
Обсуждение: «Относительная плотность по… задачи»
Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 г\моль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 г\моль
и, наконец,
4) D = Mr (( С5H10Br2 ) \ Mr(O2) = 230\32 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз 🙂 ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! 🙂
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 г\моль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99г\моль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 г\моль — получаем либо кремний: SiCl4 \SiBr4, либо галогеналкен: C2Cl4 \С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=m\Mr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=m\n=12\0.15 = 80 г\моль
Ar(Me)=(80-48)\2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=m\Mr=413.2\44 = 9.4 моль
n(оксида)=n(CO2)
Mr=m\n = … не получается
Проверьте условие задачи. Что-то там не то с числами…
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y\2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Относительная плотность вещества по воздуху = M(вещества) \ M(воздуха) (29 г\моль)
Относительная плотность вещества по водороду = M(вещества) \ M(H2)
M(вещества)=M(N2)*D=28г\моль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)\12 г\моль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан 🙂
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 г\моль = 42 г\моль
M(Hy)=42 г\моль* 0.143 = 6 г\моль
y = M(Hy)\Ar(H) = 6\6 = 1
значит, M(Cy)=42-6 = 36 г\моль
y = M(Cy)\Ar(C) = 36\12 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 г\моль = 28 г\моль, предположим, что в оксиде 1 атом О, тогда 12 г\моль — атомная масса элемента. Это С
M( оксида 2) = 15*2 г\моль = 30 г\моль. Если у нас 1 атома О, то 14 г\моль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 г\моль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси
Плотность газа
Плотность газа и другие его физические свойства
Одной из важнейших физических свойств газообразных веществ является значение их плотности.
Зачастую, применительно к газам используют понятие «относительная плотность». Данная величина представляет собой отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Относительная плотность газа
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO2) = 2 × 22 = 44 г/моль.
Плотность газа в лабораторных условиях самостоятельно можно определить следующим образом: необходимо взять стеклянную колбу с краном и взвесить её на аналитических весах. Первоначальный вес – вес колбы, из которой откачали весь воздух, конечный – вес колбы, наполненной до конкретного давления исследуемым газом. Разность полученных масс следует разделить на объем колбы. Вычисленное значение и есть плотность газа в данных условиях.
Чтобы рассчитать плотность газа при н.у. нужно воспользоваться уравнением состояния идеального газа:
В таблице ниже приведены значения плотностей некоторых газов.
Таблица 1. Плотность газов при нормальных условиях.
Химия. 10 класс
*§ 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Интересно знать
Из закона Авогадро вытекают два основных следствия.
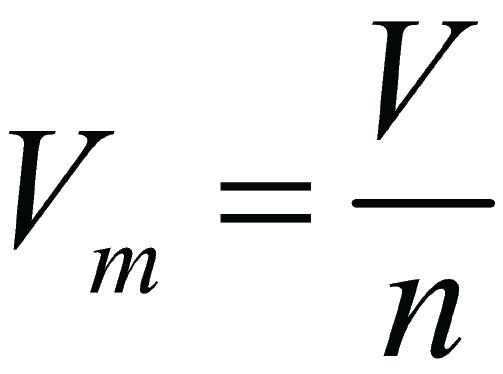
Таким образом, из закона Авогадро следует, что 22,4 дм 3 любого газа при нормальных условиях содержат 6,02 ∙ 10 23 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 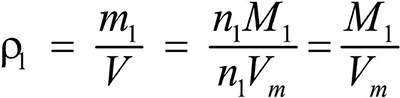
газ 2: 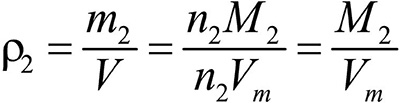
Разделив плотность первого газа на плотность второго, получим: 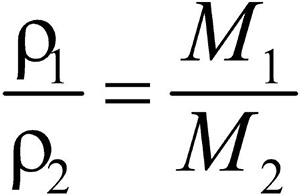
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль ;
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль ), кислорода (32 г/моль ) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм 3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 
2 дм 3 С3Н8 — 10 дм 3 О2
Смеси газов
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = 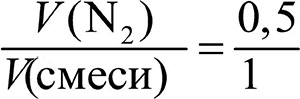
Пример 4. В результате пропускания 150 дм 3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль ):
По уравнению реакции:
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм 3 ;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 
Поскольку после взаимодействия осталось 10 см 3 хлора, то 40 см 3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см 3 хлора и водорода. Поскольку осталось 10 см 3 хлора, то в первоначальной смеси было 20 см 3 водорода и 30 см 3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(Cl2) = 30/50 = 0,6, или 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Тема урока. Плотность и относительная плотность газов
Похожие файлы
Закон Авогадро. Молярный объём газов. Относительная плотность газов.
Разработка урока Молярный объем газов. Закон Авогадро. Объемные отношения газов при химических реакциях.
ДЗ для 1ф ко 2 практическому занятию
Тема: Определение молекулярной формулы веществ по массовым долям элементов
Физика. Внутреннее трение — вязкость газов. Теплопроводность газов.
Видео
Подписи к слайдам:
Примеры решения задач
Некий газообразный углеводород обладает относительной плотностью по воздуху 2. Требуется вычислить молярную массу углеводорода. Решение Средний показатель молярной массы воздуха составляет 29 г/моль М(Х)=М(возд.)∙D=29∙2=58г/моль Углеводород с такой молярной массой — бутан С4Н10. Ответ: 58 г/моль
Необходимо рассчитать, какой объем кислорода понадобится, чтобы сжечь 2дм3 пропана. Следует учитывать при расчетах, что объемы измерены при нормальных условиях. Решение Уравнение реакции горения пропана имеет вид: С3Н8+5О2→3СО2+4Н2О Согласно закону Авогадро, одинаковые объемы разных газообразных веществ содержат равное число (моль) веществ. Предположим, что объем пропана составляет 1дм3. В таком случае, по записанному уравнению для того, чтобы сжечь 1дм3 пропана, необходимо израсходовать 5дм3 кислорода. Таким образом можно рассчитать объем кислорода, который требуется для сжигания 2дм3 пропана: 1дм3С3Н8—5дм3O2 2дм3С3Н8—10дм3О2 Ответ: V(О2)=10дм3
Объем смеси водорода с хлором равен 50см3. В результате взаимодействия газообразных веществ остаток хлора составил 10см3. Требуется определить состав начальной смесь в объемных долях. Все объемы измерены при нормальных условиях. Решение Уравнение химической реакции между водородом и хлором имеет вид: H2+Cl2→2HCl В связи с тем, что в результате взаимодействия осталось 10см3 хлора, можно сделать вывод о том, что 40см3 начальной смеси вступило в реакцию. Хлор и водород взаимодействуют между собой в равных объемных отношениях. Согласно данным соображениям, в реакцию вступили по 20см3 хлора и водорода. Исходя из того, что осталось 10см3 хлора, можно заключить, что в исходной смеси было 20см3 водорода и 30см3хлора. Расчет объемных долей газов в начальной смеси: ϕ(H2)=20/50=,4, или 40%; ϕ(Cl2)=30/50=,6, или 60%. Ответ: ϕ(H2)=40%;ϕ(Cl2)=60%
относительная плотность газа
3.8 относительная плотность газа r: Отношение масс равных объемов сухого газа и сухого воздуха при одинаковых условиях.
3.4.5 относительная плотность газа (relative density); d: Величина, представляющая собой отношение масс равных объемов сухого газа и сухого воздуха при стандартных условиях.
1.3.2.3 относительная плотность газа 
Смотри также родственные термины:
3.1.5 относительная плотность газа d: Отношение масс равных объемов сухого газа и сухого воздуха при стандартных условиях.
3.1.11 относительная плотность газа d: Отношение масс равных объемов сухого газа и сухого воздуха при стандартных условиях.
2.11 относительная плотность газа или пара: Отношение плотности газа или пара к плотности воздуха при тех же давлении и температуре.
Полезное
Смотреть что такое «относительная плотность газа» в других словарях:
относительная плотность газа — Отношение плотности газа к плотности воздуха того же состояния [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN gas relative density … Справочник технического переводчика
относительная плотность газа d — 3.1.5 относительная плотность газа d: Отношение масс равных объемов сухого газа и сухого воздуха при стандартных условиях. Источник … Словарь-справочник терминов нормативно-технической документации
относительная плотность газа — santykinis dujų tankis statusas T sritis Standartizacija ir metrologija apibrėžtis Tam tikro dujų tūrio masės arba dujų tankio, esant tam tikrai temperatūrai ir tam tikram slėgiui, ir to paties tūrio sauso oro masės arba sauso oro tankio, esant… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
относительная плотность газа — отношение масс равных объемов сухого газа и сухого воздуха при одинаковых условиях по температуре и давлению. (Смотри: ГОСТ Р 51733 2001. Котлы газовые центрального отопления, оснащенные атмосферными горелками, номинальной тепловой мощностью до… … Строительный словарь
относительная плотность газа или пара — Отношение плотности газа или пара к плотности воздуха при одинаковых значениях давления и температуры (плотность воздуха равна 1,0). [ГОСТ Р МЭК 60050 426 2006] Тематики взрывозащита EN relative density of a gas or a vapour … Справочник технического переводчика
относительная плотность газа или пара — 2.11 относительная плотность газа или пара: Отношение плотности газа или пара к плотности воздуха при тех же давлении и температуре. Источник: ГОСТ Р 51330.9 99: Электрооборудование взрывозащищенное. Часть 10. Классификация взрывоопасных зон … Словарь-справочник терминов нормативно-технической документации
относительная плотность газа относительная плотность пара — relative density of a gas, relative density of a vapour Отношение плотности газа или пара к плотности воздуха при одинаковых значениях давления и температуры (плотность воздуха равна 1,0) … Электротехнический словарь
относительная плотность пара относительная плотность газа — relative density of a gas, relative density of a vapour Отношение плотности газа или пара к плотности воздуха при одинаковых значениях давления и температуры (плотность воздуха равна 1,0) … Электротехнический словарь
Плотность газа относительная — Относительная плотность газа: отношение масс равных объемов сухого газа и сухого воздуха при одинаковых температуре и давлении. Источник: ГОСТ Р 51377 99. Государственный стандарт Российской Федерации. Конвекторы отопительные газовые бытовые.… … Официальная терминология
относительная плотность — 3.36 относительная плотность (relative density): Отношение плотности газа или пара к плотности воздуха при одинаковых значениях давления и температуры (плотность воздуха принята за 1). Источник … Словарь-справочник терминов нормативно-технической документации