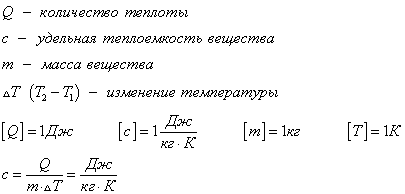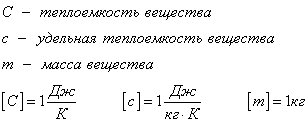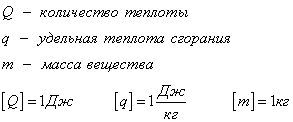что такое охлаждение в физике
Что такое охлаждение в физике
При нагревании тело получает тепло, а при охлаждении отдает его.
Количество теплоты, полученное телом при нагревании, можно рассчитать по формуле:
— разность конечной и начальной температур.
Эта же формула годится для расчета количества теплоты, выделившейся при охлаждении тела.
При охлаждении тела до прежней температуры выделяется такое же количество теплоты, которое было затрачено на нагревание этого тела.

1. Почему в водоемах летом вода на достаточной глубине плохо прогревается?
Нагревание воды солнечными лучами происходит сверху. Однако вода обладает плохой теплопроводностью.
2. Почему зимой на глубине у дна водоема сохраняется температура +4 градуса по Цельсию?
Нагревание пузырька плотничьего уровня.
Очень часто лед используется для охлаждения. Это возможно, потому что при таянии (плавлении) льда поглощается большое количество тепла.
Что такое холод с точки зрения физики?
Существует ряд очень простых вопросов, ответы на которые кажутся нам столь очевидными, что выдаются автоматически, без подключения мыслительного аппарата.
К примеру, всем, от мала до велика, известно, что такое холод. С точки зрения физики ответ будет далеко не простым, поскольку затронет основополагающие понятия этой науки.
Существует ли холод?
Многим из нас вопрос, существует ли вообще холод, покажется нелепым и бессмысленным. Конечно, холод существует, ведь вы не раз его ощущали и даже испытывали из-за него дискомфорт. Но если посмотреть внимательнее, мы увидим, что понятие холода – это всего лишь производное от понятия тепла: когда тепла много, мы ощущаем жар, когда его недостаточно – чувствуем холод.
Таким образом, с точки зрения физики, холода объективно не существует, это всего лишь недостаточное количество тепла. Согласно одной из легенд, популярных в мире учёных, впервые на эту проблему обратил внимание Альберт Эйнштейн, причём ещё в то время, когда был студентом.
При помощи собственных ощущений мы можем определять тепло и холод в достаточно узком диапазоне температур: всё, что нагрето выше 60-70 градусов Цельсия, будет для нас «очень горячим», а всё, что имеет температуру ниже нуля по Цельсию – «очень холодным».
Что говорят учебники физики?
Если открыть учебник физики, то именно это в нём и написано: холод – это состояние сравнительно низкой температуры, выражаемое в субъективном ощущении либо сравнении с более тёплым состоянием окружающей среды, предмета, субстанции. Т.е., говоря простыми словами, это недостаток тепла. На самом деле, какое-то количество тепла присутствует практически всегда, но если оно нам кажется недостаточным, то мы называем это состояние холодом.

В физике существует понятие абсолютного нуля, при котором вещества лишены тепловой энергии. Абсолютный нуль соответствует –273,15 градусам Цельсия, и в природе он возможен лишь в космическом вакууме и при полном отсутствии света или других излучений. В этом состоянии хаотическое движение элементарных частиц, свойственное всем без исключения веществам, полностью прекращается. Стоит веществу, находящемуся в состоянии полного покоя, получить хотя бы один квант тепловой энергии, движение частиц возобновляется.
Чем выше температура нагрева вещества, тем активнее и энергичнее движутся составляющие его частицы. Как известно, именно с этим связан процесс испарения: наиболее активные и подвижные молекулы отрываются от основной массы и в дальнейшем перемещаются уже среди молекул воздуха или иного газа.
Если же лишить частицы тепловой энергии, они становятся значительно менее подвижными. Внешне это выражается в выпадении капель конденсата или намерзании кристалликов инея на твёрдых поверхностях.
Охлаждение – процесс отъёма тепла
Чтобы сделать какой-либо предмет холодным, надо всего лишь отнять у него тепло, передав его излишек другому предмету или среде. Так, зимой достаточно поставить слишком горячий чай на открытый балкон, чтобы через несколько минут он остыл, отдав своё тепло окружающей среде. Летом мы, наоборот, охлаждаем свой напиток, бросая в стакан кусочки льда, которые постепенно тают, забирая лишнее тепло у сока или лимонада.
По принципу отъёма излишков тепла работают все современные холодильные установки. Изъятие тепловой энергии происходит за счёт испарения хладагента – специального вещества, которое активно испаряется при низкой температуре. Атомы хладагента отбирают тепловую энергию у воздуха, находящегося в камере холодильника, а тот, в свою очередь, охлаждает стенки камеры и лежащие на полках продукты.
Итак, что же такое холод?
Основываясь на вышеописанных примерах, мы можем уверенно утверждать: с точки зрения физики холода не существует. То, что мы называем холодом – всего лишь состояние недостаточного, с нашей точки зрения, тепла.

В целом же понятия «тёплого» и «холодного» являются нашими субъективными ощущениями: все предметы и среды, нагретые выше температуры нашего тела, будут казаться нам тёплыми или горячими, а всё, что имеет более низкую, чем наша кожа, температуру, покажется прохладным или холодным.
II. Молекулярная физика
Тестирование онлайн
Термодинамика
Раздел молекулярной физики, который изучает передачу энергии, закономерности превращения одних видов энергии в другие. В отличие от молекулярно-кинетической теории, в термодинамике не учитывается внутреннее строение веществ и микропараметры.
Термодинамическая система
Это совокупность тел, которые обмениваются энергией (в форме работы или теплоты) друг с другом или с окружающей средой. Например, вода в чайнике остывает, происходит обмен теплотой воды с чайником и чайника с окружающей средой. Цилиндр с газом под поршнем: поршень выполняет работу, в результате чего, газ получает энергию, и изменяются его макропараметры.
Количество теплоты
Это энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях.
В результате различных процессов теплообмена энергия, которая передается, определяется по-своему.
Нагревание и охлаждение
Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле
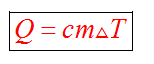

Плавление и кристаллизация
Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле

Удельная теплота плавления известная для каждого вещества величина, значение смотреть в физических таблицах.
Парообразование (испарение или кипение) и конденсация

Удельная теплота парообразования известная для каждого вещества величина, значение смотреть в физических таблицах.
Количество теплоты, которое выделяется при сгорании вещества

Удельная теплота сгорания известная для каждого вещества величина, значение смотреть в физических таблицах.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:
Удельная теплоемкость вещества
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества
c — удельная теплоемкость вещества [Дж/кг*˚C]
C — теплоемкость вещества [Дж/˚C]
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Основные агрегатные состояния вещества
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
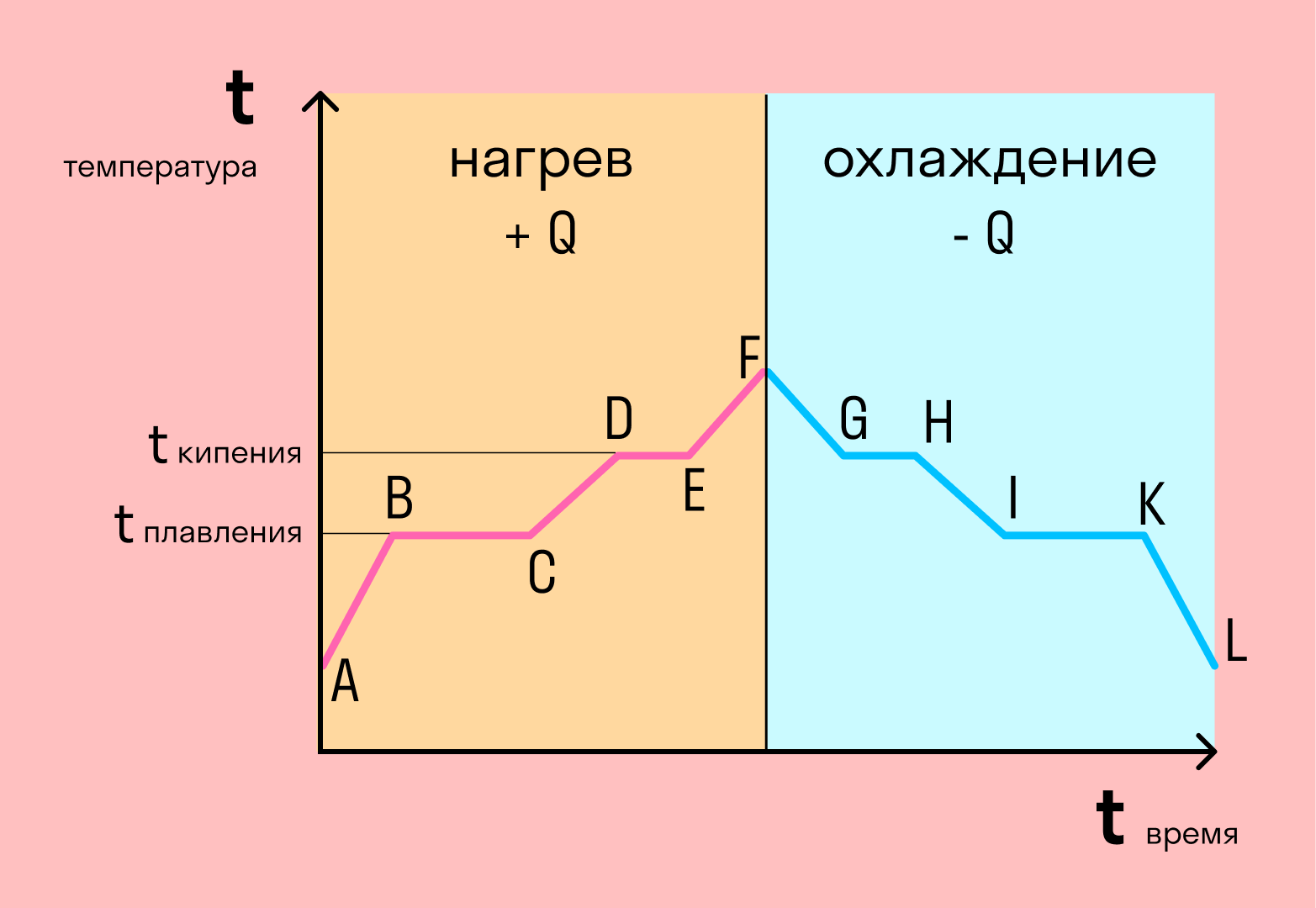
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.