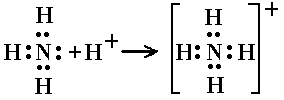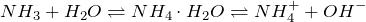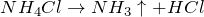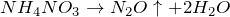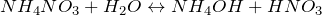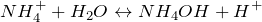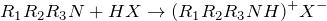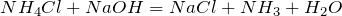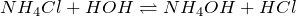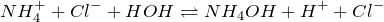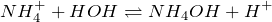что такое nh4 в химии
Формула аммония
Определение и формула аммония
Химическая формула NH4 +
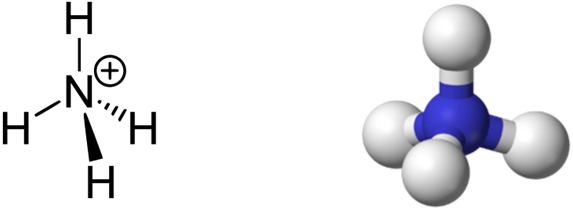
Ион аммония NH4 + является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра.
Образование иона аммония
В молекуле аммиака NH3 три электронные пары образуют три связи N – H, четвертая, прина длежащая атому азота электронная пара является неподеленной. С помощью этой электронной пары образуется связь с ионом водорода, который имеет свободную орбиталь:
Таким образом, в ионе аммония три ковалентные связи образуются по обменному механизму, а одна – по донорно-акцепторному. Механизм образования не оказывает слияния на характеристики связи, все связи в катионе аммония равноценны.
Соединения аммония
Катион аммония может образовывать с различными противоионами аммонивые соединения, в которых положительно заряженный атом азота, ковалентно связан с ионами водорода и (или) с органическими радикалами, а ионно – с каким-либо анионом.
Неорганические соединения аммония
Гидрат аммиака (гидроксид аммония, аммиачная вода, едкий аммоний, едкий аммиак). Формула: NH3·H2O
Образуется при взаимодействии аммиака с водой. Слабое основание, диссоциирует в воде с образованием катионов аммония и гидроксид-ионов:
Реакция обратима, поэтому водные растворы гидроксида аммония всегда имеют характерный резкий запах аммиака.
Соли аммония
Все соли аммония по своим свойствам похожи на соответствующие соли натрия. Хорошо растворяются в воде, полностью диссоциируют в водном растворе, при нагревании разлагаются:
В растворе гидролизуются по катиону:
Первичные, вторичные и третичные аммониевые соединения можно рассматривать как соли соответствующих аминов, их можно получить взаимодействием этих аминов с кислотами:
где R1,R2, R3 — органические радикалы или водород, X — анион кислотного остатка.
Качественная реакция на ионы аммония – взаимодействие со щелочами с выделением аммиака:
Примеры решения задач
| Задание | Какое значение рН (больше или меньше 7) имеет водный раствор хлорида аммония? Запишите молекулярное и ионно-молекулярное уравнения гидролиза. |
| Решение | Хлорид аммония NH4Cl – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. |
Полное ионное уравнение:
Краткое ионное уравнение:
В процессе гидролиза образовались водорода (H + ), поэтому раствор имеет кислую среду (pH ПРИМЕР 2
| Задание | Какая масса соли образуется при взаимодействии 44,8 л аммиака и 33,6 литров хлороводорода (нормальные условия)? |
| Решение | Запишем уравнение реакции: |
Молярные массы аммиака, хлороводорода и образующейся соли – хлорида аммония (NH4Cl) равны:
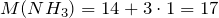
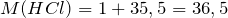
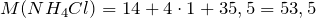
Сколько соли образуется.
Рассчитаем исходные количества аммиака и хлородоводорода с учетом того, что 1 моль газа при нормальных условиях занимает объем 22,4л:
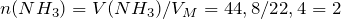
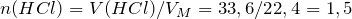
По уравнению реакции
Следовательно, аммиак взят в избытке. Расчет будем вести по хлороводороду.
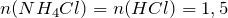
Масса хлорида аммония будет равна:
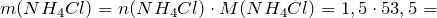
Аммоний
Существует также короткоживущий свободный радикал аммония с формулой NH4 [7] (см. Свободный аммоний).
Содержание
Диссоциация солей аммония
При диссоциации солей аммония в водных растворах образуется катион аммония, например:
Свойства солей аммония
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
Если соль образована нелетучей кислотой, то нагреванием можно удалить NH3:
Реакция для обнаружения аммония
Реакция для обнаружения аммония — выделение аммиака при действии едких щелочей на соли аммония:
Широко используется для спектрофотометрического количественного анализа также реакция с реактивом Несслера.
Свободный аммоний
При попытке получения в свободном виде аммоний распадается на аммиак и водород. Однако при определенных условиях возможно выделение очень нестабильного свободного аммония NH4. Впервые он был получен при восстановлении раствора хлорида аммония амальгамой натрия в виде тестообразной массы, выделяющей водород и аммиак. В дальнейшем его удалось получить в жидком аммиаке. Если действовать NH4I на синий раствор металлического натрия в жидком аммиаке, то он обесцвечивается вследствие реакции по схеме:
Так как выделение водорода при этом не наблюдается и образовавшаяся бесцветная жидкость легко присоединяет иод (предположительно – по схеме: 2NH4 + I2 = 2NH4I), весьма вероятно, что в ней содержится свободный радикал – NH4. Заметное разложение последнего с выделением водорода начинает идти лишь выше минус 40 °C. [3]
Замещённые соединения аммония
Органические
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические
См. также
Литература
Примечания
Полезное
Смотреть что такое «Аммоний» в других словарях:
АММОНИЙ — АММОНИЙ ( Αμμώνιος), сын Гермия (между 435 445 между 517 526, Александрия) представитель Александрийской школы неоплатонизма, преподаватель философии, не пренебрегавший геометрией и астрономией. Комментарии Аммония к Аристотелю пользовались… … Философская энциклопедия
АММОНИЙ — (лат. ammonium от греч. ammoniakon). Металлическое вещество, составляющее основание аммиака, представляет соединение 1 атома азота с 4 атомами водорода. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. АММОНИЙ лат.… … Словарь иностранных слов русского языка
Аммоний — я, муж. Стар. редк.Отч.: Аммониевич, Аммониевна.Производные: Моня.Происхождение: (От др. евр. ’amon искусный мастер, художник.)Именины: 23 янв., 8 февр., 10 сент., 14 сент., 17 сент., 17 окт. Словарь личных имён. Аммоний Посвященный Амону, егип.… … Словарь личных имен
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
аммоний — нашатырь Словарь русских синонимов. аммоний сущ., кол во синонимов: 2 • нашатырь (6) • удо … Словарь синонимов
АММОНИЙ — NH4+, однозарядный катион. Входит в состав нитрата аммония NH4NO3, сульфата аммония. (NH4)2SO4 и др. солей аммония … Большой Энциклопедический словарь
АММОНИЙ — АММОНИЙ, я, муж. Не существующее в свободном виде соединение атомов азота и водорода, обладающее химическими свойствами металлов. | прил. аммониевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Аммоний — (NH+4) неорганический радикал; входит в молекулы многих химических соединений, в свободном виде не существует. Широко применяют соли А. (аммониевые соли). Гидроксид А. (гидроокись А.) NH4OH образуется при растворении аммиака в воде … Российская энциклопедия по охране труда
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
Соли аммония. Общая характеристика. Химические свойства.
Соли аммония.
Ион аммония образуется, когда аммиак, слабое основание, реагирует с кислотами Бренстеда (доноры протонов):
Таким образом, обработка концентрированных растворов солей аммония сильным основанием дает аммиак.
Когда аммиак растворяется в воде, его небольшое количество превращается в ионы аммония:
— если pH низкий, равновесие смещается вправо: больше молекул аммиака превращается в ионы аммония.
— если pH высокий, равновесие сдвигается влево: ион гидроксида отнимает протон от иона аммония, образуя аммиак.
Важно! Все соли аммония растворимы в воде, кроме гексахлороплатината аммония (раньше использовалось в качестве теста на NH4 + )
Наибольшее значение среди солей аммония в промышленности имеют хлорид аммония (NH4Cl), сульфат аммония ((NH4)2SO4), нитрат аммония (NH4NO3), характеристики которых мы сегодня и пройдем.
Уровень опасности: раздражающее средство
3) С щелочами (Ме АІ):
4) С щелочами (Ме АІІ):
5) С нерастворимыми основаниями:
6) C основаниями (комплексообразующими):
8) С солями летучих кислот:
9) С оксидами малоактивных Ме:
10) С оксидами активных Ме:
Уровень опасности: окислитель, раздражающее средство, экологически опасен
Уровень опасности: окислитель (взрывчатое вещество), раздражающее вещество
NH4NO 3
Азот. Аммиак. Соли аммония
Селитра – природные нитраты натрия и калия – была известна в Китае в первые века нашей эры; ее использовали для приготовления пороха и проведения фейерверков. Позже она упоминается в трудах европейских алхимиков (латинские названия – nitro или sal nitri). Нагревая селитру с железным купоросом, алхимики получали азотную кислоту, которая длительное время называлась по-латыни aqua fortis («крепкая вода»; в русских текстах обычно встречается термин «крепкая водка»).
Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой):

Он же обнаружил, что при взаимодействии азотной кислоты с поташом K2CO3 образуется чистая калийная селитра. Это открытие имело большое практическое значение, ведь раньше селитру, необходимую для производства пороха, ввозили в Европу из стран Востока, а также выделяли из соляного налёта на стенах конюшен или из селитряных ям, где она образовывалась под действием микроорганизмов как конечный продукт окисления азотсодержащих органических соединений.
При прокаливании смеси селитры NaNO3,железного купороса FeSO4∙7H2O, алюмокалиевых квасцов KAl(SO4)2∙12H2O и нашатыря NH4Cl алхимикам удалось получить жидкость, растворявшую даже «царя металлов» — золото. Поэтому ее и назвали aqua regia, что значит «царская вода» или «царская водка». Царская водка – жидкость жёлтого цвета, образующаяся при смешении трёх объёмов соляной и одного объёма азотной кислот. В царской водке без труда растворяется даже платина.
Азот независимо друг от друга открыли в конце XVIII в. несколько учёных. Английский исследователь Генри Кавендиш получил «мефитический воздух» (так он назвал азот), многократно пропуская воздух над раскаленным углем (тем самым удаляя кислород), а потом через раствор щелочи для поглощения образовавшегося углекислого газа СО2.

Соотечественник Кавендиша Джозеф Пристли описал образование газа, не поддерживающего горение и дыхание, — «флогистированного воздуха», — наблюдая за горением свечи в закрытом сосуде.
Наконец, ещё один английский учёный, Даниэль Резерфорд, также получил азот из воздуха. В отличие от Кавендиша и Пристли, он сразу же, 1772 г., опубликовал работу, где описал получение и свойства выделенного им «удушливого воздуха». Поэтому именно Резерфорд считается первооткрывателем азота.
В природе наибольшее количество азота находится в несвязанном виде в воздухе. Основной состав атмосферного воздуха определил А.Л.Лавуазье, по предложению которого новый элемент и назвали азотом. Название это составлено из греческого слова «зое» («жизнь») и приставки «а»- («не-») и означает «безжизненный», «не дающий жизнь». Латинское низвание азота – Nitrogenium – переводится как «образующий селитру».
В промышленности азот получают из жидкого воздуха. Для этого воздух переводят в жидкое состояние, и при температуре – 196 0 С азот испаряется.
В лаборатории азот получают разложением нитрита аммония NH4NO2 при нагревании:
Физические свойства
Характерные степени окисления:
— 3 0 +1 +2 +3 +4 +5
Химические свойства
В химических реакциях азот может быть как окислителем, так и восстановителем.
Азот взаимодействует как окислитель:
Азот взаимодействует как восстановитель:
Применение
Азот является исходным сырьем для получения аммиака, азотной кислоты и азотных удобрений.
Аммиак
Аммиак – бесцветный газ с резким запахом, хорошо растворимый в воде. В одном литре воды при температуре 20 0 С растворяется 700 л аммиака. Этот раствор называется аммиачной водой или нашатырным спиртом.
Химические свойства
Кислотно-основные свойства
AgCl + 2NH3 = [Ag(NH3)2]Cl Хлорид диамин серебра (I)
Окислительно – восстановительные свойства
В молекуле аммиака азот имеет степень окисления – 3, поэтому в окислительно – восстановительных реакциях он может только отдавать электроны и является только восстановителем.
Соли аммония
При взаимодействии аммиака или гидроксида аммония с кислотами образуются соли аммония:
Все соли аммония хорошо растворимы в воде. Соли аммония имеют общие свойства солей. К особым свойствам солей аммония относятся реакции их термического разложения, которые протекают по-разному, в зависимости от характера аниона, например:
Реакция взаимодействия солей аммония со щелочью является качественной реакцией на катион аммония NH4 + :
Выделяющийся аммиак определяют по запаху или по посинению влажной лакмусовой бумаги.
Применение аммиака и солей аммония
Из аммиака получают азотную кислоту, гидроксид аммония (нашатырный спирт), соли аммония и т.д. Нашатырный спирт NH4OH и нашатырь NH4Cl широко применяется в медицине. Нитрат аммония, фосфат аммония и другие аммонийные соли используются в сельском хозяйстве в качестве удобрений.
Скачать:
Скачать бесплатно реферат на тему: «Азот» Azot.doc (246 Загрузок)
Скачать бесплатно реферат на тему: «Азот и фосфор» Азот-и-фосфор.docx (248 Загрузок)
Скачать бесплатно реферат на тему: «Соединения азота» Соединения-азота.docx (222 Загрузки)
Скачать бесплатно реферат на тему: «Производство азотных удобрений» ПРОИЗВОДСТВО-АЗОТНЫХ-УДОБРЕНИЙ.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Аммиак» Аммиак.docx (259 Загрузок)
Скачать бесплатно реферат на тему: «Аммиачная селитра» Аммиачная-селитра.docx (Одна Загрузка)
Скачать рефераты по другим темам можно здесь
Что такое аммоний и где его используют
Содержание статьи
Аммоний – химическое вещество, образующееся в результате взаимодействия атомов азота и водорода (формула – NH4), активно использующееся в различных сферах деятельности человека. Аммоний обнаруживается в составе более сложных соединений и никогда в чистом виде. К таким соединениям относятся: хлорид аммония или нашатырь, при взаимодействии с водой образующий нашатырный спирт, сульфат аммония, аммоний ацетат, нитрат аммония.
В природе возникновение подобных соединений связано с вулканической активностью планеты, соли хлорида аммония присутствуют в почве и горных породах в местах разломов земной коры, в пещерах, вблизи часто извергающихся вулканов. Незначительное количество нашатыря образуется в процессе разложения продуктов жизнедеятельности животных. В промышленных масштабах аммоний получают в лабораторных условиях.
Использование аммония в промышленности
Сфера применения этого вещества чрезвычайно широка – от производства строительных материалов до пищевой промышленности.
Хлорид аммония получил название нашатыря, это вещество представляет собой белый мелкокристаллический порошок, хорошо растворимый в воде и не имеющий запаха, используется при производстве стали, в качестве удобрения в сельском хозяйстве, как лекарственный препарат, обладающий диуретическим действием, в медицине.
Сульфат аммония – это порошок без запаха и цвета, хорошо растворимый в воде и разлагающийся при нагревании до 250°С. Основные сферы применения: пищевая, химическая, горнодобывающая промышленность, производство кормов для животных, строительных материалов. Сульфат аммония обладает легким дезинфицирующим действием, используется в разработке вакцин.
Аммония ацетат – бесцветный или белый кристаллический порошок, получаемый при взаимодействии раствора аммиака с уксусной кислотой. Наиболее часто применяется в химической промышленности, при изготовлении и хранении изделий из кожи, в качестве консерванта при производстве некоторых продуктов питания.
Аммоний как пищевая добавка
Различные соединения аммония применяются в пищевой промышленности в качестве консерванта и пищевой добавки:
Е510 (хлорид аммония). Используется в основном в хлебобулочном производстве в качестве разрыхлителя теста, в пивоварении для ускорения процесса брожения пива. В ряде стран пищевая добавка Е510 запрещена, в России добавляется в дрожжи, приправы, соусы, мучные изделия.
Е517 (сульфат аммония). Применяется в качестве заменителя соли, эмульгатора, ускоряет процесс поднятия хлеба, улучшает качество муки, вещество разрешено к употреблению в пищу в России и странах ЕС.
Е264 (ацетат аммония). Способствует увеличению срока годности пищевых продуктов, предотвращает появление плесени, улучшает вкус, запрещен к употреблению в большинстве стран мира, в том числе в России.