что такое kmno4 в химии
Перманганат калия
| Перманганат калия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Перманганат калия |
| Химическая формула | KMnO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое (хрупкие кристаллы) |
| Отн. молек. масса | 158,03 а. е. м. |
| Молярная масса | 158,03 г/моль |
| Плотность | 2.703 г/см³ |
| Термические свойства | |
| Температура разложения | 240 °C |
| Молярная теплоёмкость (ст. усл.) | 119,2 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -813.4 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 6.38 (20 °C) |
| Классификация | |
| Рег. номер CAS | 7722-64-7 |
| SMILES | O- [Mn](=O)(=O)=O.K+ |
| Регистрационный номер EC | 231-760-3 |
| RTECS | SD6475000 |
Содержание
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления σ 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/моль·K (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/моль·K (т) (при 298 К) |
Химические свойства
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
формула
группа
Медицинское применение
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счет этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приемом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на нее анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Побочные действия
Способ применения и дозы
Наружно, в водных растворах для промывания ран (0.1-0.5 %), для полоскания рта и горла (0.01-0.1 %), для смазывания язвенных и ожоговых поверхностей (2-5 %), для спринцевания (0.02-0.1 %) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Взаимодействие
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:



Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Галерея
М. Пресняков,
Кристаллы марганцовокислого калия.
2010.
Порошок перманганата калия
(под микроскопом)
Калия перманганат
Калия перманганат
| Перманганат калия | |||||||||||||||||||||||
 | |||||||||||||||||||||||
 | |||||||||||||||||||||||
| Общие | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Систематическое наименование | Перманганат калия | ||||||||||||||||||||||
| Химическая формула | KMnO4 | ||||||||||||||||||||||
| Отн. молек. масса | 158,03 а. е. м. | ||||||||||||||||||||||
| Молярная масса | 158,03 г/моль | ||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||
| Плотность вещества | 2.703 г/см³ | ||||||||||||||||||||||
| Состояние (ст. усл.) | бесцветная жикость | ||||||||||||||||||||||
| Термические свойства | |||||||||||||||||||||||
| Температура разложения | 240 °C | ||||||||||||||||||||||
| Молярная теплоёмкость (ст. усл.) | 119,2 Дж/(моль·К) | ||||||||||||||||||||||
| Энтальпия (ст. усл.) | -813.4 кДж/моль | ||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||
| Растворимость в воде | 6.38 (20 °C) г/100 мл | ||||||||||||||||||||||
| Классификация | |||||||||||||||||||||||
| номер CAS | [7722-64-7 | ||||||||||||||||||||||
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/моль·K (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/моль·K (т) (при 298 К) |
Химические свойства
Сильный окислитель. Стандартные окислительно-восстановительные потенциалы приведены в таблице.
В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия:
Однако надо отметить, что в последняя реакция (в щелочной среде) идёт по указаной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
формула
группа
Медицинское применение
Разбавленные растворы (около 0,1%) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
Фармакологическое действие
Показания
Противопоказания
Побочные действия
Способ применения и дозы
Наружно, в водных растворах для промывания ран (0.1-0.5%), для полоскания рта и горла (0.01-0.1%), для смазывания язвенных и ожоговых поверхностей (2-5%), для спринцевания (0.02-0.1%) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Взаимодействие
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Литература
См. также
Полезное
Смотреть что такое «Калия перманганат» в других словарях:
КАЛИЯ ПЕРМАНГАНАТ — Действующее вещество ›› Калия перманганат (Potassium permanganate) * * * КАЛИЯ ПЕРМАНГАНАТ ( Кalii permanganas ). Синонимы: Калий марганцовокислый, Кalium hypermanganicum. Темно или красно фиолетовые кристаллы или мелкий порошок с металлическим… … Словарь медицинских препаратов
КАЛИЯ ПЕРМАНГАНАТ — Kalii permanganas. Свойства. Калия перманганат (марганцовокислый калий) кристаллический порошок или ромбовидные кристаллы темно фиолетового цвета с металлическим опенком. Хорошо растворим в воде (1:18), в зависимости от концентрации растворы окр … Отечественные ветеринарные препараты
КАЛИЯ ПЕРМАНГАНАТ — КАЛИЯ ПЕРМАНГАНАТ, KMnO4, темно фиолетовые кристаллы, разлагается выше 240шC. Калия перманганат применяют для отбеливания тканей, очистки газов, как компонент ослабляющих растворов в фотографии, аналитической химии, в медицине как антисептик … Современная энциклопедия
калия перманганат — калий марганцовокислый, марганцовка Словарь русских синонимов. калия перманганат сущ., кол во синонимов: 3 • калий марганцовокислый (1) … Словарь синонимов
Калия перманганат — КАЛИЯ ПЕРМАНГАНАТ, KMnO4, темно фиолетовые кристаллы, разлагается выше 240°C. Калия перманганат применяют для отбеливания тканей, очистки газов, как компонент ослабляющих растворов в фотографии, аналитической химии, в медицине как антисептик. … Иллюстрированный энциклопедический словарь
КАЛИЯ ПЕРМАНГАНАТ — KMnO4, темно фиолетовые кристаллы. Растворим в воде. Цвет раствора красно фиолетовый. Сильный окислитель. Применяют для отбеливания тканей, в фотографии, аналитической химии, как антисептическое средство в медицине … Большой Энциклопедический словарь
калия перманганат — KMnO4, тёмно фиолетовые кристаллы. Растворим в воде. Цвет раствора красно фиолетовый. Сильный окислитель. Применяют для отбеливания тканей, в фотографии, аналитической химии, как антисептическое средство в медицине. * * * КАЛИЯ ПЕРМАНГАНАТ КАЛИЯ… … Энциклопедический словарь
калия перманганат — kalio permanganatas statusas T sritis chemija formulė KMnO₄ atitikmenys: angl. potassium hypermanganate; potassium permanganate rus. калий марганцовокислый; калия перманганат ryšiai: sinonimas – kalio tetraoksomanganatas … Chemijos terminų aiškinamasis žodynas
Калия перманганат — марганцовокислый калий, KMnO4, см. Перманганат калия … Большая советская энциклопедия
КАЛИЯ ПЕРМАНГАНАТ — (potassium permanganate) соль калия; применяется для дезинфекции и очистки ран, а также в качестве общего кожного антисептика. Раздражает слизистые оболочки; ядовита при попадании внутрь организма … Толковый словарь по медицине
Формула перманганата калия
Определение и формула перманганата калия
Раствор KMnO4 имеет темно-малиновый цвет, а при большой концентрации – фиолетовый цвет, свойственный перманганат ионам (MnO4 — ).
Рис. 1. Кристаллы перманганата калия. Внешний вид.
Химическая формула перманганата калия
Химическая формула перманганата калия – KMnO4. Она показывает, что в составе молекулы этого сложного вещества находится один атома калия (Ar = 39 а.е.м.), один атом марганца (Ar = 55 а.е.м.)и четыре атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу перманганата калия:
Mr(KMnO4) = 39 + 55 + 4×16 = 39 + 55 +64 =158
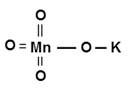
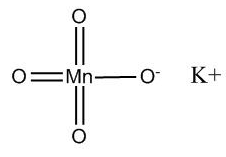
Структурная (графическая) формула перманганата калия
Более наглядной является структурная (графическая) формула перманганата калия. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула перманганата калия имеет вид:
Перманганат калия представляет собой среднюю соль марганцовой кислоты, которая способна диссоциировать на ионы в водном растворе согласно следующему уравнению:
В этой связи для перманганата калия также можно указать и ионную формулу:
Примеры решения задач
| Задание | Вычислите, какой объём кислорода (н.у.) выделится при разложении 237 г перманганата калия? |
| Решение | Запишем уравнение разложения перманганата калия: |
Вычислим количество вещества перманганата калия по формуле:
Для этого необходимо указать молярную массу перманганата калия(значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(KMnO4) = Ar(K) + Ar(Mn) + 4×Ar(O) = 39 + 55 + 4×16 = 94 + 64 = 158 г/моль
Тогда, количество вещества перманганата калия будет равно:
n(KMnO4)= 237/ 158 = 1,5 моль
Согласно уравнению реакции n(O2) : n(KMnO4) = 1 : 2, значит:
n(O2) = 1/2 × n(KMnO4) = ½ × 1,5 = 0,75 моль
Найдем молярную массу молекулярного кислорода (допущение, указанное при расчете молярной массы кислорода действительно и в данном случае):
M(O2) = 2×Ar(O) = 2×16 = 32 г/моль
Определим объем выделившегося кислорода:
| Задание | Установите массовую формулу вещества, содержащего 33,3% натрия, 20,3% азота и 46,4% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (натрий), «у» (азот) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Na)/Ar(Na) :ω(N)/Ar(N) : ω(O)/Ar(O);
x:y:z= 33,3/23 : 20,3/14 : 46,4/16;
x:y:z= 1,45 : 1,45:2,9 = 1 : 1: 2
Значит формула соединения натрия, азота и кислорода будет иметь вид NaNO2. Это нитрит натрия.