Что такое хром в химии
Хром. Химия хрома и его соединений
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
3. Оксид хрома (III) не взаимодействует с водой.
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
3. Гидроксид хрома (II) – сильный восстановитель.
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Что такое хром в химии
| Название, символ, номер | Хром / Chromium (Cr), 24 |
|---|---|
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d 5 4s 1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K |
| Температура кипения | 2945 K |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Содержание
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Природный хром состоит из четырех стабильных изотопов ( 50 Cr (изотопная распространённость 4,345 %), 52 Cr (83.789 %), 53 Cr (9.501 %), 54 Cr (2.365 %)).
Химические свойства
Характерные степени окисления
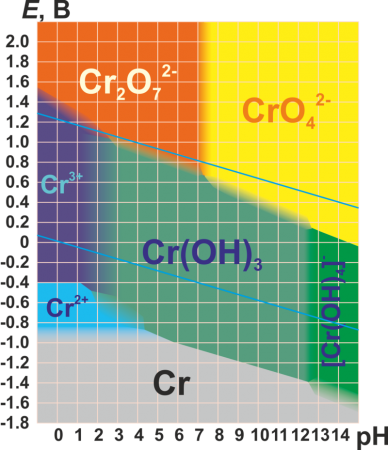
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr 2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr 3+ (зелёные или лиловые соли) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 | Кислотный | CrO4 2− (хроматы, желтые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr 2+ (растворы голубого цвета) получаются при восстановлении солей Cr 3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr 2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr 2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr 3+ существует в виде аквакомплексов [Cr(H2O)6] 3+ ) до зелёного (в координационной сфере присутствуют анионы).
Cr 3+ склонен к образованию двойных сульфатов вида M I Cr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами, получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Фото соединений хрома:

Хром окись пигментная

Паста ГОИ (содержит Окись хрома)
Калий хромовокислый (калий хромат)

Хромовой ангидрид (Хрома (VI) окись
Хром (III) окись
Хром азотнокислый
Хромокалиевые квасцы
Соединения двухвалентного хрома.
Оксид хрома (II) CrO
Гидроксид хрома (II) Cr(OH)2
Фторид хрома (II) CrF2
Хлорид хрома (II) CrCl2
Бромид хрома (II) CrBr2
Йодид хрома (II) CrI2
Сульфид хрома (II) CrS
Сульфат хрома (II) CrSO4
Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3
Гидроксид хрома (III) Cr(OH)3
Фторид хрома (III) CrF3
Хлорид хрома (III) CrCl3
Бромид хрома (III) CrBr3
Иодид хрома (III) CrI3
Оксифторид хрома (III) CrOF
Сульфид хрома (III) Cr2S3
Сульфат хрома (III) Cr2(SO4)3
Ортофосфат хрома (III) CrPO4
Соединения четырехвалентного хрома.
Оксид хрома (IV) CrO2
Фторид хрома (IV) CrF4
Хлорид хрома (IV) CrCl4