Что такое химерный ген
Генетические маркеры
Химерные онкогены
Транслокации после крупных делеций и дупликаций являются самыми частыми хромосомными аномалиями. Различают два основных типа специфических хромосомных транслокаций:
Транслокации хромосомы 8 с хромосомами 2, 14 и 22, в результате которых происходит перемещение протоонкогена MYC (8q24) в область генов иммуноглобулинов IGH (14q32), IGK (2p12) и IGL (22q11), – классический пример аномалии первого типа. Эти гены обладают очень сильными регулярными элементами, которые начинают постоянно активировать MYC. Как правило, не участвует в перестройке первый некодирующий экзон протоонкогена. В 90% случаев лимфомы Беркитта выявляются именно эти транслокации.
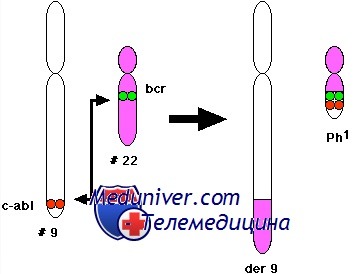
В результате транслокаций, инверсий и небольших делеций достаточно часто появляются химерные гены с новой агрессивной функцией белкового продукта – слитных белков. В 1973 г описана специфическая транслокация хромосом 9 и 22, приводящая к появлению филадельфийской хромосомы при хронической миелоидной лейкемии, – классический пример транслокаций второго типа. В результате появляется ген, кодирующий слитный белок, имеющий свойства тирозинкиназы, подобной ABL, но с аномальными трансформирующими свойствами.
Описано 358 химерных, формируемых 337 различными генами. Химерные гены определены практически во всех типах злокачественных опухолей (Mitelman et al., 2007). В злокачественных опухолях кроветворной системы встречается почти 75% химерных генов. При остром миелоидном лейкозе описано 267 химерных генов, при остром лимфобластном лейкозе – 155, в солидных опухолях – только 75. Для каждого типа заболевания характерны определённые перестройки, им соответствует определенная клиническая картина. Зачастую транслокации позволяют поставить точный диагноз, подобрать лечение и прогнозировать течение заболевания.
Химерные гены могут провоцировать развитие опухоли определённого гистогенетического типа. Образующийся в результате транслокации t(12;15)(p13;q25) химерный ген ETV6-NTRK3 вызывает ОМЛ, мезобластную нефрому, фибросаркому, аденокарциному молочной железы.
Молекулярная цитогенетика, в частности, многоцветная флуоресцентная гибридизация in situ, SKY и сравнительная геномная гибридизация позволяют осуществлять поиск новых химерных генов. Методы ОТ-ПЦР (обратная транскрипция мРНК-ПЦР) или прямого секвенирования позволяют диагностировать химерные гены, характерные для определённой опухоли.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Что такое химерный ген
Метод молекулярно-генетической диагностики хронического миелолейкоза, позволяющий выявить в генетическом материале клеток крови или костного мозга мутантный ген, продукт деятельности которого играет ключевую роль в развитии этого заболевания.
Исследование клеток крови методом FISH (t (9; 22)/BCR/ABL), FISH анализ транслокации t(9;22) BCR-ABL.
BCR/ABL1 Translocation (9;22), FISH; Philadelphia Chromosome, BCR-ABL1 Fusion.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Наличие филадельфийской хромосомы исследуют в клетках периферической крови или костного мозга. При использовании крови её взятие производят обычным способом – посредством пункции вены и набора необходимого количества крови в вакутейнер. Взятие костного мозга проходит под местной анестезией, поэтому, если имеется аллергия на какой-либо местный анестетик, необходимо обязательно сообщить об этом доктору. После наступления анестезии врач специальной иглой производит пункцию кости (обычно из грудины или гребней подвздошных костей), шприцем аспирирует костный мозг и перемещает его в пробирку. Несмотря на анестезию, непосредственно в момент аспирации могут возникать болевые ощущения из-за перепада давления в полости кости. После манипуляции на место пункции накладывают асептическую повязку.
Стандартным методом для обнаружения описанной хромосомной аномалии является цитогенетическое исследование клеток костного мозга, однако оно не всегда позволяет выявить филадельфийскую хромосому, и в таких случаях рекомендуется более чувствительный анализ – FISH. Флюоресцентная in-situ гибридизация является молекулярно-генетическим исследованием, которое позволяет выявить в генетическом материале анализируемых клеток последовательность нуклеотидов, характерную для химерного гена BCR-ABL. Для этого применяются специальные последовательности ДНК, аналогичные участкам нормальных генов ABL и BCR, меченные флюоресцирующими веществами разных цветов – ДНК-зонды. В процессе анализа под воздействием высокой температуры и химических веществ двухцепочечные молекулы ДНК разделяются на отдельные цепи. Следующим этапом происходит гибридизация – соединение цепочек зондов с подходящими участками на клеточной ДНК. Результат гибридизации врач оценивает с помощью флюоресцентного микроскопа, который позволяет увидеть свечение, испускаемое присоединившимися к нативной ДНК зондами. При отсутствии транслокации каждый зонд присоединится к своей хромосоме и в микроскоп будут видны два разных и удаленных друг от друга свечения. Химерный ген BCR-ABL на 22-й хромосоме присоединит к себе оба зонда, и в микроскопе свечение будет исходить из одной точки, а его цвет поменяется на соответствующий комбинации двух исходных.
Для чего используется исследование?
Когда назначается исследование?
При отсутствии филадельфийской хромосомы по данным стандартного цитогенетического исследования или его недоступности:
Дифференциально-диагностические критерии уровней ответа на терапию ингибиторами тирозинкиназ, а также их интерпретация в качестве оптимального результата или неудачи лечения рассматриваются по утвержденным единым международным рекомендациям.
Что означают результаты?
Помимо исследования наличия BCR-ABL в анализируемом материале, при обнаружении химерного гена указывается, в какой доле проанализированных клеток он выявлен, исходя из чего определяется уровень достигнутого ответа (однако необходим анализ не менее 200 ядер):
Частичный и полный цитогенетические ответы соответствуют выраженному снижению Ph-позитивных клеток и определяются как большой цитогенетический ответ.
Что может влиять на результат?
Нарушения в проведении отдельных этапов исследования, опыт и квалификация врача молекулярно-генетической диагностики.
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
Морфологическое исследование трепанобиоптата костного мозга
Мочевая кислота в сыворотке
Лактатдегидрогеназа (ЛДГ) общая
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
NCCN Clinical Practice Guidelines in Oncology: Chronic Myeloid Leukemia. Version 4.2018 – January 24, 2018. Available at www.nccn.org.
Что такое химерный ген
Этиология и встречаемость хронического миелоидного лейкоза (ХМЛ). Хронический миелоидный лейкоз (ХМЛ) (MIM №608232) — клональная экспансия трансформированных кроветворных клеток-предшественниц, при которой возрастает число циркулирующих миелоидных клеток. Трансформация клеток-предшественниц происходит за счет экспрессии онкогена BCR-ABL.
Хронический миелоидный лейкоз (ХМЛ) составляет до 15% всех случаев лейкоза у взрослых и встречается с частотой 1-2 на 100 000; скорректированная возрастная встречаемость более высокая среди мужчин, чем среди женщин (1,3-1,7 против 1,0).
Патогенез хронического миелоидного лейкоза (ХМЛ)
Приблизительно 95% пациентов с хроническим миелоидным лейкозом (ХМЛ) имеют филадельфийскую хромосому; остальные — сложные варианты транслокаций. Протоонкоген Абельсона (ABL), кодирующий нерецепторную тирозинкиназу, находится в сегменте 9q34, а ген точечного разрыва кластерного региона (BCR), кодирующий фосфопротеин, — в 22qll.
При образовании филадельфийской хромосомы ген ABL разрывается в интроне 1, а ген BCR в одном из трех кластерных регионов разрыва; в производной хромосоме 22 фрагменты генов BCR и ABL соединяются «голова в хвост». Объединенный ген BCR-ABL в транслоцированной хромосоме 22 генерирует белок, изменяющийся по величине в зависимости от длины пептида Bcr, присоединяющегося к N-концу.
До настоящего времени функции белков Abl и Bcr в норме окончательно не определены. Белок Abl довольно хорошо сохраняется в ходе эволюции многоклеточных. Он присутствует как в ядре, так и в цитоплазме и связан с внутренней цитоплазматической мембраной. Относительное количество белка Abl в этих частях клетки изменяется в различных типах клеток, а также в ответ на стимулы.
Abl участвует в клеточном цикле, ответе на стресс, передаче сигналов от интегринов и в нервном развитии. Функциональные области Bcr включают двойную спираль для полимеризации с другими белками, область треонин-серин-киназы, область обмена ГДФ-ГТФ, вовлеченную в регуляцию белков семейства Ras, и область активации ГТФ, участвующую в регуляции Rac и Rho ГТФаз.
Экспрессия Abl не приводит к трансформации клеток, вызываемой экспрессией химерного белка Bcr-Abl. У трансгенных мышей, вырабатывающих химерный Bcr-Abl с рождения, развивается острый лейкоз, а инфицирование здоровых мышей ретровирусами, экспрессирующими Bcr-Abl, вызывает ряд острых и хронических лейкозов, в зависимости от генетического фона.
В отличие от белка Abl, химерный белок Bcr-Abl имеет активность конститутивной тирозинкиназы и ограничен цитоплазмой, где энергично связывает микрофибриллы актина. Bcr-Abl фосфорилирует несколько цитоплазматических субстратов и тем самым активизирует сигнальные каскады, управляющие ростом, дифференцировкой и, возможно, адгезией кроветворных клеток.
Неправильная активизация этого сигнального пути приводит к неуправляемому распространению гемопоэтических стволовых клеток, выходу незрелых клеток из костного мозга, и, в конце концов, к хроническому миелоидному лейкозу (ХМЛ).
По мере развития хронического миелоидного лейкоза (ХМЛ) становится все более агрессивным. В ходе этой эволюции клетки опухоли у 50-80% пациентов приобретают дополнительные хромосомные изменения [трисомию 8,i(17q), или трисомию 19], вторую филадельфийскую хромосому. Кроме описанных цитогенетических изменений, при развитии хронического миелоидного лейкоза (ХМЛ) также часто мутируют гены-супрессоры опухолевого роста и протоонкогены.
Фенотип и развитие хронического миелоидного лейкоза (ХМЛ)
Хронический миелоидный лейкоз (ХМЛ) — двух- или трехфазная болезнь. Начальный, или хронический этап характеризуется незаметно подкрадывающимся началом с постепенным развитием усталости, недомогания, потери массы тела и минимальным или умеренным увеличением селезенки. Со временем хронический миелоидный лейкоз (ХМЛ) обычно переходит в фазу акселерации и затем в бластный криз, хотя некоторые пациенты переходят непосредственно от хронической фазы в бластный криз.
Развитие хронического миелоидного лейкоза (ХМЛ) включает появление дополнительных хромосомных аномалий в клетках опухоли, прогрессирующего лейкоцитоза, анемии, тромбоцитоза или тромбоцитопении, всевозрастающую спленомегалию, лихорадку и костные нарушения. Властный криз — состояние острого лейкоза, бласты могут быть миелоидными, лимфоидными, эритроидными или недифференцированными. Фаза акселерации — промежуточная между хронической фазой и бластным кризом.
Приблизительно 85% больных диагностируют в хронической фазе. В зависимости от метода исследования, средний возраст постановки диагноза колеблется от 45 до 65 лет, хотя заболеванию подвержены лица любых возрастов. При отсутствии лечения показатель перехода из хронической фазы в бластный криз составляет приблизительно 5-10% в первые 2 года и затем 20% за год. Поскольку бластный криз быстро приводит к летальному исходу, развитие криза равнозначно смерти.
Особенности фенотипических проявлений хронического миелоидного лейкоза (ХМЛ):
• Возраст начала: от середины до конца зрелости
• Лейкоцитоз
• Спленомегалия
• Усталость и недомогание
Лечение хронического миелоидного лейкоза (ХМЛ)
Выяснение молекулярной основы хронического миелоидного лейкоза (ХМЛ) привело к разработке специфического ингибитора тирозинкиназы Bcr-Abl — иматиниба (гливек). Теперь это лекарство — основной препарат при лечении хронического миелоидного лейкоза (ХМЛ). Более 85% больных дают четкий цитогенетический ответ на терапию иматинибом, с исчезновением t(9;22) в клетках, получаемых при пункции костного мозга.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое химерный ген
Хронический миелоидный лейкоз (ХМЛ) — клональное новообразование, развивающееся из стволовых кроветворных клеток. Это первая опухоль человека, при которой был обнаружен характерный хромосомный маркер. Открытие сделано в 1960 г. американскими исследователями Р. С. Nowell и D. A. Hungerford в Филадельфии, поэтому маркер был назван филадельфийской (Ph)-хромосомой. Именно с этой находки началась клиническая цитогенетика в онкологии.
Филадельфийская хромосома — укороченная хромосома из группы так называемых малых акроцентриков. В каждой нормальной женской клетке эта группа включает две пары хромосом — 21-ю и 22-ю, а в мужских клетках таких хромосом не 4, а 5, поскольку в эту группу, кроме 21-й и 22-й хромосомных пар, включена также Y-хромосома.
Ph-хромосома выявляется при обычной окраске (без G-бендинга) практически у всех больных хроническим миелоидным лейкозом (95—98 %). На дифференциально окрашенных (бендинг) хромосомах видно, что укорочена одна из хромосом 22-й пары.
Примерно у 90 % больных Ph-хромосома видна во всех анализируемых метафазах, у остальных пациентов обнаруживают как клетки с Ph-хромосомой, так и нормальные клетки, причем в отдельных случаях Ph-хромосома регистрируется в меньшинстве клеток костного мозга. Транслокация (9;22) наблюдается в миелоидных клетках, эритробластах, В-и Т-лимфоцитах, мегакариоцитах. Этот факт свидетельствует о том, что заболевание начинается с некоммитированной клетки-предшественницы гемопоэза.
В 1973 г. знаменитым американским исследователем J. D. Rowley было установлено, что Ph-хромосома образуется не вследствие делеции хромосомы 22, как предполагали ранее, а в результате сбалансированной транслокации между хромосомами 9 и 22 (участками 9q34 и 22qll), при этом формируются две маркерные хромосомы, обозначаемые как 9q+ и 22q- (Ph). Изредка наблюдаются перестройки, скрывающие укороченную хромосому 22, — так называемая замаскированная Ph-хромосома, т. е. маленький фрагментик, оторвавшийся от любой другой хромосомы, может «прилепиться» к обломанной хромосоме 22 и «замаскировать» поломку. Эта «маскировка» довольно легко раскрывается при дифференциальной окраске.
Примерно в 10 % случаев наблюдаются атипичные транслокации, при которых стандартное цитогенетическое исследование позволяет увидеть перенос фрагмента хромосомы 22 не на 9-ю, а на какую-либо другую хромосому. Кроме того, иногда при хроническом миелоидном лейкозе обнаруживают сложные Ph-транслокации с участием не двух (9-й и 22-й), а трех или более хромосом.
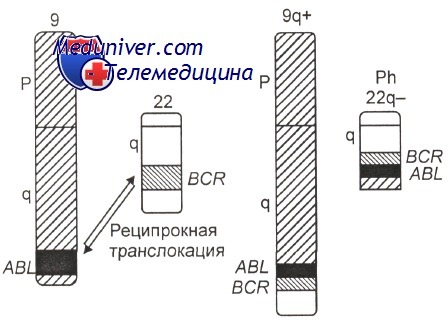
Установлено, что практически при всех Ph-транслокациях участвуют хромосомы 9 и 22, однако это не всегда видно при стандартном цитогенетическом исследовании, но обнаруживается при использовании FISH и ПЦР.
Большинство исследователей считают, что тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Использование молекулярно-генетических методов позволило установить, что в хромосоме 9 разрыв проходит через ген (протоонкоген) ABL, идентифицированный ранее в одном из вирусов лейкоза у мышей. В хромосоме 22 наблюдается разрыв гена ВСЯ. В результате слияния фрагментов названных генов (ABL и BCR) образуется химерный ген BCR-ABL, расположенный, как правило, на делетированной хромосоме 22 (Ph-хромосома) Схематическое изображение молекулярно-генетических событий, приводящих к развитию хронического миелоидного лейкоза, показано на рисунке.
Примерно в 70 % случаев, кроме транскрипта BCR-ABL, обнаруживают продукт (транскрипт) другого химерного гена, образующегося в результате t(9;22) —ABL-BCR на der (9), однако его роль в развитии хронического миелолейкоза неясна.
Установлен еще один важный факт: примерно у 20—25 % больных хроническим миелолейкозом имеется делеция в маркерной хромосоме 9q+. Эта аномалия не видна при «простом хромосомном анализе». Ее можно обнаружить только при использовании FISH со специально разработанными зондами. Размер делеции варьирует от пациента к пациенту: делетированный участок может включать последовательности гена BCR, перенесенные на хромосому 9 с хромосомы 22, последовательности самой хромосомы 9 или последовательности обеих этих хромосом.
Установлено, что делеция возникает одновременно с формированием специфической t(9;22), ее частота одинакова в группах больных, обследованных на разных стадиях хронического миелолейкоза. Независимо от метода лечения (даже при использовании программ, включающих гливек) прогноз у больных с интерстициальной делецией в маркере 9q+ существенно хуже, чем у больных без этой аномалии. Длительность хронической фазы и соответственно выживаемость у больных с делецией значительно меньше. Так, при обследовании большой группы больных (241) обнаружено, что медиана выживаемости была 38 мес для больных с делецией (39 человек) и 88 мес для группы больных без делеции (202 человека). Различия статистически значимы.
Применение этого информативного прогностического метода пока, к сожалению, не вошло в широкую клиническую практику, поскольку он весьма сложен и требует дорогостоящих реактивов и оборудования.
Роль делеции маркера 9q+ в прогрессии хронического миелолейкоза пока до конца не выяснена. Выпадение кодирующих последовательностей генов ABL и/или BCR в результате делеции приводит к тому, что экспрессируется только один химерный ген BCR-ABL, но нет экспрессии гена ABL-BCR. Возможно, и это событие играет роль в профессии лейкоза. Обсуждается также возможность инактивации неизвестных пока генов-супрессоров, локализованных в хромосомном районе, который делетируется.
Химерный ген BCR-ABL кодирует белок с мол. м. 210 000, обладающий более высокой протеинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с высокой протеинкиназной активностью. В эксперименте проводили вырезание гена gag/abl, после этого вирус терял способность вызывать лейкоз у мышей.
Изучение разрывов в генах ABL и BCR при хроническом миелолейкозе показало, что у разных больных их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика —до 200 kb, а в гене BCR разрывы локализуются обычно на маленьком участке — 8,5 kb, т. е. имеется кластер разрывов, отсюда название самого гена BCR (breakpoint cluster region).
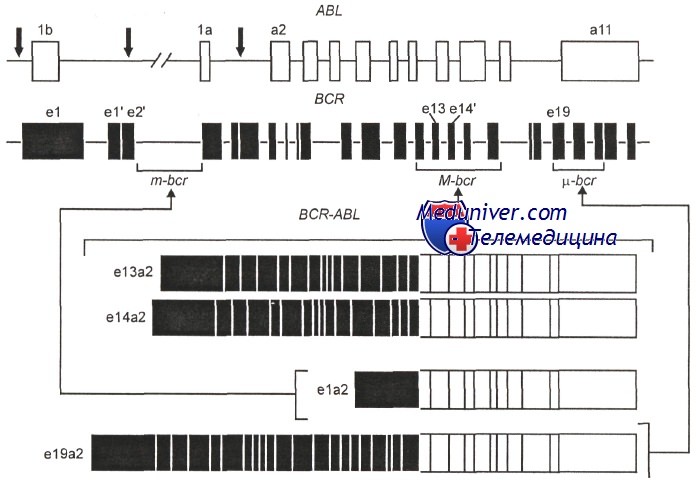
Первый ряд — разрывы в гене ABL; второй ряд — три кластера разрывов в гене BCR: m-BCR, М-BCR и u-BCR. Ниже три типа транскриптов химерных генов BCR-ABL, различающихся по длине вошедших участков гена BCR
В подавляющем большинстве случаев t(9;22) разрывы гена BCR обнаруживают на участке, обозначаемом M-BCR, при этом химерный ген включает длинный фрагмент гена BCR и в результате возникает характерный для хронического миелолейкоза белок P210Bcr/Abl. Кроме того, при t(9;22) разрывы в гене BCR могут локализоваться на одном из двух других типичных участков, называемых m-bcr и u-bcr. Разрывы в области m-bcr приводят к образованию химерного белка Р190Bcr/Abl, т. е. белка меньшей величины, чем Р210Bcr/Abl. При локализации разрывов в u-bcr образуется более крупный белок Р230Bcr/Abl.
Эти молекулярные различия не строго коррелируют с клиническими особенностями лейкозов. Так, Р190Bcr/Abl характерен для двух абсолютно разных лейкозов: с одной стороны, это Ph-позитивный острый лимфобластный лейкоз, а с другой — хронический гранулоцитарный лейкоз с выраженным моноцитозом и миелодиспластическими чертами. При обнаружении Р230Bcr/Abl обычно наблюдается картина так называемого нейтрофильного варианта хронического миелолейкоза, т. е. хронический миелолейкоз, при котором формула крови представлена зрелыми нейтрофилами и единичными метамиелоцитами. Кроме того, название «нейтрофильный гранулоцитарный лейкоз» используется на протяжении многих лет для обозначения Ph(BCR-ABL)-негативного хронического миелолейкоза — относительно доброкачественного варианта, наблюдаемого у пожилых людей, но редко встречающегося и у подростков.
Как отмечалось, коррелятивная связь между типом химерного белка (P190Bcr/Abl, Р210Bcr/Abl или Р230Bcr/Abl) и клинико-гематологичесой картиной лейкоза не является строгой. Любой из этих белков может быть обнаружен при классической картине хронического миелолейкоза. Есть также сообщения о нередком сочетании двух типов белков (Р210Bcr/Abl| и Р190Bcr/Abl) при типичном хроническом миелолейкозе и при остром лимфобластном лейкозе.
Реальная частота «атипичных» белков BCR-ABL при типичном хроническом миелолейкзе неизвестна, поскольку исследования на большом материале не проводились.
Решающая роль гена BCR-ABL и его продукта — белка Р210 в развитии хронического миелолейкоза продемонстрирована на разных модельных системах in vivo и in vitro. Так, трансдукция bcr/abl в стволовые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным животным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелолейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой тирозинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в злокачественной трансформации клеток.
При введении клеток, экспрессирующих р210Bcr/Abl, группе летально облученных мышей в условиях одного и того же эксперимента у одних животных развивался лейкоз, очень похожий на хронический миелолейкоз человека, а у других — самые разнообразные новообразования из гемопоэтических клеток: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные саркомы и эритроидные опухоли. Причина различий не выяснена. Эти опыты, как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины хронического миелолейкоза, пока еще не установлена.
В самом обобщенном виде «молекулярный патогенез» хронический миелолейкоз описывают так: химерный ген BCR-ABL кодирует белок с постоянно активированной тирозинкиназной активностью; это в свою очередь приводит к активации множества сигнальных путей и выраженным изменениям клеточного цикла, адгезии и апоптоза. Считают, что этих событий достаточно для инициации злокачественной трансформации клетки и поддержания опухолевого фенотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выявление и количественное определение мРНК химерного гена bcr-abl (р210) в Москве
Лабораторный анализ основного маркера хронического миелоидного лейкоза.
Приём и исследование биоматериала
Когда нужно сдавать анализ Выявление и количественное определение мРНК химерного гена bcr-abl (р210)?
Подробное описание исследования
Хронический миелоидный лейкоз (ХМЛ), или миелолейкоз, — клональное онкогенетическое заболевание, которое происходит из мутировавших злокачественных кроветворных — миелоидных — клеток костного мозга. На данный момент причины, по которым развивается миелолейкоз, не установлены. К факторам риска в основном относят инфекционные заболевания и радиационное облучение.
Для хронического миелоидного лейкоза характерны:
Ph, или филадельфийская хромосома, — это аномальная хромосома, которая возникает при обмене участков 9 и 22 хромосом. Данный обмен называют транслокацией, в результате неё возникает химерный онкоген BCR-ABL, который приводит к бесконтрольному росту клеток миелоидной линии (нейтрофилов, эозинофилов, базофилов и моноцитов). В норме избыточное кроветворение блокируется специфическими сигналами, однако аномальный белок BCR-ABL не воспринимает их. Со временем опухолевая масса вытесняет нормальные клетки кровяного ростка костного мозга.
При обмене участков 9 и 22 хромосом в местах обмена образуются разрывы. В зависимости от места разрыва могут быть разные транскрипты — генетические материалы в виде молекулы РНК — BCR-ABL. Основной транскрипт (мРНК) этого гена — p210. Данное исследование направлено на количественное определение именного этого варианта транскрипта BCR-ABL.
Клиническая картина хронического миелоидного лейкоза протекает в три фазы: хроническая, фаза акселерации и бластный криз. Заболевание начинается бессимптомно, затем появляется интоксикация и характерный синдром — гепатоспленомегалия (увеличение размеров печени и селезенки). В этот период в крови можно обнаружить избыточный уровень лейкоцитов. По мере прогрессирования болезни объем селезенки увеличивается в несколько раз, в крови выявляется анемия и низкий показатель тромбоцитов, а также появляются бластные клетки. Клинически у пациентов могут быть следующие симптомы:
Диагноз хронический миелолейкоз устанавливают при помощи полимеразной цепной реакции (ПЦР), который количественно определяет мРНК BCR-ABL p210. Помимо этого, данный метод используют у пациентов с выявленным ХМЛ для оценки эффективности получаемого лечения, проводимого в основном таргетными препаратами — ингибиторами BCR/ABL тирозинкиназы.