Что такое химерный белок
Химерные белки
Стабильность продукта экспрессии гена-интереса в хозяйской клетке также программируют на стадии конструирования рекомбинантной ДНК. Один из способов защиты продуктов экспрессии чужеродных генов (белков) от деградации в хозяйских клетках – ковалентное присоединение продукта клонированного гена к какому-либо стабильному белку хозяина. Подобная конструкция получила название “химерный белок” или “слитый белок”. Слияние белков программируется на уровне ДНК лигированием кодирующих участков соответствующих генов. При этом следует помнить о рамке считывания, поскольку теоретически нуклеотидная последовательность мРНК в процессе трансляции может быть декодирована с помощью любой из трех различных рамок считывания, причем образующиеся полипептидные цепи будут в этих трех случаях совершенно разными.
В зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, что встречается нечасто.
Для удаления балластной (хозяйской) белковой последовательности из химерного белка на уровне ДНК программируют введение сайтов узнавания для протеаз. Олигонуклеотидные линкеры, несущие такие сайты, можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, последовательность нуклеотидов, кодирующая олигопептид Ile-Glu-Gly-Arg, узнаваемый фактором крови Ха, который является специфической протеинкиназой (рис. 57).
Рис. 57. Пример встраивания в рекомбинантную ДНК линкерной последовательности, кодирующей внутри слитого белка сайт, узнаваемый специфической протеинкиназой
Создание подобных химерных конструкций широко используется также для контроля за уровнем экспрессии вводимого гена и для определения места локализации его продукта в клетке-хозяине. В этом случае последовательности гена-мишени сливают с генами, которые кодируют нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. Они получили название – репортерные гены.
Репортерные гены. Чаще всего в качестве репортерных используют гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT) и др.
Особые свойства белка GFP, а именно его способность флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ, обусловлены самой структурой его молекулы и не требуют субстратов или кофакторов.
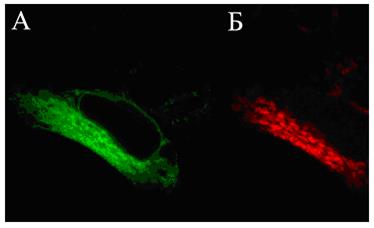
Рис. 58. Клетки линии НЕК-293, трансфецированные плазмидными ДНК, которые содержат репортерные гены зеленого (А) и красного (Б) флюоресцирующих белков
Фотографии сделаны на лазерном сканирующем конфокальном микроскопе “Leica SP2” (увеличение в 400 раз).
Область применения репортерных генов включает контроль переноса и экспрессии чужеродных генов, а также временные и пространственные особенности экспрессии данного конкретного гена, как чужеродного клетке-реципиенту, так и ее собственного
Другие области применения “химерных белков”
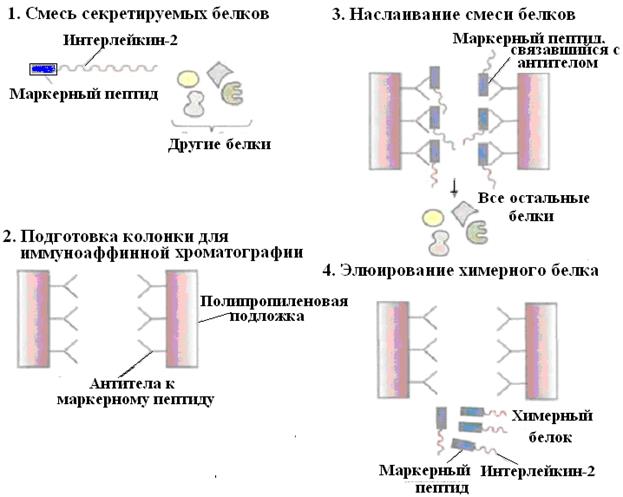
Методический прием создания конструкции ДНК с программируемым синтезом продукта в составе химерного белка используют также и для упрощения процедуры очистки рекомбинантного белка. Например, плазмидная конструкция для клеток S.cerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Tyr-Lys-Asp-Asp-Asp-Asp–Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Химерный белок, образующийся после экспрессии этой конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии (рис. 59).
Рис. 59. Очистка химерного белка с помощью иммуноаффинной хроматографии.
Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
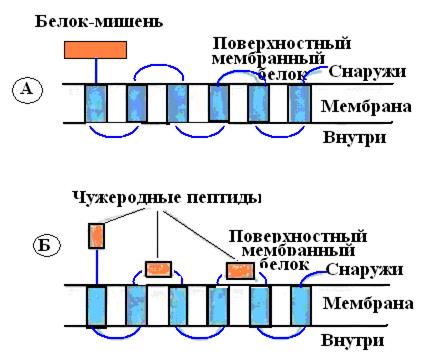
Для скрининга обширных (до 5х10 клонов) библиотек комплементарные ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обычно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например М13), или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов, где их идентифицируют иммунологически (рис. 60).
Рис. 60. Химерные белки, состоящие из поверхностного бактериального белка и чужеродного белка- мишени, присоединенного к его N- или С-концу (А) либо включенного в экспонируемые участки молекулы (Б)
Химерный белок
Смотреть что такое «Химерный белок» в других словарях:
химерный белок — Фьюжн белок, синтезируется на рибосомах в результате транскрипции/трансляции химерной ДНК [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN chimeric protein … Справочник технического переводчика
Гибридный белок — (англ. fusion protein, также химерный, составной белок) белок, полученный объединением двух или более генов, изначально кодировавших отдельные белки. Трансляция гибридного гена приводит к синтезу белка, который может сочетать некоторые … Википедия
составной белок — fused protein составной белок. Гибридный (химерный) полипептид, образуется в результате экспрессии рекомбинантной молекулы ДНК, в которой соединены друг с другом в одной рамке считывания кодирующие участки двух или нескольких разных генов;… … Молекулярная биология и генетика. Толковый словарь.
Составной белок — * састаўны бялок * fused protein or fusion p. гибридный (химерный) полипептид, который образуется в результате экспрессии рекомбинантной молекулы ДНК, включающей кодирующие участки двух или нескольких разных генов, соединенных в одной рамке… … Генетика. Энциклопедический словарь
ген-модификатор кроссинговера — * генмадыфікатар красінговера * crossing over modifier gene ген, изменяющий частоту рекомбинации (как в «своей» группе сцепления, так и в др. группах) и в ряде случаев не имеющий иных фенотипически роявлений. Ген мутантный * ген мутантны * mutant … Генетика. Энциклопедический словарь
ген селектируемый — * ген селекцыйны * selected gene ген, обеспечивающий клетке возможность выживания на определенной селективной среде, напр., в присутствии антибиотиков. Ген селектор * ген селектар * selector gene ген, контролирующий развитие отдельных блоков… … Генетика. Энциклопедический словарь
Псориаз — Псориатическое поражение спины и рук … Википедия
Белковая ловушка: как зеленые химеры «ловят» гены
Ася Хрущева, Наталья Дорогова, Светлана Федорова
«Природа» №8, 2018
Об авторах
Ася Сергеевна Хрущева — студентка магистратуры Новосибирского национального исследовательского государственного университета (НГУ). Занимается изучением деления соматических клеток, динамики цитоскелета.
Наталья Владимировна Дорогова — кандидат биологических наук, научный сотрудник сектора генетики клеточного цикла Федерального исследовательского центра «Институт цитологии и генетики» (ФИЦ ИЦиГ) СО РАН. Область научных интересов — визуализация внутриклеточных структур, митохондрии, программируемая клеточная гибель.
Светлана Александровна Фёдорова — кандидат биологических наук, заведующая сектором генетики клеточного цикла ФИЦ ИЦиГ СО РАН, старший преподаватель НГУ. Специалист в области биологии развития, исследует процессы формирования и функционирования гонад, взаимодействия генеративной и соматической тканей.
Ключевой механизм развития любого организма — динамическое изменение экспрессии его генов. Своевременное «включение» и «выключение» конкретных генов в определенных клетках вызывает их морфологические изменения, что проявляется во всем разнообразии живых организмов.
К настоящему времени разработано множество методов, позволяющих изучать экспрессию генов, измерять количество различных РНК в разных типах клеток, однако полное понимание функции гена невозможно без данных о пространственной и временной локализации его продукта. Частично эту проблему решает использование антител, которые специфично связываются с целевым белком, что позволяет определять его внутриклеточное местоположение или количество. Для использования антител необходимо иметь изучаемый белок или знать нуклеотидную последовательность кодирующего его гена, что не всегда возможно. Кроме того, антителами можно окрашивать только фиксированный материал, что существенно затрудняет анализ динамики распределения изучаемого белка.
Белковая ловушка

Рис. 1. Схема работы белковой ловушки (а) и ее модификаций (б, в). В ген внедряется искусственный мобильный элемент, содержащий белковую ловушку (зеленый участок — ДНК, кодирующая GFP; фиолетовые треугольники по краям — повторы от природного мобильного Р-элемента, которые необходимы для встраивания ловушки в геном). Зрелая матричная РНК данного гена включает в себя копию внедренной последовательности (зеленые участки). Продукт трансляции этой мРНК — соответствующий белок дикого типа (синий) с пришитой к нему флуоресцентной меткой (зеленая). При быстрой искусственной деградации целевых белков (б), содержащих GFP или любой другой флуоресцентный маркер, белковые Ub-метки связываются с GFP, после чего убиквитированный белок направляется в протеасому и деградирует (бледно-голубой с пунктирным контуром). При интерференции белковой ловушки IGFPi (в) двуцепочечные РНК (дцРНК, темно-зеленые), комплементарные последовательности gfp, связываются с матричной РНК, которая разрезается, вследствие чего белок не производится
Технология создания искусственных гибридных белков легла в основу современного метода белковой ловушки (дословный перевод с англ. — protein trap), который был разработан в 1996 г. для анализа локализации эндогенных (природных) белков [5]. Белковая ловушка содержит репортерный ген (как правило, gfp), который самостоятельно экспрессироваться не может. Этот искусственно созданный мобильный элемент запускают в ядро клетки, где он произвольно встраивается в геном. Если встройка произошла в межгенное пространство или в гены, которые кодируют РНК (например, гены рибосомной или транспортной РНК), или в ген в правильной ориентации, но со сдвигом кодона, то GFP будет «молчать» и эту линию мы в ходе анализа не заметим. Активация экспрессии gfp возможна только в случае встраивания генетического элемента в правильной ориентации (относительно начала гена) в ген, кодирующий белок, — отсюда и название «белковая ловушка» (рис. 1, а). Репортерный ген gfp в белковой ловушке не несет дополнительных последовательностей, регулирующих экспрессию, поэтому полученный химерный ген будет транскрибироваться в точности, как природный, т.е. его продукт будет нарабатываться на тех же стадиях и в тех же тканях. Так как ловушка — искусственная конструкция с полностью известной нуклеотидной последовательностью, можно относительно легко определить с точностью до нуклеотида, в какой именно ген произошла ее встройка, т.е. «поймать» при ее помощи гены с определенными особенностями экспрессии. Изучая локализацию химерных белков в клетках, можно вычленить гены, которые участвуют в каком-либо конкретном процессе (к примеру, определив белки, которые локализуются внутри митохондрий или на них, — получить список генов, продукты которых необходимы для поддержания структуры и функции митохондрий. Соответственно, белковую ловушку иногда называют ловушкой для генов.
Комбинирование флуоресцентного белка с изучаемым во многих случаях не приводит к изменению конформации и функции последнего, а свечение флуоресцентной «метки» позволяет определять его распределение в клетке. Гибридный GFP-белок от такого химерного гена в большинстве случаев будет иметь внутриклеточную локализацию, аналогичную природному. Полученный химерный белок и его внутриклеточное распределение можно изучать напрямую, по встроенной флуоресцентной метке (GFP), либо при помощи антител как к самому белку, так и к флуоресцентной метке. Таким образом, используя флуоресценцию, либо имея антитела только к GFP, можно изучить локализацию тысячи белков, поэтому метод белковой ловушки приобрел широкую популярность [3]. Кроме того, данный метод позволяет исследовать распределение гибридных белков непосредственно в живых клетках, что дает возможность не только наблюдать в реальном времени процессы, происходящие с участием GFP-гибридных молекул и их взаимодействие, но и использовать химерные белки в качестве различных внутриклеточных маркеров [3–6]. Применение таких гибридных маркеров позволяет изучать динамику процессов изменения морфологии и организации различных внутриклеточных структур в зависимости от стадии клеточного деления и дифференцировки [7]. В настоящее время получено множество модификаций белковых ловушек, содержащих различные флуоресцентные метки — YFP (от англ. yellow fluorescent protein — ‘желтый флуоресцентный белок’), Venus (модернизированный YFP), EYFP (от англ. enhanced yellow fluorescent protein — ‘усиленный желтый флуоресцентный белок’), RFP (от англ. red fluorescent protein — ‘красный флуоресцентный белок’) и др.
В некоторых случаях встраивание флуоресцентной метки все-таки изменяет конформацию нативного белка (например, если GFP нарушает целостность функционально значимого белкового домена) и получаемый химерный белок не обладает всеми функциями природного. Тем не менее, такой мутантный GFP-гибридный белок дает полную информацию о том, как экспрессия изучаемого гена зависит от ткани и стадии развития организма. Кроме того, остаются доступными инструменты исследования, разработанные на основе белковой ловушки: РНК-интерференция, FP-опосредованная деградация белков и т. д. Мутантный химерный белок не способен заменить природный, поэтому, наблюдая, как отражаются его дефекты на поведении других белков, органелл или клетки в целом, мы можем сделать выводы о функциях нативного белка. Иными словами, даже если встройка белковой ловушки окажется «неудачной», почти все преимущества данного метода сохраняются, а кроме того, мы дополнительно получаем мутацию гена, которую можем исследовать методами классической генетики.
Один из примеров использования белковой ловушки — визуализация мембран эндоплазматического ретикулума (ЭПР) с помощью гибридной формы дисульфид-изомеразы (Pdi, от англ. protein disulfide isomerase) — основного структурного белка ЭПР — и GFP-репортера. Химерный белок Pdi-GFP можно использовать для визуализации всех процессов, связанных с локализацией, перестройкой и метаболизмом ЭПР [12]. Например, в сперматогенезе дрозофилы происходят специфические изменения статуса ЭПР в зависимости от стадии клеточного деления и дифференцировки (рис. 2). Ретикулярная мембранная сеть, характерная для интерфазы (см. рис. 2, а), во время деления клеток замещается тубулярными мембранами, располагающимися между микротрубочками веретена (см. рис. 2, б). После мейоза, в самом начале дифференцировки спермиев, ЭПР окружает ядро и митохондрии, слившиеся в специфическую структуру, называемую небенкерном (см. рис. 2, в), затем, на стадии элонгации спермиев, ЭПР удлиняется согласованно с этими структурами (см. рис. 2, г). Окончание сперматогенеза характеризуется диссоциацией ЭПР на отдельные мембранные элементы и гранулы, которые удаляются из зрелых сперматозоидов (см. рис. 2, д).
Рис. 2. Визуализация динамики ЭПР (микрофотографии гибридного белка PdiGFP) на соответствующих стадиях сперматогенеза дрозофилы. Перед мейозом ЭПР равномерно распределена по цитоплазме (а), во время деления ретикулярная мембранная сеть замещается тубулярными мембранами, располагающимися между микротрубочками веретена (б). После мейоза начинается морфогенез сперматид (в). В это время ЭПР окружает ядро (на схеме слева выделено белым) и слившиеся в специфичную структуру митохондрии — небенкерн (показано черным). Во время роста хвостов сперматид (стадия элонгации) ЭПР удлиняется вместе с клеточной цитоплазмой (г), а во время индивидуализации и финального созревания сперматозоидов большая его часть будет удалена (д). На микрофотографиях синим светится хроматин, окрашенный DAPI, зеленым — белок GFP-Pdi. Длина масштабной линейки 10 мкм
С помощью GFP-гибридных мРНК-связывающих белков была выявлена пространственно-временная организация синтетических процессов в сперматогенезе дрозофилы [7]. Белки, участвующие в процессе созревания и локализации мРНК, разделились на три группы (рис. 3):

Рис. 3. Пространственно-временная организация синтетических процессов в сперматогенезе дрозофилы при помощи белков, участвующих в процессе созревания и локализации мРНК. Синий — хроматин, окрашенный DAPI, зеленый вверху слева — белок Rtc1-GFP, вверху справа — pAbp-GFP; внизу — Squid-GFP. Длина масштабной линейки 10 мкм
Распределение белков Squid и Hrb98DE в ядрах сперматоцитов морфологически сходно с распределением телец сплайсинга (splicing factor compartments). Белок RpL10Ab локализуется в цитоплазме; на стадии сперматоцита обнаруживается также гранула внутри ядра, с высокой вероятностью соответствующая ядрышковому организатору — области, где собираются субъединицы рибосомы. Белки Imp и Hrb98DE на стадии элонгации сперматид локализуются на особой структуре, которая отвечает за области наибольшей синтетической активности клеток на этой стадии развития.
Анализ места и стадий локализации гибридных белков помогает обнаруживать новые функции известных генов. Например, ранее считалось, что ген дрозофилы gilgamesh (gish), кодирующий синтез белка казеин-киназы-γ I, задействован только в дифференцировке глиальных клеток. Однако при изучении коллекции линий дрозофилы со встройками белковой ловушки мы установили, что эта протеинкиназа участвует также в метаболизме мембран во время сперматогенеза [13].
GFP-опосредованная РНК-интерференция
В результате встройки белковой ловушки в ген образуется матричная РНК, содержащая крайне специфичную последовательность gfp, которая не повторяется более ни в одном гене данного организма. На этом факте основан метод под названием «мишень-опосредованная потеря функции» (tagmediated loss-of-function), в котором в качестве мишени (тега) выступает РНК-последовательность gfp [14]. Если в клетку добавить малые двуцепочечные РНК, комплементарные участку gfp, то произойдет РНК-интерференция 4 (разрушение РНК), в результате чего перестанет нарабатываться продукт данного гена (см. рис. 1, в). Удобство проведения РНК-интерференции на основе белковой ловушки, названной IGFPi (от англ. in vivo GFP interference), состоит в том, что не требуются разработка и получение комплементарных малых РНК для каждого гена, который планируют «выключить», — достаточно использовать лишь РНК, комплементарную к gfp [15, [16]. Анализируя обширные коллекции организмов с GFP-белковыми ловушками, можно проводить интерференцию множества генов без создания дополнительных генетических конструкций.
Дополнительное преимущество использования интерференции на основе последовательности гена gfp из белковой ловушки — возможность определения эффективности самой РНК-интерференции. Обычно такие работы требуют проведения анализа количества РНК и белка в ткани, для которого необходимы антитела к исследуемому белку. Так как в случае белковой ловушки каждый гибридный белок содержит GFP-метку, можно одновременно оценивать интенсивность сигнала GFP в любой конкретной клетке или ткани, сравнивая линии с РНК-интерференцией против gfp и без, и делать выводы о проценте «выключения» гена, содержащего белковую ловушку [15].
Деградация FP-меченых белков
Белковая ловушка, содержащая любую флуоресцентную метку (FP), позволяет использовать антитела только к самой метке, не разрабатывая их к исследуемому белку. Это же преимущество было использовано для создания метода получения быстрой искусственной деградации целевых белков, содержащих GFP или любой другой флуоресцентный маркер (DeGradFP). Сконструированные белки, состоящие из фрагмента антител к GFP и лигазного домена белка SLMB дрозофилы, специфично узнают GFP и навешивают на такой химерный белок «цепочки» молекул убиквитина — Ub-метки (см. рис. 1, б) [17]. Их наличие служит сигналом для направления данного белка в протеасому и его последующей деградации. Система, регулирующая стабильность белков путем их убиквитинирования, эволюционно высококонсервативна, поэтому метод быстрой деградации GFP-меченых химерных белков работает в любых эукариотических клетках. Более того, Ub-метки подходят для других флуоресцентных ловушек, содержащих Venus, YFP, EYFP и т. д. Как и в случае РНК-интерференции, эффективность инактивации химерных белков через их деградацию можно оценивать по интенсивности их флуоресцентного сигнала. Во многих случаях это готовое к использованию решение, так как к настоящему времени существуют целые коллекции разных организмов с GFP-белковыми ловушками [17].
Модификации белковой ловушки iTRAC
В 2011 г. был разработан и описан новый подход — iTRAC (от англ. Integrase mediated trap conversion — ‘модификация интеграза-опосредованной ловушки’) [18]. Он позволяет адаптировать белковые ловушки, несущие специфические последовательности ДНК (сайты attP и attB), для различных целей с помощью относительно простой замены содержимого этих генетических конструкций, уже встроившихся в исследуемый ген (рис. 4). Данный подход основан на работе специального фермента (интегразы ϕС31), который катализирует рекомбинацию по attP и attB. После рекомбинации эти сайты изменяют свою нуклеотидную последовательность и перестают узнаваться интегразой, т.е. вторичный обмен происходить уже не может. Модифицированные ловушки содержат один или несколько сайтов attP, для замены содержимого такой ловушки используются вторичные конструкции, содержащие сайт(ы) attB. При активировании интегразы ϕС31 происходит рекомбинация участков ДНК между сайтами attР и attB, т.е. обмен содержимого ловушки и вторичной конструкции (см. рис. 4). Такой принцип обмена называется кассетным. Активировать интегразу ϕС31 можно повсеместно или только на интересующих нас стадиях развития или в отдельных клетках или органах, что существенно расширяет области ее применения. Например, внесение во вторичную ловушку стоп-кодона позволяет целенаправленно мутировать исследуемый ген и анализировать функции такого укороченного белка в конкретном типе клеток. А использование в первичной и вторичной ловушках флуоресцентных меток разного цвета — исследовать взаимодействие разных типов клеток в органах и тканях. Примером может служить ловушка, работающая на основе транспозона Minos, которая была разработана для визуализации физиологических процессов у разноногого рака Parhyale hawaiensis. Первичная ловушка содержала красный флуоресцентный маркер RFP, вторичная — зеленый GFP. Это позволило, ткане- или стадиеспецифически заменяя одну ловушку на другую, изучать различные системы органов данного организма, в частности проследить сердечную функцию, открытие и закрытие клапанов в деталях, которые ранее не были изучены [18].
Рис. 4. Схема работы iTRAC с двумя вариантами вторичных ловушек: содержащей красную флуоресцентную метку DsRED и содержащей стоп-кодон. Модифицированные белковые ловушки содержат по краям последовательности attP и attB (розовые). Интеграза ϕС31 катализирует рекомбинацию по сайтам attP и attB, и происходит обмен участками ДНК между сайтами attР и attB, т.е. содержимого ловушки, уже встроившейся в ген, и вторичной конструкции
Таким образом, первичная ловушка, содержащая последовательность attР, может быть реконструирована и использована вторично. Универсальность iTRAC позволяет использовать ее для самых различных целей: во-первых, для создания внутриклеточных маркеров для различных типов микроскопии; во-вторых, для внедрения систем, дающих возможность изменять экспрессию генов, используя вставку сильных терминаторов транскрипции; в-третьих, для введения в клетки генетических маркеров для определения различных типов клеток или для специфичного введения клеточного токсина только в клетки, содержащие первичную ловушку [18].
Данный подход универсален, так как интеграза работает во многих модельных организмах, включая дрозофилу, лягушек, мышей. Также для таких организмов уже существуют большие коллекции линий, содержащих ловушки, что позволяет разрабатывать и конструировать только вторичные конструкции, обмен материала с которыми требуется произвести.
Работа выполнена при поддержке Бюджетного проекта «Молекулярно-генетические основы регуляции экспрессии генов, морфологии, дифференцировки и перепрограммирования клеток» (проект 0324-2018-0019), а также Министерства образования и науки РФ по Программе повышения конкурентоспособности ведущих российских университетов среди ведущих мировых научно-образовательных центров (проект 5-100).
Литература
1. Shimomur O., Johnson F. H., Saiga Y. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea // J. Cell Comp. Physiol. 1962; 59(3): 223–239. DOI: 10.1002/jcp.1030590302.
2. Prasher D. C., Eckenrode V. K., Ward W. W. et al. Primary structure of the Aequorea victoria green-fluorescent protein // Gene. 1992; 111(2): 229–233. DOI: 1016/0378-1119(92)90691-H.
3. Степаненко О. В., Верхуша В. В., Кузнецова И. М. и др. Флуоресцентные белки: физико-химические свойства и использование в клеточной биологии // Цитология. 2007; 49(5): 395–420.
4. Wang S., Hazelrigg T. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis // Nature. 1994; 369: 400–403. DOI: 10.1038/369400a0.
5. Chudakov D. M., Matz M. V., Lukyanov S. A. et al. Fluorescent proteins and their applications in imaging living cells and tissues // Physiol. Rev. 2010; 90: 1103–1163. DOI: 10.1152/physrev.00038.2009.
6. Giepmans B., Adams S., Ellisman M. et al. The fluorescent toolbox for assessing protein location and function // Science. 2006; 312: 217–224. DOI: 10.1126/science.1124618.
7. Nerusheva O. O., Dorogova N. V., Omelyanchuk L. V. GFP markers for studying D. melanogaster spermatogenesis // Cent. Eur. J. Biol. 2009; 4(4): 452–460. DOI: 10.2478/s11535-009-0052-y.
8. Kelso R. J. Buszczak M., Quiсones A. T. et al. Flytrap, a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster // Nucleic. Acids. Res. 2004; 32(Database issue): D418–D420. DOI: 10.1093/nar/gkh014.
9. Morin X., Daneman R., Zavortink M. et al. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila // Proc. Natl. Acad. Sci. USA. 2001; 98(26): 15050e5. DOI: 10.1073/pnas.261408198.
10. Quiсones-Coello A. T., Petrella L. N., Ayers K. et al. Exploring strategies for protein trapping in Drosophila // Genetics. 2007; 175(3): 1089–1104. DOI: 10.1534/genetics.106.065995.
11. Buszczak M., Paterno S., Lighthouse D. et al. The carnegie protein trap library: a versatile tool for Drosophila developmental studies // Genetics. 2007; 175(3): 1505–1531. DOI: 10.1534/genetics.106.065961.
12. Дорогова Н. В., Нерушева О. О., Омельянчук Л. В. и др. Изучение структурной организации и динамики эндоплазматического ретикулума в сперматогенезе Drosophila melanogaster с помощью гибридного белка Pdi-GFP // Биологические мембраны. 2009; 26(1): 50–57.
13. Nerusheva O. O., Dorogova N. V. et al. A GFP trap study uncovers the functions of Gilgamesh protein kinase in Drosophila melanogaster spermatogenesis // Cell Biology International. 2009; 33(5): 586–593. DOI: 10.1016/j.cellbi.2009.02.009.
14. Neumüller R. A., Wirtz-Peitz F., Lee S. et al. Stringent analysis of gene function and protein — protein interactions using fluorescently tagged genes // Genetics. 2012; 190(3): 931–940. DOI: 10.1534/genetics.111.136465.
15. Roignant J. Y., Carré C., Mugat B. et al. Absence of transitive and systemic pathways allows cell-specific and isoform-specific RNAi in Drosophila // RNA. 2003; 9(3): 299–308. DOI: 10.1261/rna.2154103.
16. Pastor-Pareja J. C., Xu Т. Shaping cells and organs in Drosophila by opposing roles of fat body-secreted collagen IV and perlecan // Dev. Cell. 2011; 21(2): 245–256. DOI: 10.1016/j.devcel.2011.06.026.
17. Caussinus E., Kanca O., Affolter M. Fluorescent fusion protein knockout mediated by anti-GFP nanobody // Nat. Struct. Mol. Biol. 2011; 19: 117–121. DOI: 10.1038/nsmb.2180.
18. Kontarakis Z., Pavlopoulos A., Kiupakis A. et al. A versatile strategy for gene trapping and trap conversion in emerging model organisms // Development. 2011; 138(12): 2625–2630. DOI: 10.1242/dev.066324.
1 Подробнее см.: Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Свет и цвет живых организмов: флуоресцирующие и цветные белки // Природа. 2003. № 3. С. 33–43.
2 Подробнее см.: Чудов С. В. Лауреаты Нобелевской премии 2008 года по химии — О. Симомура, М. Чалфи, Р. Цянь // Природа. 2009. № 1. С. 123–124.
4 Про явление РНК-интерференции — процесс подавления экспрессии гена при помощи малых молекул РНК — подробнее см.: Кленов М. С. Лауреаты Нобелевской премии 2008 года по физиологии или медицине — Э. Файер и К. Мэллоу // Природа. 2007. № 1. С. 76–79.