Что такое фосфорилирование в биологии
ФОСФОРИЛИРОВАНИЕ
замещение атома в молекуле орг. соед. на остаток фосфорной или к.-л. другой фосфорсодержащей к-ты либо их производного (кислого эфира и др.), напр.:
В широком смысле Ф. наз. замещение любого атома или группы атомов на остаток фосфорсодержащей к-ты или введение остатка такой к-ты в молекулу любыми др. способами.
Ф. обычно осуществляется по механизму бимол. нуклеоф. замещения ( N 2) у атома P. Как правило, переходное состояние имеет конформацию тригон. бипирамиды с атомом P в центре.
Фосфорилирующая способность соед. Р(Ш) обычно выше, чем соед. P(V). Так, хлориды Р(Ш) могут гомолитически фосфорилировать углеводороды в присут. окислителей при g-облучении. Известны примеры Ф. спиртов, аминов, тиолов с помощью соед. пятикоординац. P ( фосфоранов).
Замещение в молекуле атома H у атома С на группировку P(O)ClX (X = Cl, Alk, Ar, RO, R 2 N) осуществляют взаимод. орг. соед. с XPCl 2 и O 2 ( окислительное хлорфосфонирование).
Для избирательного Ф. полифункцион. соед. подбирают соответствующий фосфорилирующий агент или условия р-ции, напр.:
Иногда для избирательного Ф. осуществляют предварит. защиту функц. групп, не подлежащих Ф.
Ф. нек-рых важных ферментов приводит к их ингибирова-нию (потери ферментативной активности). Так, многие фос-форорг. соед. (напр., фторангидриды эфиров фосфоновых к-т, и-нитрофениловые эфиры к-т фосфора) способны фосфорилировать холинэстеразы (считают, что Ф. осуществляется по группе ОН остатка серина в активном центре), что приводит к блокаде нервно-мышечной передачи импульсов в вегетативной нервной системе (см. Ацетилхолинэстераза). Фундам. значение для жизнедеятельности всех живых организмов имеет Ф., осуществляемое при обмене в-в, к-рое катализируется ферментами группы фосфотрансфераз. Донорами фосфатной (реже пирофосфатной) группы обычно служат нуклеотиды, среди к-рых главную роль играет АТФ. Ресинтез АТФ в клетке осуществляется гл. обр. при окислительном фосфорилировании (в аэробных условиях), а также при фотосинтезе и гликолизе (в анаэробных условиях).
Ф. широко применяют для синтеза пестицидов, лек. ср-в, экстрагентов, пластификаторов, негорючих пропиток и др.
См. также Абрамова реакция, Арбузова реакция, Кабачника-Филдса реакция, Кирсанова реакция, Клея-Киннера-Перрена реакция, Михаэлиса-Беккера реакция, Перкова реакция, Пищи-муки реакция, Тодда-Атертона реакция, Хорнера реакция.
Лит.: Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ., M., 1982, с. 344-80; Hudson R., Green M., «Angew. Chem.», 1963, Bd 75, № 1, S. 47-56; Cox J., Ramsay О., «Chem. Rev.», 1964, v. 64, № 4, p. 317-52. Г. И. Дрозд.
Окислительное фосфорилирование
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий.
Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа:
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания.
Содержание
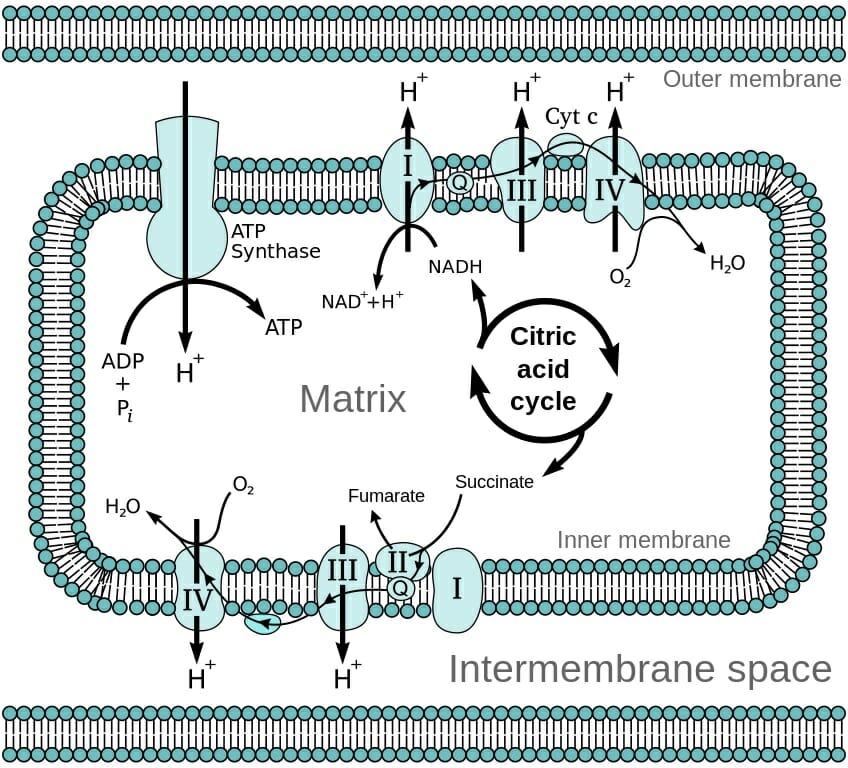
Работа АТФ-синтазы
Процесс окислительного фосфорилирования осуществляется пятым комплексом дыхательной цепи митохондрий — Протонная АТФ-синтаза, состоящая из 9 субъединиц 5 типов:
Суммарный выход
Для синтеза 1 молекулы АТФ необходимо 3 протона.
Ингибиторы окислительного фосфорилирования
Ингибиторы блокируют V комплекс:
Разобщители окислительного фосфорилирования
Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Полезное
Смотреть что такое «Окислительное фосфорилирование» в других словарях:
окислительное фосфорилирование — см. фосфорилирование окислительное. окислительные брожения – см. брожения окислительные. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — в биохимии образование аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной и фосфорной кислот за счет энергии, освобождающейся при окислении органических веществ в живых клетках. См. также Фосфорилирование … Большой Энциклопедический словарь
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной к ты (АТФ) из адеиозиндифосфорной (АДФ) и фосфорной к т за счёт энергии окисления молекул органич. веществ. Аккумулированная в АТФ энергия используется затем клеткой для… … Биологический энциклопедический словарь
окислительное фосфорилирование — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN oxidative phosphorylation … Справочник технического переводчика
окислительное фосфорилирование — (биохим.), образование аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной и фосфорной кислот за счёт энергии, освобождающейся при окислении органических веществ в живых клетках. См. также Фосфорилирование. * * * ОКИСЛИТЕЛЬНОЕ… … Энциклопедический словарь
окислительное фосфорилирование — oxidative phosphorylation окислительное фосфорилирование. Фосфорилирование основного биоэнергетического носителя (АДФ в АТФ), сопряженное с окислением низкомолекулярных соединений кислородом в дыхательной цепи; превращение АДФ в АТФ может… … Молекулярная биология и генетика. Толковый словарь.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в в в процессе клеточного дыхания. В общем виде О. ф. и его место в обмене в в можно представить схемой: АН 2… … Химическая энциклопедия
Окислительное фосфорилирование — осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления молекул органических веществ (субстратов). В результате О. ф. в клетках… … Большая советская энциклопедия
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — (биохим.), образование аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной и фосфорной к т за счёт энергии, освобождающейся при окислении органич. в в в живых клетках. См. также Фосфррилирование … Естествознание. Энциклопедический словарь
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ — образование АТФ за счет энергии переноса электронов с субстратов (напр., промежуточных продуктов цикла Кребса) на кислород … Словарь ботанических терминов
Окислительное фосфорилирование – определение и шаги OXPHOS
Определение окислительного фосфорилирования
Окислительное фосфорилирование, также известное как OXPHOS, относится к окислительно-восстановительным реакциям с участием потока электронов вдоль ряда мембраносвязанных белков в сочетании с образованием аденозинтрифосфата (АТФ).
Окислительное фосфорилирование является четвертым и последним этапом клеточное дыхание, Хотя дыхание можно представить как простое «сжигание» углеводов с образованием углекислого газа и воды, клетка не может позволить себе высвободить всю химическую энергию, накопленную в углеводах, за один шаг, так как это необратимо нарушит сложный баланс и гомеостаз из организм.
Уравнение представляет собой сжигание углеводов.
Вместо этого питательные вещества сначала перевариваются и усваиваются. Они подвергаются метаболизму в цитоплазма и их конечные продукты транспортируются в митохондрии, чтобы участвовать в цикле Креба, также известном как цикл лимонной кислоты. Здесь химическая энергия в органических молекулах постепенно высвобождается за счет поэтапного окисления до углекислого газа. Процесс также генерирует много электронов высокой энергии, которые используются специальными молекулами, называемыми электронными носителями. Наиболее распространенными электронными носителями, связанными с окислительным фосфорилированием, являются никотинамид-адениндинуклеотид (NAD +) и флавин-адениндинуклеотид (FAD). Когда NAD + и FAD принимают электроны, они становятся восстановителями (NADH и FADH2), которые способны переносить эти электроны в молекулы, которые имеют высокую аффинность к ним.
Окислительное фосфорилирование начинается с окисления NADH и FADH2. Энергия электронов, выделяемых этими двумя молекулами, поэтапно используется и используется для создания градиента протонов через внутреннюю мембрану митохондрий у эукариот. Этот протонный градиент затем стимулирует образование АТФ из АДФ, катализируемого ферментом АТФ-синтаза, Конечным акцептором этих высокоэнергетических электронов является кислород, и поэтому окислительное фосфорилирование генерирует как АТФ, так и воду.
АТФ как энергетическая валюта
АТФ имеет три фосфатные группы в непосредственной физической близости друг к другу. Дополнение каждого фосфатная группа должен быть связан с каким-то другим выделением энергии или Экзергоническая реакция, поскольку естественное отталкивание между отрицательно заряженными фосфатными группами необходимо преодолеть. Как только АТФ образуется, он становится готовым запасом энергии, потому что концевая фосфатная связь может быть быстро гидролизована, чтобы привести в действие какой-то другой процесс в клетке. Это заставляет АТФ вести себя как энергетическая валюта клетки.
Наличие АТФ позволяет клетке проводить дыхание, временно накапливать энергию в высокоэнергетических связях молекула и использовать его в разных местах и в разные моменты времени. Без АТФ каждая отдельная эндергоническая (требующая энергии) реакция должна была бы быть связана во времени и пространстве с окислением питательных веществ, что серьезно ограничивало бы сложность, возможную в живом организме.
Важность этой молекулы подчеркивается тем фактом, что АТФ обнаруживается во всех живых клетках, а АТФ-синтаза в значительной степени сохраняется в живом мире. Кроме того, любой процесс, который фундаментально прерывает образование этой молекулы, приводит к очень быстрой смерти.
Преобразование энергии
Первоначальный источник энергии для почти всей биосферы – ядерные реакции на Солнце. От растений и других автотрофов до одноклеточных простейшие одноклеточные организмы и для самых крупных млекопитающих энергия для поддержания жизни получается от солнца посредством ряда преобразований энергии.
В автотрофах солнечное излучение сначала используется для генерации электронов высокой энергии, которые затем используются для накачки протонов против их градиент концентрации создавая протонную движущую силу через мембрану. Потенциальная энергия в таком электрохимическом градиенте направляется на генерирование АТФ, что, в свою очередь, облегчает образование сложных макромолекул. Питательные вещества, создаваемые автотрофами, потребляются гетеротрофами, перевариваются и затем метаболизируются в своих клетках. Энергия химической связи в этих молекулах ведет себя как система хранения энергии, изначально полученной от Солнца. Когда питательные вещества окисляются, энергия связи высвобождается – как в виде АТФ, так и в виде электронов высокой энергии. В процессе, параллельном начальным реакциям внутри хлоропластов, эти электроны используются для постепенного создания электрохимического градиента, который снова приводит к образованию АТФ. АТФ многократно генерируется и используется для поддержания жизненных процессов организма.
Поэтому энергия Солнца преобразуется из одной формы в другую в виде энергии в электронах, потенциальной энергии в градиентах протонов и энергии связи макромолекул.
Строение Митохондрии
Говорят, что митохондрии произошли из древних бактерии которые стали эндосимбионтами в эукариотах, создавая первые ядросодержащие клетки, которые могут подвергаться аэробного дыхания, Структура митохондриальных мембран отражает это происхождение; эти органеллы имеют четкий геном, независимый белок перевод машины (тРНК рибосомы и связанные с ними белки) и комплексы дыхательных цепей, которые отражают аэробного дыхания в бактериях.
Митохондрии имеют две мембраны – внутреннюю и внешнюю мембраны – и внешняя мембрана структурно похожа на эукариотические плазматические мембраны. Однако они также содержат ряд трансмембранных каналов, называемых поринами. Самые крупные молекулы, способные свободно диффундировать через порины, имеют атомную массу около 6000 дальтон, что делает мембрану проницаемой для большинства малых молекул и белков. Внутренняя мембрана непроницаема почти для каждой молекулы, за исключением кислорода, углекислого газа и воды. Это свойство важно, потому что оно позволяет органеллы регулировать поток ионов и молекул через мембрану и использовать дифференциальную концентрацию этих веществ для формирования АТФ.
Внутренняя митохондриальная мембрана имеет ряд инвагинаций, называемых крист которые увеличивают его площадь поверхности. Белковые комплексы, участвующие в окислительно-восстановительных реакциях окислительного фосфорилирования, внедряются в кристы. Аналогично, АТФ-синтаза также присутствует в виде трансмембранного белка на кристах. Внутренняя митохондриальная мембрана заключает в себе богатую белком матрицу, которая получает пируват молекулы из цитоплазмы и содержит ферменты, которые генерируют ацетил коэнзим О. Матрица также является местом, где происходят реакции цикла лимонной кислоты. Матрица настолько плотная, что напоминает кристалл белка с концентрацией белка 500 мг / мл.
Непроницаемость внутренней митохондриальной мембраны для ионов позволяет ей поддерживать электрохимический потенциал 180 мВ, генерируемый, главным образом, путем откачки протонов из матрицы в межмембранное пространство. Это делает матрицу митохондрия слабощелочная, с рН около 8.
Электронная транспортная цепь
цепь переноса электронов В окислительном фосфорилировании участвуют четыре основных белковых комплекса (пронумерованных I, II, III и IV), каждый из которых имеет повышенные потенциалы восстановления. По сути, когда электрон движется от одного белкового комплекса к другому, он движется к молекулам, которые имеют большее сродство к электронам. Электрон теряет энергию в этом процессе, и эта энергия используется для накачки протонов в межмембранное пространство.
Между двумя электронными носителями NADH имеет более низкий восстановительный потенциал и высвобождает электроны в комплекс I. Комплекс I также известен как NADH: хиноноксидоредуктаза и способствует переносу электронов из NADH в белок, называемый убихинон. Этот огромный мембраносвязанный комплекс состоит из 46 полипептидных цепей и может сочетать прием двух электронов из НАДН с движением ионов 4 Н + из матрицы в межмембранное пространство. Каждый из этих четырех протонов прокачивается через отдельный выделенный канал.
С другой стороны, FADH2 отдает свои электроны через комплекс II, который также известен как сукцинатдегидрогеназа. Этот относительно небольшой комплекс состоит из четырех субъединиц и не способствует тандемному движению протонов через мембрану. Из четырех субъединиц две действуют как гидрофобный якоря к внутренней митохондриальной мембране. Третья субъединица имеет ковалентно связанную молекулу FAD. Четыре субъединицы вместе образуют убихинон-связывающий сайт. Комплекс II участвует как в цикле лимонной кислоты, так и в окислительном фосфорилировании. Следовательно, электроны становятся параллельным путем достижения пула хинонов, а ФАД получает высокоэнергетические электроны от продуктов метаболизма жирных кислот.
После этого электроны проходят через тот же путь и поступают в комплекс III через убихинон, который действует в качестве переносчика электронов внутри мембраны. Комплекс III также участвует в накачке ионов H + в межмембранное пространство. Из комплекса III другой мобильный носитель, называемый цитохром С, переносит электроны в комплекс IV. Комплекс IV действует как место для заключительного этапа в этих реакциях, включающих расщепление молекулы кислорода и образование воды. Вода является последним местом покоя для электронов, которые попали в систему через NADH и FADH2 и либо используются в метаболических путях клетки, либо выводятся из организма.
В конце цепи переноса электронов NAD + и FAD регенерируются и создается электрохимический градиент.
АТФ-синтаза и генерация АТФ
Внутренняя митохондриальная мембрана непроницаема для ионов и имеет один выделенный канал для потока протонов обратно в матрицу. Это мембраносвязанный фермент АТФ-синтаза. Он состоит из двух частей – регионов F0 и F1. F0 образует протонную пору и внедряется в мембрану. Когда протоны возвращаются обратно в матрицу из межмембранного пространства, каталитическая активность фермента использует потенциальную энергию, выделяемую из-за хемиосмос синтезировать АТФ из АДФ и Пи.
викторина
1. Какая из этих молекул обладает наибольшим восстановительным потенциалом?A. NADHB. FADH2C. Комплекс ID. Комплекс IV
Ответ на вопрос № 1
D верно. Электроны текут от молекул, которые имеют более низкий восстановительный потенциал, к тем, у кого более высокий восстановительный потенциал. Другими словами, они движутся к молекулам, которые имеют наибольшее сродство к ним. В то время как наибольшее сродство к электронам в цепи переноса электронов – молекулярный кислород, среди приведенных вариантов комплекс IV обладает самым высоким восстановительным потенциалом.
2. Где электроны, подаренные FADH2, попадают в цепь переноса электронов?A. Комплекс IB. убихинонC. Цитохром СD. Комплекс II
Ответ на вопрос № 2
D верно. Электроны из FADH2 попадают в цепь переноса электронов через комплекс II без протонирования какого-либо протона из матрицы. Затем электроны из комплекса I и II передаются мобильному электронному носителю внутри мембраны убихинону. Он действует в качестве челнока к комплексу III, который затем обеспечивает движение электронов к комплексу IV через цитохром С.
3. Что из этого является свойством внутренней митохондриальной мембраны?A. Непроницаемый для водыB. Непроницаемый для ионовC. Наличие пориновD. Все вышеперечисленное
Ответ на вопрос № 3
В верно. Внутренняя митохондриальная мембрана должна быть непроницаемой даже для самых маленьких ионов (протонов), чтобы выполнить важнейшую задачу по поддержанию электрохимического градиента, который может обеспечить генерацию АТФ. Однако она свободно проницаема для воды, кислорода и углекислого газа, поскольку диффузия из этих молекул имеет важное значение для функционирования биохимических реакций в матрице митохондрий. Порины – это большие каналы, которые позволяют широкому спектру частиц диффундировать. Следовательно, они обнаруживаются только во внешней мембране и могут полностью разрушить функционирование митохондрий, если обнаружатся на внутренней мембране.
Тканевое дыхание, окислительное фосфорилирование
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТКАНЕВОЕ ДЫХАНИЕ, ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Тканевое дыхание — процесс окисления водорода кислородом до воды ферментами дыхательной цепи. Как указывалось выше, процесс образования воды описывается уравнением:
Дыхательная цепь — последовательность переносчиков электронов на кислород, локализованная во внутренней мембране митохондрий (ВММ). Роль таких переносчиков выполняют:
Цель работы дыхательной цепи: провести реакцию окисления водорода кислородом с образованием эндогенной воды.
Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный акцептор — кислород; протоны выбрасываются в межмембранное пространство (ММП).
Место того или иного переносчика в дыхательной цепи определяется величиной редокс-потенциала. Все реакции в дыхательной цепи направлены по термодинамической лестнице от компонента с самым отрицательным редокс-потенциалом (НАДH·Н + ) к кислороду, имеющему самый положительный редокс-потенциал.
Редокс-потенциал (Ео) численно равен э. д. с. в вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура 25С). Чем отрицательнее редокс-потенциал системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
Перенос электронов по дыхательной цепи осуществляется в следующей последовательности:
Во внутренней митохондриальной мембране переносчики электронов и протонов сгруппированы в 4 белково-липидных комплекса, пересекающих мембрану. Убихинол (КоQ) не входит в состав комплексов; цитохром с, являясь водорастворимым, находится в межмембранном пространстве:
Условные обозначения: ВММ — внутренняя мембрана митохондрий; ММП — межмембранное пространство; ПДГ — пиридинзависимые дегидрогеназы; ФДГ — флавинзависимые дегидрогеназы; ЭХП — электрохимический потенциал; РП — разность потенциалов между восстановителем и окислителем.
Комплексы дыхательной цепи
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН·Н + ; протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью, входящего в состав гемма:
Ш. Убихинол-цитохром с-оксидоредуктаза. Переносит электроны с убихинола на цитохром с. Одновременно за счет энергии, выделившейся при переносе, из матрикса переносятся протоны в межмембранное пространство.
IV. Цитохром с-оксидаза. Переносит электроны с цитохрома с непосредственно на кислород. Цитохромы а и а3, помимо атомов железа, содержат атомы меди, поэтому этот комплекс одновременно осуществляет полное (4-электронное) восстановление молекулы кислорода. Энергия переноса электронов используется на перекачивание в межмембранное пространство протонов.
Как указывалось выше, для синтеза АТФ необходимо затратить около 32 кДж/моль энергии. Для этого достаточной является разность потенциалов между окислителем и восстановителем не менее 0,26 вольта. Чанс, Скулачев установили, что таких участков в дыхательной цепи три. Они соответствуют I, III и IV комплексам и названы пунктами сопряжения или фосфорилирования.
Чтобы понять связь между транспортом электронов по дыхательной цепи и синтезом АТФ, познакомимся с V комплексом внутренней мембраны митохондрий — ферментом, осуществляющим реакцию синтеза АТФ и называемым протонной АТФ-синтазой (см. рис.). Этот ферментативный комплекс состоит из двух частей: Fо
(о – олигомицин), который встроен в мембрану и пронизывает ее насквозь, и F1, Последний по форме напоминает шляпку гриба или дверную ручку и обращен в матрикс митохондрии. В изолированном виде F1 не может синтезировать АТФ, но может проводить ее гидролиз до АДФ и фосфата.
Реакция синтеза АТФ, которую проводит V комплекс, носит название окислительного фосфорилирования и описывается уравнением:
Биохимики долго искали связь — промежуточные макроэргические соединения, которые могли бы служить посредником между процессом тканевого дыхания и окислительным фосфорилированием. Английский биохимик П. Митчелл предположил, что синтез АТФ V комплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировал хемиоосмотическую теорию окислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997 г.) подтвердили предположения Митчелла. Ими показано, что энергия движения протонов используется на изменения конформации активного центра АТФ-синтазы, что сопровождается синтезом АТФ, а затем ее высвобождением. Образовавшаяся АТФ с помощью транслоказы перемещается в цитозоль; в ответ в матрикс митохондрии поступают АДФ и фосфат. Всего на процесс синтеза, высвобождения и выброса в цитозоль расходуется 4 протона.
При окислении НАД-зависимых субстратов в ММП выбрасывается 10 протонов (см. схему комплексов дыхательной цепи). Следовательно, в таком случае может быть синтезировано 2,5 моль АТФ (10:4), т. е. коэффициент фосфорилирования Р/О = 2,5. При окислении ФАД-зависимых субстратов в ММП выбрасывается 6 протонов в III и IV пунктах сопряжения. В таком случае может быть синтезировано 1,5 моль АТФ (6:4), т. е. коэффициент фосфорилирования Р/О = 1,5.
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки,
т. е. соотношением АТФ/АДФ. АДФ является стимулятором дыхательной цепи, АТФ – аллостерическим ингибитором.
Гипоэнергетические состояния возникают в организме вследствие дефицита АТФ в клетках. Причины их следующие:
Среди последних различают, во-первых, ингибиторы дыхательной цепи. Это яды, которые блокируют перенос электронов через I, II, III, IV комплексы. Ротенон и барбитураты блокируют I комплекс, малонат — II, антимицин А – III, цианиды, угарный газ блокируют перенос электронов на кислород, осуществляемый IV комплексом дыхательной цепи.
Во-вторых, ингибиторы окислительного фосфорилирования (олигомицин), закрывающие протонный канал V комплекса.
В-третьих, разобщители окислительного фосфорилирования. Это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов дыхательной цепью. Механизм действия разобщителей сводится к тому, что, являясь липофильными веществами, они обладают способностью связывать протоны и переносить их в матрикс, минуя протонный канал Н + АТФ-синтазы. Выделяющаяся при переносе электронов энергия рассеивается в виде тепла. Различают:
Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Примерная схема монооксигеназной цепи выглядит следующим образом:
Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Повышенное образование в организме свободных радикалов кислорода ведет к «окислительному стрессу», который может привести к повреждению мембран и гибели клетки. Поэтому в организме существует антиоксидантная защита от свободных радикалов.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов: