Что такое флебэктазия прямой кишки
Флебэктазия
Смотреть что такое «Флебэктазия» в других словарях:
флебэктазия — флебэктазия … Орфографический словарь-справочник
флебэктазия — сущ., кол во синонимов: 1 • эктазия (24) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
флебэктазия — (phlebectasia; флеб + эктазия; син. венэктазия) стойкое расширение вены (вен) … Большой медицинский словарь
венэктазия — (venectasia; вена + греч. ektasis расширение) см. Флебэктазия … Большой медицинский словарь
Венэктази́я — (venectasia; Вена + греч. ektasis расширение) см. Флебэктазия … Медицинская энциклопедия
Кровено́сные сосу́ды — (vasa sanguifera, vaea sanguinea) образуют замкнутую систему, по которой осуществляется транспорт крови от сердца на периферию ко всем органам и тканям и обратно к сердцу. Артерии несут кровь от сердца, а по венам кровь возвращается к сердцу.… … Медицинская энциклопедия
Приложение. О некоторых структурных и семантических особенностях терминоэлементов греко-латинского происхождения — Большинство терминов представляет собой производные слова, образованные от других, производящих слов (основ) посредством различных способов словообразования: использование приставок и суффиксов, осново‑ и словосложение. Значение таких производных … Медицинская энциклопедия
Компрессионный трикотаж VENOTEKS — Фармакологическая группа: Другие разные средства Нозологическая классификация (МКБ 10) ›› D68.9 Нарушение свертываемости неуточненное ›› E66 Ожирение ›› E66.9 Ожирение неуточненное ›› I78.9 Болезнь капилляров неуточненная ›› I80 Флебит и… … Словарь медицинских препаратов
эктазия — растяжение, расширение Словарь русских синонимов. эктазия сущ., кол во синонимов: 24 • ангиэктазия (1) • … Словарь синонимов
ЭКТАЗИИ — (от греч. ektasis растяжение), термин, употребляемый для обозначения растяжения полостных органов, чаще всего бронхов и сосудов: бронхоэктазы (см.), ангиэкта зия (см.), соответственно строению сосудов артериэктазия (см.), флебэктазия (см.), те… … Большая медицинская энциклопедия
Что такое флебэктазия прямой кишки
Иванова Е. В., Селезнев Д. Е., Мызникова Е. А., Федоров Е. Д.
Российский национальный исследовательский медицинский университет им. Н. И. Пирогова; НОЦ абдоминальной хирургии и эндоскопии: кафедра госпитальной хирургии № 2 с НИЛ хирургической гастроэнтерологии и эндоскопии
Городская клиническая больница № 31
Медицинский реабилитационный центр «Клиника+31»
г. Москва
Введение:
Ангиодисплазии — сосудистые мальформации, которые могут встречаться на всем протяжении желудочно-кишечного тракта (ЖКТ), однако наиболее часто (до 54–81,9 %) — в слепой и восходящей ободочной кишке [1,2,6]. Ангиодисплазии чаще выявляются у пожилых пациентов, преимущественно с сопутствующей патологией (напр., хронической почечной недостаточностью, стенозом аортального клапана, приобретенной формой болезни Виллебранда) [3,4,5]. Как правило, данные поражения протекают бессимптомно, но иногда могут приводить к тяжелым кровотечениям. По литературным данным, ангиодисплазии выявляются у 0,2 % — 2,9 % пациентов без признаков кровотечения и у 2,6 % — 6,2 % пациентов с признаками скрытого или явного кровотечения (положительный тест на скрытую кровь в кале, железодефицитная анемия или клиническая картина кровотечения) [6]. Ангиодисплазии встречаются у мужчин и женщин одинаково часто.
Пациент А., 82 лет, поступил в Медицинский реабилитационный центр «Клиника К+31» г. Москвы в апреле 2013 года, в срочном порядке, с предварительным диагнозом рецидивирующее тонкокишечное кровотечение из неустановленного источника.
Из анамнеза известно, что впервые эпизод массивного желудочно-кишечного кровотечения из неустановленного источника наблюдался в 1999 году, по этому поводу пациент перенес оперативное вмешательство в объеме лапаротомии, резекции участка тонкой кишки с ангиодисплазиями. С 1999 по 2013 год отмечалась стойкая ремиссия; гемоглобин составлял 130 г/л, самочувствие было удовлетворительным. Повторный эпизод массивного желудочно-кишечного кровотечения произошел в марте 2013 года, он проявился меленой, головокружением, слабостью; уровень гемоглобина снизился до 57 г/л. При экстренной ЭГДС источников кровотечения в верхних отделах желудочно-кишечного тракта выявлено не было. При срочной колоноскопии диагностированы две ангиодисплазии в правых отделах толстой кишки, признаков кровотечения на момент осмотра выявлено не было.
По данным видеокапсульной эндоскопии (ВКЭ) были зарегистрированы множественные ангиодисплазии тела желудка, множественные лимфангиэктазии и флебэктазии тощей и подвздошной кишки; было высказано подозрение на наличие ангиодисплазии слепой кишки (рис. 1 а, б, в).
Рис. 1а. Ангиодисплазия и кровь в теле желудка
Рис. 1б. Лимфангиэктазия и флебэктазия тощей кишки
Рис. 1в. Подозрение на ангиодисплазию слепой кишки
Учитывая вышеперечисленные находки при ВКЭ, пациенту в срочном порядке была выполнена однобаллонная пероральная энтероскопия (ОБПЭ) с помощью энтероскопа SIF-Q180 и шинирующей трубки с баллоном на дистальном конце. По результатам энтероскопии: в теле желудка по передней и задней стенкам, по большой кривизне, выявлены пять ангиодисплазий размером до 5 мм. При энтероскопии было осмотрено около 3 метров тонкой кишки, в ходе исследования были выявлены флебэктазии, лимфангиэктазии и множественные лимфатические кисты тощей кишки, что не было расценено как достоверные источники кровотечения (рис. 2 а, б, в).
Рис. 2а. флебэктазия тощей кишки
Рис. 2б. Лимфангиэктазия тощей кишки
Рис. 2в. лимфатическая киста тощей кишки
По завершении энтероскопии, при осмотре желудка, была выполнена аргоно-плазменная коагуляция (АПК) ангиодисплазий слизистой желудка — для профилактики рецидива кровотечения. Через 5 суток пациент в удовлетворительном состоянии был выписан из стационара, рецидива кровотечения за время пребывания в стационаре не было. Уровень гемоглобина при выписке составлял 107 г/л.
Однако через месяц, в апреле 2013 г., возник очередной эпизод тонкокишечного кровотечения. При поступлении у пациента были жалобы на гематохезию, головокружение, имела место потеря сознания. В общем анализе крови уровень гемоглобина 58 г/л. Пациент госпитализирован в отделении реанимации и интенсивной терапии, проводилась гемотрансфузионная терапия. При экстренной ЭГДС источника кровотечения выявлено не было, ранее описанные ангиодисплазии желудка не определялись.
На следующий день, в срочном порядке, пациенту была выполнена колоноскопия. Во время колоноскопии признаков кровотечения в толстой кишке не выявили. Однако, в слепой кишке, рядом с устьем аппендикса, имелись две ангиодисплазии, размером 4 мм и 2 мм, неправильной формы, с «капиллярным ветвлением» (рис. 3 а, б).
Рис. 3а,б. две ангиодисплазии купола слепой кишки
С целью профилактики кровотечения пациенту было выполнено клипирование наибольшей по размеру ангиодисплазии. Диффузное подтекание крови после наложения клипс, остановлено с помощью аргоно-плазменной коагуляции (АПК) (рис. 4 а, б, в).
Рис. 4а. Клипирование наибольшей по размеру ангиодисплазии
Рис. 4б. Кровотечение остановлено с помощью АПК
Рис. 4в. вид места вмешательства после гемостаза
Вторая ангиодисплазия меньших размеров была коагулирована АПК без наложения клипс (рис. 5).
Рис. 5. АПК ангиодисплазии
Послеоперационный период протекал без осложнений, рецидива кровотечения не было. На фоне проводимой терапии уровень гемоглобина составил 108 г/л. Пациент выписался из стационара в удовлетворительном состоянии с клиническим диагнозом: Множественные ангиодисплазии желудочно-кишечного тракта, осложнённые массивными рецидивирующими кровотечениями.
Контрольная колоноскопия была выполнена через 13 месяцев, рецидива кровотечения за этот период не было, уровень гемоглобина 143 г/л. При колоноскопии слизистая слепой кишки не изменена, ангиодисплазий в слепой кишке не выявлено (рис. 6 а, б).
Рис. 6а,б. Вид купола слепой кишки при контрольной колоноскопии
В нисходящей ободочной кишке выявлена единичная ангиодисплазия размером до 3 мм. С целью профилактики кишечного кровотечения выполнено клипирование ангиодисплазии с последующей АПК (рис. 7 а, б).
Рис. 7а. Ангиодисплазия нисходящей ободочной кишки
Рис. 7б. Клипирование ангиодисплазии
Таким образом, данный случай демонстрирует сложности диагностики наиболее частой причины желудочно-кишечного кровотечения из неустановленного источника — сосудистой патологии желудочно-кишечного тракта. Своевременная эндоскопическая диагностика и лечение ангиодиспазий ЖКТ с применением клипирования и AПК позволяют эффективно выполнить профилактику рецидивов кровотечения.
Список литературы:
1. Howard OM, Buchanan JD, Hunt RH. Angiodysplasia of the colon: Experience of 26 cases. Lancet 1982, 2:16–9.
2. Richter JM, Christensen MR, Colditz GA, Nishioka NS. Angiodysplasia. Natural history and efficacy of therapeutic interventions. Dig Dis Sci 1989, 34:1542–6.
3. Navab F, Masters P, Subramini R, Ortego TJ, Thompson CH. Angiodysplasia in patients with renal insufficiency. Thromb Haemost 1993, 70:546.
4. Goldman MJ. Aortic stenosis and gastrointestinal bleeding. N Engl J Med 1958, 259:941.
5. Federici AB: Clinical diagnosis of von Willebrand disease. Haemophilia 2004, 10:169–76.
6. Sami SS, Al-Araji SA, Ragunath K: Review article: gastrointestinal angiodysplasia — pathogenesis, diagnosis and management. Aliment Pharmacol Ther 2014 Jan 20; 39 (1):15–34.
Геморрой и варикоз
Геморрой является варикозным увеличением пещеристых (кавернозных) вен в прямой кишке. Это самое распространенное заболевание этого органа.
Основными причинами развития патологии является гемодинамические и мышечно-дистрофические нарушения.
Первый фактор связан с нарушением функциональности сосудов, что ведет к увеличению поступления артериальной крови и снижению кавернозного отвода крови. Это и вызывает рост геморроидальных узлов. То есть геморрой является патологией сосудов.
Варикоз тоже происходит в связи с патологическими изменениями венозных стенок.
Общим у обеих болезней является наличие функциональной недостаточности сосудов. Являясь варикозным увеличением кровеносных сосудов, заболевания оказывают взаимное влияние на течение патологических процессов. А если учесть, что на развитие варикоза влияет гиподинамия, несбалансированное питание, способное вызывать запоры, то заметна очевидная взаимосвязь варикоза с геморроем.
Вероятность развития геморроя при варикозной болезни заметно повышается. Нарушения в кровотоке оказывают влияние на объем крови, приходящей к венозным сосудам в заднем проходе. К застою крови приводит и любой воспалительный процесс либо сбой в работе органов таза.
Еще больше связь двух болезней наблюдается при лечении. Так как сходны причины, вызывающие болезнь, сходным будет и медикаментозное лечение. Поэтому при проведении медикаментозного лечения геморроя происходит купирование симптомов варикозной патологии нижних конечностей.
Применение медпрепаратов, повышающих тонус сосудов и улучшающих микроциркуляцию крови, положительный эффект будет наблюдаться в течении двух болезней.
Если при варикозе нижних конечностей происходит воспаление сосудов в анальном канале, то приемлемо использование варикозных мазей при местном лечении геморроя.
Даже упражнения лечебной гимнастики, приносящие облегчение при варикозе и геморрое сходны. Поднятые вверх ноги в положении лежа вызывают отток крови от гемарроидальных сосудов и вен нижних конечностей.
Важно, что применение консервативных методов при лечении обеих болезней возможно на начальных стадиях. На более тяжелых стадиях варикоза и геморроя требуется прибегать к хирургическому или малоинвазивному лечению. Определяет степень развития геморроя, проверяет наличие осложнений и назначает действенное лечение врач проктолог.
Что такое флебэктазия прямой кишки
Варианты аномалий кишечника в зависимости от клинических проявлений
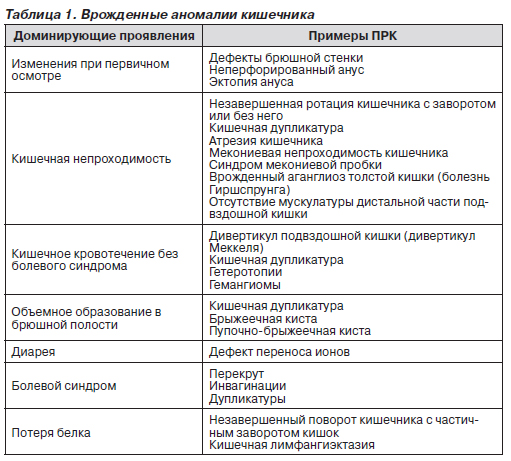
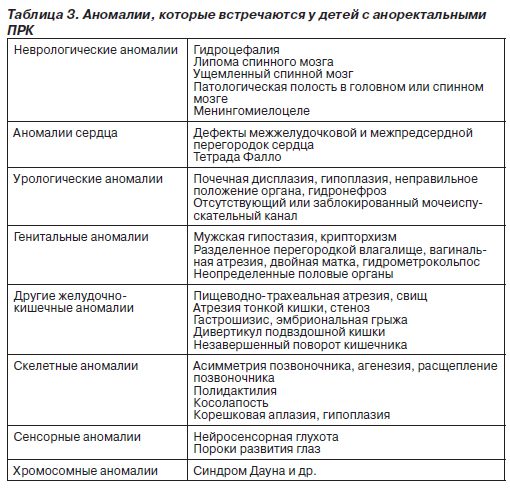
Проявления пороков развития кишечника (ПРК) могут быть различными. В зависимости от наиболее вероятных и ярких клинических проявлений ПРК разделяют на несколько групп: очевидные при первичном осмотре; проявляющиеся преимущественно кишечной непроходимостью; ПРК, при которых доминирующий симптом — кишечное кровотечение; ПРК, признаком которых является обнаружение объемного образования в брюшной полости; ПРК с преобладанием в клинике диареи; ПРК, протекающие с болями в животе; ПРК, главным симптомом которых является потеря белка с калом (табл. 1).
Симптомы непроходимости кишечника у новорожденных включают рвоту желчью, вздутие живота, неотхождение мекония и желтуху. Отхождение мекония не исключает наличия у новорожденного высокой кишечной непроходимости. Необходимо тщательно проанализировать возможные причины рвоты желчью у ребенка из-за возможности перемежающейся непроходимости, связанной с периодически возникающим и самостоятельно разрешающимся заворотом кишок. У пациентов с высокой кишечной непроходимостью возможно развитие негемолитической гипербилирубинемии со значительным преобладанием непрямого билирубина (это нехарактерно для дистальной кишечной непроходимости). Предполагают, что развитие желтухи обусловлено повышенной энтерогепатической циркуляцией билирубина и снижением активности глюкоронилтрансферазы.
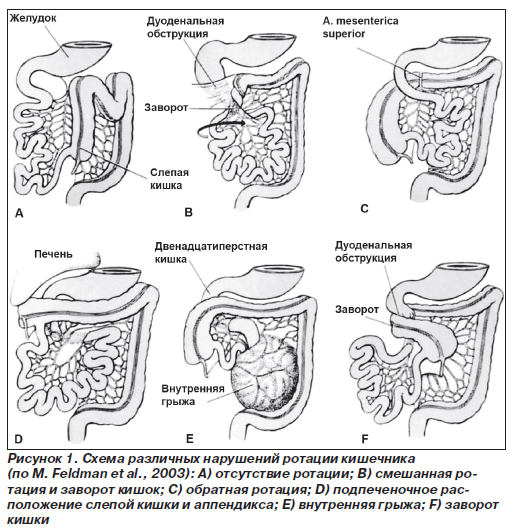
Обследование и лечение пациентов с очевидной кишечной непроходимостью должны проводиться одновременно. Для поддержания у младенца нормальной температуры и гомеостаза следует проводить интенсивную терапию. Аспирация желудочного содержимого помогает уменьшить метеоризм. Обзорная рентгенограмма брюшной полости в горизонтальном и вертикальном положении выявляет чаши Клойбера, кальцификаты в органах брюшной полости, мекониевые пробки. Рентген-исследование с контрастом помогает выявить место закупорки — в толстой или тонкой кишке — и оценить наличие, вариант и степень нарушения ротации кишечника (рис. 1).
При подозрении на возможную перфорацию кишечника вместо бария применяют водорастворимые контрасты. Гиперосмотическая клизма с контрастом может служить как диагностическим, так и терапевтическим средством у больных с мекониевой пробкой или мекониевой непроходимостью кишечника. Если исследование подтверждает нарушение ротации кишечника, то необходимо провести рентген-исследование с контрастированием per os для определения расположения связки Трейца.
Аномалии с доминированием других клинических проявлений представлены в табл. 1.
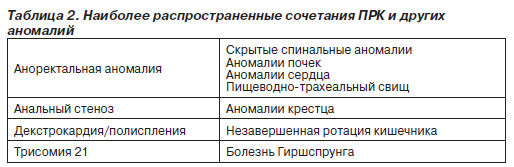
Важно учитывать, что многие ПРК сочетаются друг с другом и с другими аномалиями, т.е. при выявлении одной аномалии следует обследовать пациента для возможного обнаружения другой аномалии (табл. 2).
Варианты аномалий кишечника в зависимости от типа ПРК
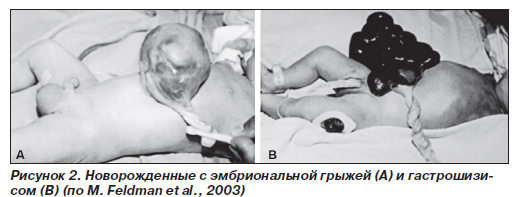
Дефекты брюшной стенки (эмбриональная грыжа и гастрошизис). Частота эмбриональной грыжи составляет около 2,5 случая на 10 тыс. новорожденных, а гастрошизиса — 1 случай на 10 тыс. новорожденных в целом, но может достигать 7 и более случаев на 10 тыс. новорожденных у матерей моложе 20 лет.
Эмбриональная грыжа представляет собой выпячивание органов брюшной полости, иногда и печени, в месте прикрепления пуповины. Как правило, размер дефекта брюшной стенки не превышает 4 см (рис. 2). Органы брюшной полости не изменены, они заключены в мембранозный мешок, к которому прикреплена пуповина. В некоторых случаях имеются только рудименты мешка. У 75 % новорожденных с эмбриональной грыжей наблюдаются внекишечные врожденные дефекты, чаще всего трисомия 13 или 18, а также синдром Beckwith — Wiedemann (синдром пуповинной грыжи — макроглоссии — гигантизма).
Гастрошизис является следствием горизонтального (поперечного) дефекта брюшной стенки в области пупка. Кишечник, не защищенный мембранозным мешком или его рудиментом, имеет аномалии, причем его поверхность матовая, а стенка утолщена из-за воздействия амниотической жидкости (рис. 2). Другие органы брюшной полости, забрюшинного пространства и таза, в том числе мочевой пузырь, почки, яичники, матка, могут находиться среди петель эвентированного кишечника. Пуповина прикреплена нормально. Приблизительно в четверти случаев у пациентов с гастрошизисом имелись другие врожденные дефекты, включая агенезию желчного пузыря и почек.
Хирургическое устранение этих дефектов проводят в первый же день жизни. Для того чтобы определить, сможет ли брюшная полость вместить выпячивающиеся внутренние органы, необходимы тщательная клиническая оценка и практический опыт. Одноразовое закрытие раны осуществляют в половине случаев, во второй половине необходимо постепенное восстановление нормальной топографии органов брюшной полости. Во время и после оперативного лечения возможно развитие некротического энтероколита, перфорации кишечника или его некроза, а также осложнений, связанных с продолжительным парентеральным питанием.
Аномалии ротации и фиксации. Между шестой и десятой неделями беременности кишечник выпячивается в пуповину и поворачивается, возвращаясь в брюшную полость и устойчиво фиксируя основание брыжейки. Частота аномалий ротации составляет около 1 %, у новорожденных мужского пола встречается в 2 раза чаще. Выделяют 3 механизма в патогенезе нарушений ротации кишечника: нарушения внутриутробного поворота кишечника, развития и фиксации отдельных сегментов кишки. Наиболее выражены аномалии положения кишки при полном обратном расположении органов брюшной полости, когда желудок, нисходящая и сигмовидная кишка, селезенка находятся справа, а слепая, восходящая кишка и печень — слева. При частичном верхнем обратном расположении органов брюшной полости аномалия ограничивается ненормальным поворотом желудка и двенадцатиперстной кишки, а при нижнем варианте аномалии наблюдается обратное расположение тонкой и толстой кишки. Обратное расположение органов брюшной полости (полное или частичное) входит в триаду Kartagener (бронхоэктазы — хронический синусит с полипами носовых ходов — обратное расположение органов брюшной полости).
Аномалии ротации и фиксации кишечника заключаются в отсутствии ротации, ее незавершенности, обратной ротации и неправильном прикреплении брыжейки (рис. 1).
Отсутствие поворота (нонротация) обусловлено остановкой I стадии нормальной ротации кишечника в самом ее начале. Как следствие, кишечник «подвешен» на узкой дорсальной брыжейке, которая является общей для тонкой и толстой кишки; тонкая кишка лежит справа, а толстая кишка — слева в брюшной полости (рис. 1). Несмотря на отсутствие связок, препятствующих прохождению содержимого, кишечник может перекручиваться вдоль своей продольной оси. В связи с этим возможны завороты кишечника, причем точкой вращения всегда является корень брыжейки с верхней брыжеечной артерией и веной. Заворот обычно охватывает всю тонкую кишку, слепую кишку и начальную часть восходящей кишки. Нонротация встречается с частотой в 0,2 %. Левостороннее положение слепой кишки вызывает большие сложности в диагностике острого аппендицита. Дефект зачастую сопровождается другими аномалиями, например эмбриональной грыжей, гастрошизисом, дуоденальной атрезией и/или стенозом, дивертикулом подвздошной кишки, билиарной атрезией, кольцевидной поджелудочной железой и неперфорированным анусом. Отсутствие вращения пупочной петли наблюдается только в сочетании с врожденной пупочной грыжей.
Остановка ротации кишечника на II стадии (мальротация) проявляется тремя изменениями. Слепая кишка поворачивается и фиксируется, но двенадцатиперстная кишка этого не делает, что ведет к ее ущемлению связками (пучки Ледда) (рис. 1). Менее распространен случай, когда слепая и двенадцатиперстная кишка поворачиваются в противоположных направлениях, вызывая блокаду толстой кишки вследствие компрессии извне верхними брыжеечными сосудами (рис. 1), или же дуоденальная петля поворачивается в обратном направлении при нормальной ротации слепой кишки, заключая тем самым тонкую кишку в ее брыжейку с формированием внутренней грыжи (рис. 1).
При нарушениях III стадии ротации кишечника дуоденальная петля поворачивается в правильном направлении и фиксируется, но этого не происходит со слепой кишкой, что приводит к отсутствию надежной фиксации слепой и восходящей кишки. Слепая кишка слабо зафиксирована и расположена высоко в правом верхнем квадранте с дефектными связками или без них (рис. 1). Высокое положение слепой кишки (Coecum altum congenitum) создает большие трудности в диагностике и лечении аппендицита. При таком расположении слепой кишки она также является подвижной, при этом формируется синдром подвижной слепой кишки (Coecum mobile).
Общая брыжейка. Общая брыжейка обычно является следствием неполной ротации. Для нее характерно отсутствие соединений между восходящей частью брыжейки толстой кишки и задней брюшной стенкой. Восходящая кишка располагается вдоль задней стенки правой половины брюшной полости, не будучи прикрепленной к ней. Частично соединенная с брыжейкой толстой кишки слепая кишка и терминальный отдел подвздошной кишки могут свободно перемещаться в брюшной полости (А.И. Парфенов, 2002).
Избыточная подвижность кишечных сегментов в случае общей брыжейки благоприятствует заворотам тонкой и толстой кишки (илеоцекальный заворот). Эта форма аномалии фиксации является наиболее частой и встречается у 14 % детей грудного возраста.
Нарушения ротации нередко приводят к более или менее значительному сдавлению двенадцатиперстной кишки длинной ножкой брыжейки, что вызывает клиническую картину артериомезентериальной непроходимости или недостаточности.
Артериомезентериальная непроходимость может развиваться при нарушениях ротации, а также самостоятельно, если верхняя брыжеечная артерия ответвляется от аорты под чрезмерно острым углом и сдавливает двенадцатиперстную кишку в области нижней горизонтальной ее части (А.И. Парфенов, 2002).
Клиника. Клинические симптомы определяются тремя типами изменений кишки: сужением ее просвета (артериомезентериальной непроходимостью), заворотом кишечника, нарушением кровоснабжения кишки вследствие перекрута участка брыжейки. В типичных случаях клиника характеризуется острой, подострой или рецидивирующей кишечной непроходимостью. У 90 % пациентов с нарушениями ротации кишечника клинические проявления обнаруживаются в течение первых 2 месяцев жизни в виде симптомов кишечной непроходимости. У некоторых больных наблюдаются рвота желчью, выраженный метеоризм в сочетании с гипотонией, шоком и кровянистым стулом. У других больных клиника может быть менее выраженной и проявляться болями в животе, медленным увеличением массы тела, гипотрофией, диареей с синдромом мальабсорбции, запорами, раздражительностью, апатией, наличием свежей крови в испражнениях и периодической рвотой, отставанием в развитии. В редких случаях мальротация имеет место у нескольких членов семьи, что подтверждает наличие генетической предрасположенности. В легких случаях появление симптомов может задерживаться до второй, третьей или четвертой декады жизни.
Артериомезентериальная непроходимость может возникать остро, после обильной пищи. Возникает резкая боль в подложечной области, повторная рвота. Наблюдается асимметрия живота за счет выбухающего в подложечной области переполненного желудка. В отличие от острой кишечной непроходимости иного генеза при артериомезентериальной непроходимости состояние улучшается после принятия больным коленно-локтевого положения. В большинстве случаев отмечается быстрое прохождение желудочно-кишечного содержимого через дуоденоеюнальный изгиб с ликвидацией симптомов непроходимости.
Хронические формы артериомезентериальной непроходимости проявляются более или менее постоянными болями в эпигастральной области, уменьшающимися в коленно-локтевом положении (А.И. Парфенов, 2002).
Синдром подвижной слепой кишки характеризуется рецидивирующими болями в правой подвздошной области или внизу живота, зависящими от положения тела.
Причина появления этих симптомов кроется в нарушениях проходимости и кровоснабжения в илеоцекальной зоне вследствие эпизодических перекрутов восходящей толстой кишки. Анализ операционного и секционного материала позволяет в некоторых случаях выявлять признаки фиброзного периколита и неспецифического лимфаденита в удлиненной брыжейке этого отдела кишечника (А.И. Парфенов, 2002).
Диагностика синдрома подвижной слепой кишки представляет большие трудности. Больные могут в течение длительного времени безуспешно лечиться по поводу систематических болей в животе, ограничивающих трудоспособность. Между тем оперативное лечение приводит к выздоровлению.
Синдром Уилки (функциональная непроходимость дистальной трети двенадцатиперстной кишки, где она перекрещивается с верхней брыжеечной артерией) характеризуется интермиттирующей рвотой с примесью желчи, исхуданием, слабостью, вынуждающей больного соблюдать постельный режим; рвота прекращается и общее самочувствие улучшается, если больной лежит на спине. Рентгенологически наблюдается расширение желудка и проксимального отдела двенадцатиперстной кишки; резкая граница бария в начале дистальной трети двенадцатиперстной кишки, на месте, где последняя перекрещивается с верхней брыжеечной артерией (А.И. Парфенов, 2002).
Синдром Ледда — кишечная непроходимость, развивающаяся у больных с аномалиями ротации кишечника. Встречается преимущественно у детей. В клинической картине доминируют симптомы кишечной непроходимости (острой или рецидивирующей), которые вызываются заворотом тонкой кишки в сочетании с пережатием двенадцатиперстной кишки эмбриональными тяжами, идущими от париетальной брюшины сперва к слепой кишке и натягивающимися при завороте (А.И. Парфенов, 2002).
Диагностика. Диагноз нарушений ротации и фиксации кишечника устанавливается клинически и рентгенологически. Для диагностики артериомезентериальной непроходимости необходимо полипозиционное рентгенологическое исследование желудка, при котором выявляют расширение его, а также двенадцатиперстной кишки, задержку бария и его быстрое прохождение после принятия больным коленно-локтевого положения.
Лечение. Больные с острой кишечной непроходимостью нуждаются в интенсивной терапии и ургентном хирургическом вмешательстве. Если состояние больного позволяет, то для подтверждения предоперационного диагноза незавершенной ротации кишечника возможно проведение рентгенологического исследования. При оперативном лечении используют операцию Ледда. Для предупреждения рецидива заворота кишечника или перекручивания брыжейки производят фиксирование двенадцатиперстной и ободочной кишки к задней брюшной стенке.
В легких случаях артериомезентериальной непроходимости лечение может быть консервативным. Больному объясняют необходимость принятия пищи лежа на правом боку, а при появлении болей целесообразно принимать коленно-локтевое положение, спазмолитические средства. При выраженном болевом синдроме необходимо оперативное лечение (позадиободочная дуоденоеюностомия по Ледду; если такая операция невозможна, то накладывают впередиободочный дуоденоеюноанастомоз; рассечение связки Трейца обычно нецелесообразно).
Дупликатуры. Кишечная дупликатура является редким врожденным пороком с неясным патогенезом. Патологоанатомические исследования показали, что частота заболевания составляет 2 случая на 9000 детей. Дупликатуры представляют собой кистозные, трубчатые или дивертикулярные образования, расположенные на брыжеечной стороне кишки и, вероятно, появившиеся в результате нарушения формирования сосудов эмбрионального кишечника. Хотя дупликатуры чаще всего возникают в тощей и подвздошной кишке, они могут также появляться и в любом другом отделе кишечника. Полость дупликатуры обычно полностью отделена от полости нормальной кишки, но обе кишки имеют общую часть мышечной оболочки и сосудистой системы. Стенки дупликатур могут быть покрыты желудочной слизистой оболочкой различной степени эмбрионального созревания. Эта особенность позволяет выявить ряд нарушений методом радиоизотопной (меккелевой) сканограммы с помощью 99mTc.
Кишечные дупликатуры тонкой кишки, как правило, имеют клинические проявления (в отличие от дупликатур толстой кишки), которые появляются в первый год жизни в виде кишечной непроходимости и/или пальпируемого опухолевидного образования в брюшной полости. У взрослых больных могут наблюдаться аналогичные острые симптомы, а также кровотечения и малигнизация.
Диагностику проводят с помощью сонографии, сканирования или КТ брюшной полости.
Лечение включает хирургическую резекцию дупликатуры и прилегающего сегмента кишечника с наложением анастомоза «конец в конец».
Кишечная атрезия — полное врожденное прерывание просвета кишки, которое приводит к кишечной непроходимости. В тонкой кишке 50 % атрезий возникает в двенадцатиперстной кишке, 36 % — в тощей, 14 % — в подвздошной. Атрезии толстой кишки менее распространены и составляют не более 10 % от всех кишечных атрезий.
Лечение включает резекцию участка кишки с атрезией с наложением анастомоза «конец в конец».
Аноректальные пороки развития. Гетеротопии в кишечнике. Опухолевые и опухолевидные пороки развития кишечника
Аноректальные пороки развития
Эпидемиология и этиология. Аноректальные пороки развития сравнительно широко распространены, их частота составляет 1 случай на 2–5 тыс. новорожденных. Эти пороки чаще встречаются у младенцев мужского, чем женского пола. Почти в половине случаев пороки развития кишечника возникают как изолированные аномалии, у остальных больных они сопровождаются другими генетическими дефектами. Наиболее частые сочетания нарушений обозначают аббревиатурами VATER или VACTERL (сочетания вертебральных, анальных, кардиальных, трахеальных, пищеводных, почечных аномалий и аномалий конечностей). В табл. 3 приведены данные о других аномалиях, наблюдаемых у больных с аноректальными ПРК. Этиология этих пороков развития не выяснена. Случаи сахарного диабета и приема лекарств, в том числе талидомида, фенитоина и тридиона, более характерны для матерей младенцев с аноректальными пороками развития, чем для матерей младенцев без таких пороков.
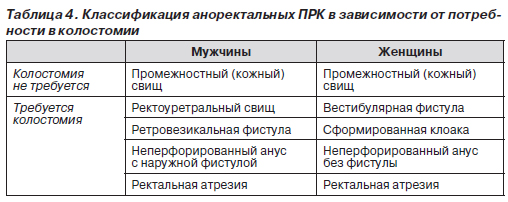
Классификация. Аноректальные ПРК классифицируются в зависимости от расположения окончания кишечника относительно мышц-леваторов, образующих диафрагму таза. Считается, что младенцы, у которых окончание толстой кишки проходит через леваторы, имеют так называемый низкий дефект развития, как правило, устраняемый с помощью местного хирургического вмешательства с хорошим исходом. В случае же, когда окончание толстой кишки расположено внутри или над мышцами-леваторами (высокий дефект развития), то данный ПРК обычно распространяется на мочевые пути (у мальчиков) и половые органы (у девочек), что затрудняет устранение аномалии хирургическим путем. В этих случаях используют различные оперативные вмешательства в зависимости от пола ребенка (табл. 4).
Функционирование анального сфинктера после хирургического вмешательства сильно зависит от того, сохранена ли его иннервация. Сохранение иннервации обусловлено сопутствующими аномалиями крестцового отдела позвоночника, спинного мозга, аномалиями центральной нервной системы.
Диагностика и лечение. В большинстве случаев аноректальные ПРК выявляют при рождении во время тщательного осмотра промежности. В качестве дополнительных методов применяют ректоскопию и сонографию.
Главными методами лечения ребенка с неперфорированным анусом являются декомпрессия кишечника методом орогастральной или назогастральной аспирации. Дальнейший вариант хирургического лечения зависит от наличия других аномалий. Для их выявления применяют сонографию и контрастирование фистул с последующим суточным ожиданием для определения их топографии. Если не обнаружены анальное отверстие, промежностная мембрана или фистула, то тогда усилия следует направить на определение месторасположения прямой кишки и любой фистулы. Большое значение также имеет выявление аномалий позвоночника, спинного мозга, сердца, других аномалий пищеварительного тракта. После тщательного обследования решается вопрос о варианте хирургического вмешательства.
Гетеротопии — дизонтогенетические дистопии эпителия из других органов, которые являются следствием нарушения его дифференциации в эмбриональном периоде.
В тонкой кишке встречаются гетеротопии желудочного эпителия (особенно в дивертикуле Меккеля), ткани поджелудочной железы. В толстой кишке гетеротопии встречаются редко. Вследствие секреции желудочным эпителием соляной кислоты и пепсиногена в месте его гетеротопии могут развиваться пептические язвы с кровотечением. Возможна малигнизация гетеротопий.
При развитии пептических язв лечение консервативное — противоязвенное. При склонности к кровотечениям или подозрении на малигнизацию лечение хирургическое — резекция кишки. В случае гетеротопии ткани поджелудочной железы обычно проводят динамическое наблюдение и лишь в случае изъязвления желательно оперативное лечение.
Опухолевидные и опухолевые ПРК
Гамартия (в переводе с греч. — «недостаток», «погрешность») — аномалия развития, заключающаяся в неправильном соотношении тканей в анатомических структурах или в появлении остатков зародышевых образований, отсутствующих в норме в зрелом организме. Образующееся из такой ткани опухолевидное образование — гамартома — возникает в результате нарушения эмбрионального развития органов и тканей, состоит из тех же компонентов, что и орган, где оно находится, но отличается их неправильным расположением и степенью дифференцировки. Нередко наблюдается бластоматозное перерождение гамартом (А.И. Парфенов, 2002).
Гамартома бруннеровых желез — гиперплазия, полипоидная пролиферация или аденома бруннеровых желез. Такие гамартомы чаще всего располагаются в двенадцатиперстной кишке.
Различают полиповидные гемангиомы тонкой и толстой кишки, множественные флебэктазии (в том числе телеангиэктазии Ослера), кавернозные гемангиомы и генерализованный гемангиоматоз.
Гемангиомы кишечника встречаются редко. Они составляют 0,3 % от всех опухолей желудочно-кишечного тракта.
Различают полиповидные гемангиомы тонкой и толстой кишки, множественные флебэктазии (в том числе телеангиэктазии Ослера), кавернозные гемангиомы и генерализованный гемангиоматоз. Полиповидные гемангиомы тонкой и толстой кишки могут приводить к обструкции, инвагинации, кишечным кровотечениям и хронической анемии. Около 30 % всех ангиоматозных повреждений протекают бессимптомно.
При множественных флебэктазиях речь идет о многочисленных «опухолях» голубоватого цвета величиной от 0,1 до 0,5 см. Они располагаются чаще всего в слизистой или подслизистой оболочке и составляют 40–60 % всех интестинальных гемангиоматозных поражений (А.И. Парфенов, 2002).
Телеангиэктазии Ослера. Эта болезнь описана англо-американским терапевтом W. Osler. Она характеризуется наличием множественных наследственных телеангиэктазий кожи и слизистых оболочек.
Геморрагические телеангиэктазии наследуются по аутосомно-доминантному типу. Распространенность телеангиэктазий достигает 15,6 на 100 тыс. населения. Изменения в белковом синтезе нарушают рост кровеносных сосудов. В результате образуются артериовенозные соустья между небольшими сосудами, которые ведут к образованию телеангиэктазий.
Телеангиэктазии локализуются чаще на губах и слизистой носа, но также и в других органах, в частности в стенках тонкой и толстой кишок. У большинства пациентов телеангиэктазии не вызывают клинических симптомов, но у 13 % больных могут возникать серьезные желудочно-кишечные кровотечения (А.И. Парфенов, 2002).
При кавернозных гемангиомах следует различать диффузно-инфильтративную и полиповидную формы. Поверхность кавернозной гемангиомы окрашена в голубоватый цвет, имеет мягко-эластическую консистенцию. Полипозная форма, как правило, бывает представлена солитарной опухолью. Она составляет примерно 15 % от всех ангиоматозных поражений желудочно-кишечного тракта. Клиническая картина кавернозной гемангиомы кишечника характеризуется кровотечениями, кишечной непроходимостью или повторными инвагинациями. Диффузно-инфильтративные кавернозные гемангиомы локализуются преимущественно в слизистой оболочке и постепенно распространяются на все слои кишки. Кавернозные гемангиомы находятся одинаково часто в тощей и подвздошной кишке, реже — в двенадцатиперстной кишке. По мере разрастания опухоли возможно появление клинических симптомов, в первую очередь кровотечений, затем симптомов непроходимости (А.И. Парфенов, 2002).
При генерализованном гемангиоматозе речь идет о кавернозных или капиллярных гемангиоматозных поражениях, частота их составляет от 2 до 12 % от всех гемангиом. Этот тип гемангиом характеризуется тяжелыми внутренними кровотечениями.
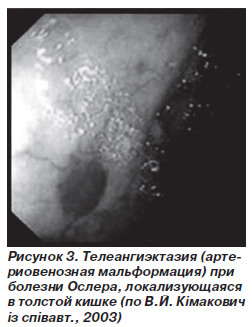
Красное пятно с нечеткими краями, которое бледнеет при надавливании, типично при болезни Ослера. Не следует проводить биопсию из-за риска кровотечения
Лечение главным образом хирургическое. При небольших флебэктазиях слизистой оболочки кишечника может применяться эндоскопическая электрокоагуляция опухоли.
Для остановки кровотечений из телеангиэктазий в желудочно-кишечном тракте применяют лазер, фармакологическую терапию эстроген-прогестероном.
Лимфангиоматозы кишечника — гамартоматозные полипообразные образования, которые большей частью распространяются вглубь стенки кишки.
Различают 3 формы лимфангиоматозных поражений кишечника (А.И. Парфенов, 2002):
1. Лимфангиомы.
2. Первичная интестинальная лимфангиэктазия.
3. Лимфоцисты.
Лимфангиомы встречаются исключительно редко, локализуются прежде всего в двенадцатиперстной кишке.
Первичная кишечная лимфангиэктазия (болезнь Вальдмана) — аномалия развития лимфатических сосудов в виде множественных кавернозных образований. Последние располагаются преимущественно в подслизистом слое. Лимфангиомы содержат густую лимфу с большим содержанием в ней лимфоцитов.
Лимфатические кисты — множественные кисты диаметром до 1 см в подслизистом слое стенки кишки или в брыжейке. В отличие от лимфангиэктазий они не содержат лимфоцитов и не сопровождаются потерей белка в просвет кишки.
Клиническая картина характеризуется более или менее выраженной энтеропатией с потерей белка, отеками. В толстой кишке лимфангиэктазии располагаются редко и обычно являются эндоскопической находкой. При распространенной форме наблюдается стойкая, выраженная гипопротеинемия, резистентная к терапии. Отеки могут спонтанно уменьшаться и нарастать. При обструктивных изменениях лимфатических сосудов они могут быть асимметричными, а в тяжелых случаях присоединяется асцит и гидроторакс, вплоть до анасарки. Вследствие дефицита белка дети отстают в развитии и росте, у взрослых развивается атрофия мышечной системы, ногтевые фаланги приобретают вид «барабанных палочек». Боли в животе беспокоят редко. Часто появляются судороги из-за недостатка кальция. Последний, соединяясь с жирами в просвете кишки, не всасывается. У 80 % больных наблюдается хроническая диарея со стеатореей (А.И. Парфенов, 2002).
Диагноз устанавливают на основании рентгенологического и эндоскопического исследования кишечника с гистологическим исследованием слизистой оболочки. При первичной лимфангиэктазии и лимфангиомах слизистая оболочка кишки отечна, складки ее резко утолщены, стенка кишки может быть ригидной, слизистая оболочка рыхлая, пестрого вида за счет белесых пятен 1–2 мм диаметром. При гистологическом исследовании ворсинки слизистой оболочки тонкой кишки расширены из-за нарушения оттока лимфы и отека.
Для более точной топической диагностики пораженного кишечного сегмента применяют радиоизотопные, электрофоретические и иммунологические исследования кишечного сока, полученного из разных отделов тонкой или толстой кишки.
Лечение в основном симптоматическое. Для устранения гипопротеинемии применяют длительное внутривенное вливание белковосодержащих растворов, в первую очередь альбумина и γ-глобулина. Лечение проводят курсами 2–3 раза в год по 1 месяцу. Всем больным показаны препараты кальция, железа. Диета должна содержать повышенное количество белка (до 130 г/сут). Длинноцепочечные тугоплавкие жиры по возможности заменяются легкоусвояемыми среднецепочечными триглицеридами. У пациентов с первичной лимфангиэктазией в случаях, резистентных к консервативному лечению, может быть обсужден вопрос о резекции наиболее пораженных петель кишки (А.И. Парфенов, 2002).