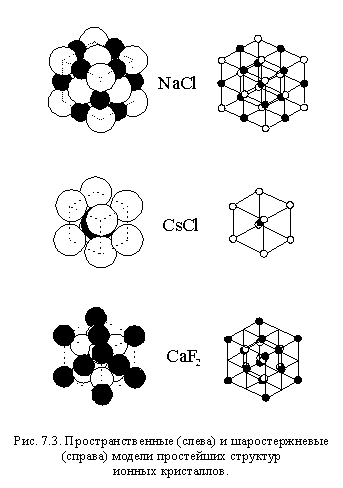Что такое частичный заряд
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
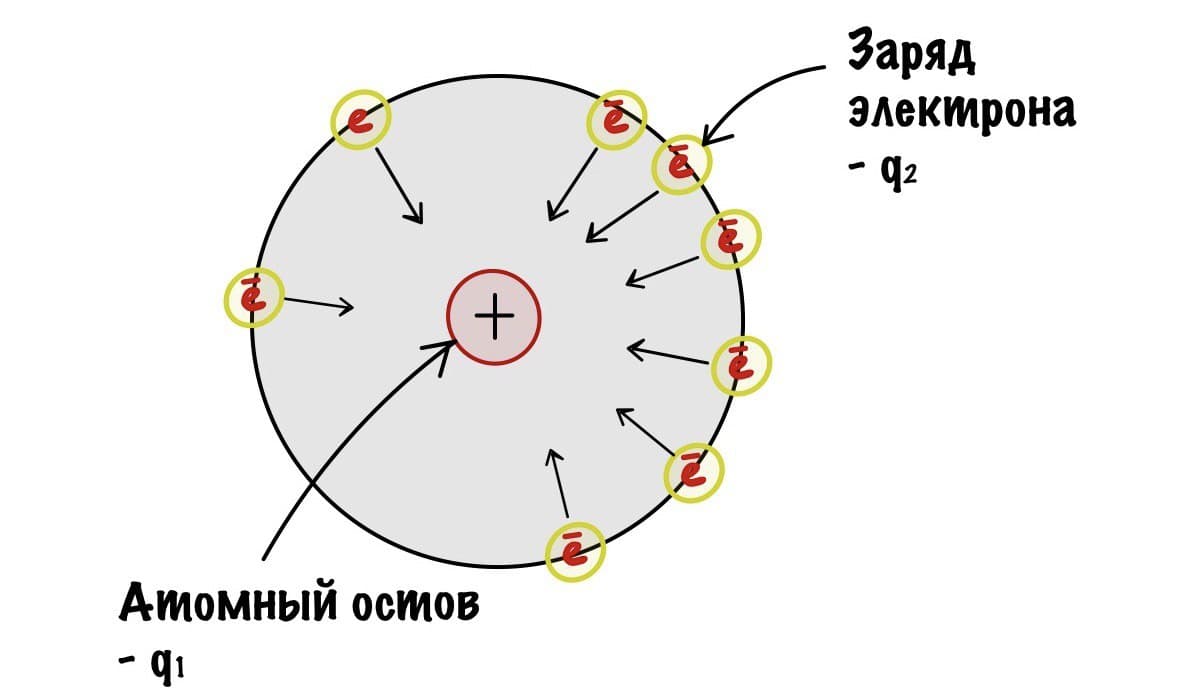
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
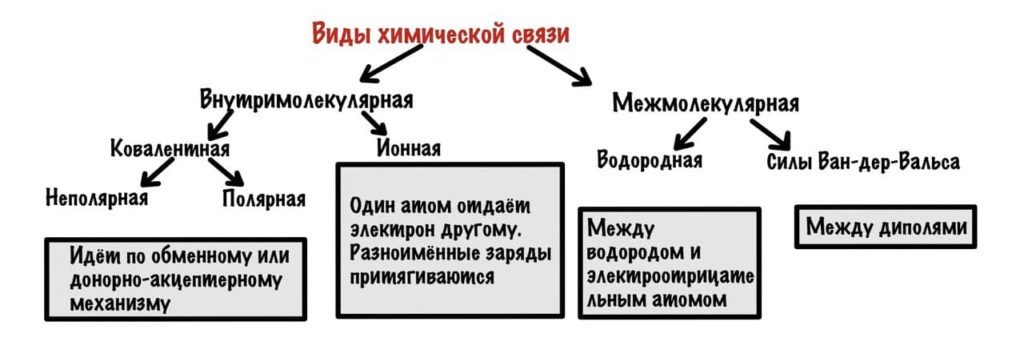
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Что такое частичный заряд
7.4. Состав и строение ионных соединений
В обычных условиях соединения с ионной связью или, как их обычно называют, ионные соединения представляют собой твердые вещества. Они состоят из ионных кристаллов.
| Ионный кристалл – кристалл, состоящий из разноименно заряженных ионов, связанных ионной связью. |
Как видно из определения, понятие » координационное число» используется не только для характеристики окружения ионов, но и в других случаях, с которыми мы познакомимся позже.
Естественно, что в случае ионного кристалла ближайшими соседями иона являются тоже ионы, но противоположного знака.Посмотрим, чему равны координационные числа (КЧ) ионов в различных ионных кристаллах:
NaCl: КЧ(Nа 

CsCl: КЧ(Cs 

CaF2: КЧ(Са 2 

Количественный состав ионного соединения определяется электронейтральностью вещества. Так как любое химическое вещество электронейтрально, то в любой порции вещества суммарный заряд катионов равен суммарному заряду анионов. Это относится и к наименьшей порции немолекулярного вещества – формульной единице. Следовательно, состав ионного вещества зависит только от зарядов ионов, из которых оно состоит. Зная заряды ионов и помня об электронейтральности вещества, легко составить формулы ионных соединений (структурные и простейшие):
Na 

(Na 

Na2O
Ca 2 

(Ca 2 

CaCl2
Bi 3 

(Bi 3 

BiF3
Na 

(Na 

Na2SO4
K 

(K 

K3N
Fe 2 

(Fe 2 

FeO
Cr 3 

(Cr 3 

Cr2S3
Ba 2 

(Ba 2 

BaCO3
Ag 

(Ag 

AgCl
Mg 2 

(Mg 2 

Mg3P2
La 3 

(La 3 

LaP
Ca 2 

(Ca 2 

Ca3(PO4)2
Из электронейтральности вещества следует и другое правило, которым можно пользоваться при составлении простейших формул ионных соединений: отношение индексов ионов в простейшей формуле равно обратному отношению модулей зарядов этих ионов.
Пример. Запишем формулу хлорида кальция в виде CaxCly, тогда
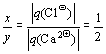
| Физический ионный радиус – расстояние от ядра иона до минимума электронной плотности на прямой, соединяющей ядра разноименно заряженных ионов. |
На рис. 7.3 показаны структуры кристаллов трех соединений: NaCl, CsCl и CaF2. Слева на этом рисунке в виде объемных моделей изображены элементарные ячейки кристаллов, то есть минимальные объемы кристаллов, многократно повторяя которые в трех направлениях, можно получить весь кристалл. Справа на этом рисунке те же элементарные ячейки изображены в виде шаростержневых моделей. В этих моделях шариками изображаются не сами атомы, а только их центры, а расстояния между шариками пропорциональны межатомным расстояниям.
Структуры, аналогичные приведенным на рисунке 7.3, имеют многие соединения. Так структуру NaCl имеют, например: KF, KCl, CaO, FeO, CaS, CrN и многие другие соединения. Веществ со структурой CsCl значительно меньше, и это прежде всего хлориды, бромиды и йодиды рубидия и цезия. Напротив, соединений со структурой CaF2 очень много, например: BaF2, SrCl2, CuF2, CdF2. Существует довольно много соединений, структура которых похожа на структуру CaF2, только катионы и анионы в них как бы поменялись местами: K2O, Na2S, Li2Se и другие. Кроме того, существует еще несколько структурных типов, к которым относятся другие бинарные ионные соединения.
Ионные кристаллы со сложными катионами или анионами имеют, естественно, более сложную структуру.
По физическим характеристикам ионные соединения – твердые хрупкие вещества с довольно высокими температурами плавления (обычно выше 400 o С) и кипения. В расплавленном состоянии они представляют собой ионные жидкости (ионные расплавы). Как и ионные кристаллы, ионные жидкости состоят из катионов и анионов, удерживаемых вместе ионными связями, но, в отличие от кристалла, в расплаве ионы подвижны. Поэтому расплавы ионных соединений проводят электрический ток. В газообразном состоянии при высокой температуре большинство ионных веществ состоит из ионных молекул, обычно соответствующих формульной единице твердого вещества.
| Фторид кальция – CaF2. Бесцветное кристаллическое вещество с ионной связью. В природе это минерал флюорит или плавиковый шпат. Природные флюориты почти всегда слабо окрашены в зеленый, голубой и даже пурпурный тона, и, пока не истощились их залежи, они использовались в качестве красивого поделочного камня. Флюорит не растворяется в воде, химически малоактивен. Он издавна применялся в металлургии для снижения температуры плавления руд цветных металлов и образующихся шлаков (флюор по латыни – » текучий» ). В настоящее время флюорит используют для получения фтороводорода и плавиковой кислоты, кроме того, кристаллы флюорита находят применение в оптике, так как они пропускают излучение в инфракрасной и ультрафиолетовой части спектра лучше, чем вода, кварц и стекло. Кроме того, фторид кальция входит в состав некоторых глазурей и эмалей. |














2.Составьте простейшие формулы следующих соединений: оксид кальция, хлорид рубидия, сульфид лития, йодид магния, оксид бария.
3.Перечислите увиденные вами недостатки и достоинства объемных и шаростержневых моделей структуры кристаллов.
7.5. Энергия ионной связи
Одна из важнейших характеристик химической связи – ее прочность. Прочность связи характеризуется энергией связи. Для разных типов связи энергия связи определяется и называется по-разному. Для ионной связи эта энергия называется молярной энергией ионной кристаллической решетки, или кратко энергия решетки.
| Молярная энергия ионной кристаллической решетки (Екр) – отношение энергии, выделяющейся при образовании порции кристаллического вещества из изолированных ионов, к количеству вещества в этой порции |
Энергия решетки показывает, какая энергия выделится при образовании 1 моля вещества из изолированных ионов, или, какую энергию необходимо затратить на разделение одного моля вещества на изолированные ионы. [Eкр] = 1 кДж/моль.
Для обычной поваренной соли Екр(NaCl) = 767 кДж/моль. Для сравнения, 767 кДж надо затратить, чтобы при 100 o С полностью испарить 340 г воды.
Таблица 18. Значения энергии решетки для некоторых веществ
Е кр
кДж/моль
кДж/моль
Как видно из таблицы 18, значения энергии решетки меняются в довольно широких пределах: примерно от 600 до 15000 кДж/моль. От чего же это зависит?
Силы, связывающие ионы в кристалле – электростатические силы, и, следовательно, по закону Кулона ионная связь тем прочнее, чем больше значения зарядов и меньше радиусы ионов.
Действительно, энергия решетки йодида лития много меньше, чем энергия решетки фторида лития потому, что радиус фторид-иона существенно меньше радиуса йодид-иона. Самая большая энергия решетки из приведенных в таблице у оксида алюминия потому, что в этом соединении и ионы маленькие, и значения их зарядов достаточно велики.


2.В каком из соединений энергия решетки больше и почему: а) Na2S или K2S; б) MgCl2 или MgI2; в) KCl или CaCl2?
3.Какой из оксидов – MgO или CaO – плавится при более высокой температуре?
7.6. Формальный заряд. Поляризация ионов
После знакомства со строением ионных кристаллов на вопрос, из чего они состоят, вы уверенно отвечаете: » Из ионов». При этом вы понимаете под ионами заряженные аналоги атомов и молекул, на самом деле имеющие целочисленный заряд, например, +1е или – 3 е. Но это не так.
Экспериментально установлено, что реальные или, как их называют, эффективные заряды ионов в соединениях несколько отличаются от их формальных зарядов, то есть от тех зарядов, которые мы записываем в символе иона.
Эффективный заряд иона (qэф) – реальный, экспериментально определяемый заряд иона в ионном кристалле.
Формальный заряд иона (qф) – реальный заряд изолированного иона.
Как для эффективного, так и для формального удобная заряда единица измерений – элементарный электрический заряд. Хотя, конечно, эти заряды могут быть измерены и в кулонах. При обозначении формального заряда иона в правом верхнем индексе знак » +» или » – » ставится в кружочке (



Эксперименты показали, что в кристалле хлорида натрия qэф(Na 

Чтобы понять, почему это так, рассмотрим реакцию получения хлорида натрия из простых веществ:
Буквенные индексы у формул веществ показывают, в каком агрегатном состоянии взяты исходные вещества, и в каком агрегатном состоянии образуются продукты реакции. В данном случае натрий и хлорид натрия – твердые кристаллические вещества (к), а хлор – газ (г).
Мысленно разобьем процесс образования кристалла хлорида натрия на следующие этапы;
1) кристалл натрия разделяется на атомы натрия: Na(к) = Na(г);
2) молекулы хлора разделяются на атомы хлора: Cl2(г) = 2Cl(г);
3) атомы натрия отдают электроны, а атомы хлора их принимают: то есть Na(г) + Cl(г) = Na + (г) + Cl – (г);
4) из изолированных ионов образуется кристалл хлорида натрия: Na + (г) + Cl – (г) = NaCl(к).
Поляризация ионов – деформация электронных оболочек ионов при образовании ионного кристалла, приводящая к некоторому перераспределению зарядов между ионами.
В том же хлориде натрия
qф(Nа 

qф(Cl 

Впечатление такое, будто у иона возникает дополнительный заряд противоположного знака, частично компенсирующий основной заряд этого иона.
Такой дополнительный заряд называют частичным зарядом. Частичные заряды ионов возникают из-за поляризации этих ионов при образовании ионной химической связи.
| Частичный заряд (qч) – разность между эффективным и формальным зарядом иона или атома. |
Для ионов натрия и хлорид-ионов в хлориде натрия
qч(Na 


qч(Cl 


Обратите внимание, что частичный заряд иона противоположен по знаку его формальному заряду.