что такое болезнь шенлейн геноха
Геморрагический васкулит у детей
Общая информация
Краткое описание
Дата разработки протокола: 2017 год.
Пользователи протокола: врачи общей практики, педиатры, детские гематологи, аллергологи, нефрологи, дерматовенерологи, ревматологи.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
I. Патогенетические формы:
Базисная форма пурпуры Шенлейна-Геноха:
· без существенного повышения уровня иммунных комплексов в плазме;
· со значительным повышением уровня иммунных комплексов в плазме.
Некротическая форма:
· Формы с криоглобулинемией и (или) моноклоновый парапротеинемией:
— с холодовой крапивницей и отеками;
— без холодовой крапивницы и без отеков.
· Вторичные формы при лимфомах, лимфгранулематозе, миеломной болезни, лимфолейкозе и др.опухолях, а также при системных заболеваниях.
Смешанные варианты.
II. Клинические формы (синдромы):
Кожная и кожно-суставная:
· простая;
· некротическая;
· с холодовой крапивницей и отеками.
Абдоминальная и абдоминально-кожная:
· с поражением других органов.
Почечная и кожно-почечная (в том числе и нефротическим синдромом).
Смешанные формы.
III. Варианты течения:
· молниеносное, острое, затяжное;
· рецидивирующее, хроническое персистирующее с обострениями (частыми, редкими).
IV. Степени активности:
· малая;
· умеренная;
· высокая;
· очень высокая.
V. Осложнения:
· кишечная непроходимость, перфорации, перитонит, панкреатит;
· ДВС синдром с тромбоцитопенией, снижением уровня антитромбина III, протеина С и компонентов системы фибринолиза, повышение ПДФ;
· постгеморрагическая анемия;
· тромбозы и инфаркты в органах, в том числе церебральные расстройства, невриты [3].
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1,2,6,8]
Диагностические критерии
Жалобы и анамнез:
Геморрагический васкулит начинается обычно остро, при субфебрильном, реже фебрильном повышении температуры тела, а иногда и без температурной реакции.
Клиническая картина может быть представлена одним или несколькими из характерных синдромов (кожный, суставной, абдоминальный, почечный), в зависимости от чего выделяют простую и смешанную формы болезни [2].
Абдоминальный синдром, обусловленный отёком и геморрагиями в стенку кишки, брыжейку или брюшину, наблюдают почти у 70% детей. Больные могут жаловаться на умеренные боли в животе, которые не сопровождаются диспепсическими расстройствами, не причиняют особых страданий и проходят самостоятельно или в первые 2-3 дня от начала лечения. Однако нередко сильные боли в животе носят приступообразный характер, возникают внезапно по типу колики, не имеют чёткой локализации и продолжаются до нескольких дней. Может быть тошнота, рвота, неустойчивый стул, эпизоды кишечного и желудочного кровотечения. Наличие абдоминального синдрома с начала заболевания, рецидивирующий характер болей требуют совместного наблюдения пациента педиатром и хирургом, так как болевой синдром при геморрагическом васкулите может быть обусловлен как проявлением болезни, так и её осложнением (инвагинация, перфорация кишечника) [6,8].
Анамнез:
· установить начало заболевания и его связь с атопией, инфекциями, изменением пищевого режима;
· установить наличие предшествующих инфекционных заболеваний (ангина, грипп, обострение хронических инфекционно-воспалительных процессов), переохлаждения, эмоциональных и физических перегрузок, введение вакцин, сывороток, глобулинов;
· выяснение аллергологического анамнеза: проявления атопического дерматита, наличие пищевой и медикаментозной аллергии, наследственной отягощенности по развитию атопических реакций и иммунологических заболеваний.
Показания для консультации специалистов:
· консультация нефролога – при подозрении на поражение почек при ГВ;
· консультация хирурга – при подозрении на острую хирургическую патологию.
Диагностический алгоритм: (схема)
Дифференциальный диагноз
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Активированный уголь (Activated carbon) |
| Алгелдрат (Algeldrate) |
| Гепарин (Heparin) |
| Декстран (Dextran) |
| Декстроза (Dextrose) |
| Дипиридамол (Dipyridamole) |
| Дифенгидрамин (Diphenhydramine) |
| Ибупрофен (Ibuprofen) |
| Магния гидроксид (Magnesium hydroxide) |
| Морфин (Morphine) |
| Напроксен (Naproxen) |
| Натрия хлорид (Sodium chloride) |
| Плазма свежезамороженная |
| Преднизолон (Prednisolone) |
Группы препаратов согласно АТХ, применяющиеся при лечении
Лечение (амбулатория)
лечение на амбулаторном уровне не проводится, все дети с любой формой ГВ должны быть госпитализированы в стационар.
Хирургическое вмешательство: нет.
Индикаторы эффективности лечения: отсутствие осложнений заболевания.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [2,4,5,7,9]: зависит от формы, течения, степени тяжести заболевания, возрастных и индивидуальных особенностей, предполагаемого этиологического фактора и складывается из базисной терапии и альтернативных терапевтических направлений. Все дети с данным лечатся на стационарном уровне.
Немедикаментозное лечение:
· ограничение двигательной активности на высоте проявлений кожной пурпуры, при абдоминальном и суставном синдромах.
· индивидуально постельный режим устанавливается при капилляротоксическом нефрите. Возобновление геморрагических высыпаний требует возврата к постельному режиму. Двигательный режим должен быть ограничен на высоте проявлений кожной пурпуры, при абдоминальном и суставном синдромах, необоснованное удлинение ограничения двигательного режима ребенка может усилить гиперкоагуляцию [2,5].
гипоаллергенная диета [5] – из рациона питания исключаются облигатные аллергены, а также все продукты и медикаменты, на которые когда-либо были аллергические реакции. При абдоминальном синдроме назначается модифицированный стол №1 по Певзнеру, до его полного купирования. При нефрите стол №7 (без соли, мяса, творога) с постепенным переходом на гипохлоридную диету, добавляя соль в готовые блюда до 0,5г в сутки, через 1-1,5 месяца – 3-4г в сутки.
Медикаментозное лечение [2,4,5,7,9]:
Основными в лечение ГВ являются антиагреганты и антикоагулянты [2,4], которые воздействуют на основные звенья патогенеза и относятся к средствам патогенетической терапии.
Дезагреганты [2]: дипиридамол через рот 3-5 мг/кг·сутки. Дезагреганты при ГВ назначаются на 3-4 недели.
При кожной форме ГВ – гепарин назначается в стартовой дозе 100 ЕД/кг в сутки с максимальным ступенчатым повышением до 250 ЕД/кг/сутки в среднем на 10 дней с последующим постепенным снижением дозы в течение 3-4 дней.
При кожно-суставной форме ГВ стартовая доза 100-200 ЕД\кг/сутки с максимальным ступенчатым повышением до 500 ЕД/кг/сутки, в среднем на 17 дней со снижением в течение 4-8 дней.
При смешанной форме ГВ без поражения почек стартовая доза гепарина 150-200 ЕД/кг/сутки со ступенчатым повышением до 600 ЕД/кг/сутки, средний курс лечения в полной дозе 23 дня, отмена за 8-10 дней.
При смешанной форме ГВ с поражением почек гепарин в стартовой дозе 150-300 ЕД/кг/сутки со ступенчатым повышением до 550 ЕД/кг/сутки на 25 дней с последующим снижением дозы в течение 8-10 дней.
Абдоминальный синдром с кишечным кровотечением и гематурия не являются противопоказаниями к антитромботической терапии. Перед назначением гепарина следует провести контроль уровня антитромбина III и при его снижении к лечению добавить трансфузию свежезамороженной плазмы 10 – 15 мл/кг в сутки 2 раза в неделю.
Инфузионная терапия [2] используется для улучшения микроциркуляции, реологических свойств, нормализации объема циркулирующей крови (ОЦК) и снижения коагуляционного потенциала крови.
Декстран 10-20мл/кг в/в капельно (при выраженной кожной пурпуре с тромбогеморрагическим компонентом, ангионевротические отеки, абдоминальный синдром).
Энтеросорбенты [2] (активированный уголь) назначаются с целью связывания биологически активных веществ и токсинов в просвете кишечника, длительность лечения составляет при остром течении заболевания 2-4недели. Циклы энтеросорбции могут быть повторными при волнообразном и рецидивирующем течении ГВ.
Антибактериальные и противовирусные препараты [1,2] назначаются при сопутствующей инфекции или эмпирически в зависимости от предполагаемого этиологического фактора или на основании результатов микробиологического и/или серологического исследования.
Антигистаминные препараты [1,2] при наличии отягощенного аллергоанамнеза или аллергена в качестве этиологического агента в средне-терапевтических возрастных дозировках от 7-14 дней.
Кортикостероидная терапия [2, 9] показана при молниеносной форме, при наличии буллезно-некротических форм кожной пурпуры, упорном абдоминальном синдроме, нефрите с макрогематурией, нефротическом синдроме, капиляротоксического нефрита, в комбинации с антикоагулянтами и/ или дезагрегантами.
Применение кортикостероидов (преднизолона) у детей с ГВ. [9,2]:
| Клинический вариант ГВ | Суточная доза | Курс лечения | Схема отмены |
| Распространенная кожная пурпура, буллезно-некротическая и экссудативные элементы | 2мг/кг per os | 7-14 дней | По 5мг через 1-2 дня |
| Абдоминальный синдром | 2 мг/кг в/в или per os | 7-14 дней | По 5мг через 1-2 дня |
| Волнообразное течение кожной пурпуры | 2 мг/кг per os | 7-21 дней | По 5мг через 1-3 дня |
| Нефрит при ГВ с макрогематурией, нефротическим синдромом | 2 мг/кг per os | 21 день | По 5мг через 5-7 дней |
Перечень основных лекарственных средств:
· гепарин;
· дипиридамол;
· глюкокортикостероиды;
· препараты, улучшающие реологию крови.
Таблица сравнения препаратов:
Хирургическое вмешательство: нет.
Индикаторы эффективности лечения:
· клинические: регрессирование кожного синдрома (угасание сыпи и отсутствие появления новых элементов кожной пурпуры), купирование суставного синдрома, абдоминального синдрома;
· лабораторные (улучшение показателей коагулограммы: удлинение показателей АПТВ и ВСК по Ли-Уайту в 1,5-2раза).
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: показаний для плановой госпитализации нет, динамическое наблюдение и обследование проводится амбулаторно или в дневном стационаре.
Показания для экстренной госпитализации:
· при подозрении на геморрагический васкулит, экстренная госпитализация в специализированное гематологическое отделение;
· пациенты с капиляротоксическим нефритом госпитализируются в специализированные нефрологические отделения.
Информация
Источники и литература
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Омарова Кулян Омаровна – доктор медицинских наук, профессор РГКП «Научный центр Педиатрии и Детской Хирургии».
2) Абдилова Гульнара Калденовна – кандидат медицинских наук, гематолог, заместитель директора по педиатрической службе РГКП «Научный центр Педиатрии и Детской Хирургии».
3) Манжуова Лязат Нурбапаевна – кандидат медицинских наук, гематолог, врач высшей категории, заведующий отделением онкогематологии для детей старшего возраста РГКП «Научный центр Педиатрии и Детской Хирургии».
4) Булабаева Гулнара Ержановна – врач высшей категории, гематолог, заведующий отделением онкогематологии для детей раннего возраста РГКП «Научный центр Педиатрии и Детской Хирургии».
5) Нургалиев Даир Жванышевич – доктор медицинских наук, врач высшей категории, гематолог, заведующий отделением онкологии Национального Научного Центра Материнства и Детства.
6) Макалкина Лариса Геннадьевна – кандидат медицинских наук, Phd, MD, клинический фармаколог, доцент кафедры клинической фармакологии АО «Медицинский университет» г.Астана.
Указания на отсутствие конфликта интересов: отсутствует.
Список рецензентов:
1) Доскожаева Сауле Темирбулатовна – доктор медицинских наук, профессор, АО «Казахский медицинский университет непрерывного образования», проректор по учебной работе, заведующая кафедрой инфекционных болезней с курсом детских инфекций.
2) Кулжанова Шолпан Адлгазыевна – доктор медицинских наук, профессор, АО «Медицинский университет Астана», заведующая кафедрой инфекционных болезней и эпидемиологии.
Условия пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Геморрагический васкулит
Распространенным заболеванием иммунного генеза, проявляющимся как воспаление стенок капилляров кожи и внутренних органов, является геморрагический васкулит. Это асептическая патология, для которой характерно активное образование иммунных комплексов и поражение стенки микрососудов с возрастанием их проницаемости. Болезнь носит системный характер и поражает людей в любом возрасте, однако наибольшее число больных приходится на детей и подростков в возрасте от 4 до 12 лет. Мальчики заболевают в 2-2,5 раза чаще, чем девочки.
Что это за болезнь
Это заболевание носит инфекционно-аллергическую природу: основной причиной геморрагического васкулита служит присутствие в крови больных иммунных комплексов и активных компонентов защитной системы протеолитических ферментов. Иммунные комплексы накапливаются в кровотоке, а при чрезмерном количестве антигенов либо недостатке антител происходит отложение белковых образований на эндотелий стенки микрососудов. Факторами, способствующими развитию болезни, являются:
Существуют данные о наличии наследственной предрасположенности к заболеванию. В некоторых случаях невозможно выяснить, какой именно фактор послужил «спусковым крючком» для организма больного.
Проявления заболевания
Симптомы геморрагического васкулита достаточно разнообразны. Наиболее характерным внешним признаком служит поражение кожи, проявляющееся в виде так называемой пурпуры – яркой сыпи в виде небольших багрово-синюшных пятен, симметрично проявляющихся на голенях и ступнях, а с развитием болезни поднимающихся выше, до других участков тела. Помимо пурпуры, на теле больного могут появляться и другие виды сыпи – эритемы, петехии, везикулы. В тяжелых случаях возможно появление некротизированных участков кожи.
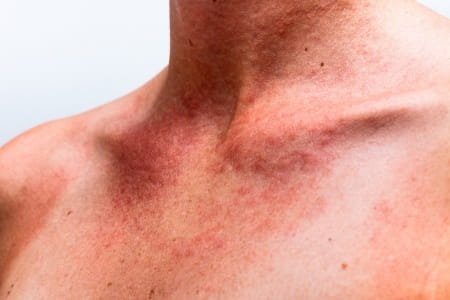
Существует определенная разница между проявлениями заболевания у детей и взрослых.
Геморрагический васкулит у детей отличается яркой симптоматикой, в том числе:
Случаи геморрагического васкулита у взрослых, как правило, характеризуются стертыми, маловыразительными проявлениями в начале болезни. Абдоминальный синдром присутствует не более чем у половины пациентов, в основном без тошноты и рвоты. При поражении почек практически всегда развиваются хронический гломерулонефрит и хроническая почечная недостаточность.
Диагностические методы
Поскольку у детей заболевание с самого начала проявляется яркой, острой симптоматикой, то с постановкой диагноза, как правило, проблем не возникает. Гораздо более сложной является диагностика геморрагического васкулита у взрослых, особенно при отсутствии характерной сыпи в начале болезни. Как правило, она базируется на лабораторных исследованиях, в числе которых назначают:
Важным этапом диагностики, позволяющим установить степень поражения внутренних органов, являются инструментальные исследования – УЗИ брюшной полости и почек, УЗДГ почечных сосудов, гастроскопия. При тяжелом течении болезни назначают биопсию кожи и почек для определения величины отложений иммуноглобулина, проницаемости сосудистой стенки.
Как лечить?

Терапия включает медикаментозное лечение в соответствии с показаниями. При тяжелом течении заболевания могут назначаться глюкокортикостероиды, а также проведение плазмафереза или трансфузионную терапию для детей. При наличии аллергических проявлений назначают антигистаминные препараты. Диета при геморрагическом васкулите направлена на исключение потенциально аллергенных продуктов, способных ухудшить состояние больного, – цитрусовых, клубники, шоколада, кофе, яиц и др. При выраженном почечном и абдоминальном синдроме назначают специальные диеты.
Часто задаваемые вопросы
Чем опасен геморрагический васкулит?
Это системное заболевание, поражающее многие органы. При отсутствии медицинской помощи у тяжелых больных возможен летальный исход, который становится следствием перитонита или перфорации кишечника, кровоизлияний в головной мозг либо развития почечной недостаточности. Кроме того, существует ряд осложнений болезни, в числе которых панкреатит, кишечная непроходимость, церебральные расстройства, невриты, тромбозы.
К какому врачу обратиться по поводу лечения?
Лечение геморрагического васкулита ведет ревматолог, который назначает диагностические исследования, определяет схему лечения и наблюдает за состоянием пациента. Во многих случаях требуются дополнительные консультации нефролога, дерматолога, гастроэнтеролога, пульмонолога, кардиолога и других специалистов.
Благоприятен ли прогноз течения болезни?
Прогноз зависит от формы заболевания. При легкой форме пациенты полностью восстанавливаются и в дальнейшем возвращаются к обычному образу жизни. Тяжелое течение болезни чревато рецидивами и риском развития осложнений. В любом случае, после выписки из стационара пациент должен строго соблюдать рекомендации врача.
Пурпура Шенлейна—Геноха
О.Г. КРИВОШЕЕВ, доцент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук; С.В. ГУЛЯЕВ, ассистент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук
Пурпура Шенлейна—Геноха (геморрагический васкулит) — системный васкулит, поражающий микроциркуляторное русло (артериолы, капилляры и посткапиллярные венулы), с типичным отложением в стенке сосудов иммунных комплексов, состоящих из иммуноглобулинов А (IgA). Клинически болезнь проявляется кожной геморрагической сыпью, суставным синдромом, поражением желудочно-кишечного тракта (ЖКТ) и почек.
Пурпура Шенлейна—Геноха развивается в любом возрасте, однако максимальная заболеваемость наблюдается у детей в возрасте 4—6?лет, составляя примерно 13—18 случаев на 100 тыс. С возрастом заболеваемость снижается и развитие болезни после 60 лет считается редкостью.
Патогенез
В настоящее время пурпура Шенлейна—Геноха рассматривается как иммунокомплексное заболевание, связанное с отложением в сосудистой стенке гранулярных IgA-депозитов и активацией комплемента. Эта концепция основывается на результатах многочисленных исследований, показавших нарушение синтеза и/или метаболизма IgA у большинства больных пурпурой Шенлейна—Геноха: повышение уровня сывороточного IgA, IgA-содержащих иммунных, а также IgA-фибронектиновых комплексов. Тем не менее патогенетическое значение этих нарушений требует дальнейшей оценки. В последние годы накапливаются факты, свидетельствующие о противовоспалительных свойствах IgA, что дает основание расценивать увеличение его синтеза как компенсаторный процесс, возникающий вторично в ответ на воспалительную реакцию в слизистых оболочках. Так, было показано, что IgA обладает способностью уменьшать продукцию провоспалительных цитокинов и не способен активировать комплемент; IgA обнаруживается в эндотелии непораженных сосудов и в мезангии неизмененных почечных клубочков; описано наблюдение пурпуры Шенлейна—Геноха при полном селективном дефиците IgA. Учитывая нередкую связь развития пурпуры Шенлейна—Геноха с эпизодами инфекций респираторного тракта и ЖКТ, это предположение представляется вполне вероятным.
Другой причиной изменений в метаболизме IgA при пурпуре Шенлейна—Геноха может быть нарушение О-гликозилирования шарнирной области тяжелых цепей молекулы IgA1, что, как было показано, может приводить к нарушению клиренса IgA1 рецепторами печени и удлинению периода циркуляции IgA-полимеров и IgA-содержащих иммунных комплексов в системном кровотоке. Показано, что молекулы IgA1 с аберрантным гликозилированием приобретают способность активировать комплемент по альтернативному пути и имеют повышенную тропность к мезангиальному матриксу почечных клубочков.
В последние годы получены дополнительные данные, косвенно подтверждающие предположение об инфекционно зависимом характере пурпуры Шенлейна—Геноха. Так, было показано, что у большинства больных в период обострения кожного васкулита наблюдается транзиторная эндотоксемия — циркуляция в системном кровотоке липополисахарида грамотрицательных бактерий. Патогенетическое значение этого феномена при пурпуре Шенлейна—Геноха требует дальнейшего изучения, однако предполагается возможность участия эндотоксина в развитии сосудистого воспаления, опосредованного реакцией Шварцмана. Важную роль в патогенезе эндотоксемии может играть хроническое воспаление кишечной стенки, возможно, обусловленное дисфункцией ее локальной иммунной системы или инфекционным процессом. В пользу этого предположения свидетельствует обнаружение повышенной кишечной проницаемости для макромолекул (овальбумин) у большинства больных пурпурой Шенлейна—Геноха в период обострений кожного васкулита. Кроме этого продемонстрировано наличие у больных пурпурой Шенлейна—Геноха хронического воспалительного процесса в слизистой оболочке тонкой кишки, что, по-видимому, является морфологической основой для нарушения функции кишечного барьера и развития транзиторной эндотоксемии.
Клиническая картина
Клиническая картина пурпуры Шенлейна—Геноха складывается из четырех типичных проявлений: кожной геморрагической сыпи, поражения суставов, ЖКТ и почек. В большинстве случаев болезнь развивается исподволь, постепенно и существенно не нарушает общее состояние больных. Как правило, такой вариант начала болезни наблюдается при изолированном поражении кожи. Количество органных проявлений пурпуры Шенлейна—Геноха варьирует от 1—2 до комбинации всех 4 классических признаков, которые могут развиваться в любой последовательности в течение нескольких дней или недель болезни. В некоторых случаях, кроме упомянутых проявлений, может развиваться поражение других органов, в частности, легких, сердца, центральной нервной системы.
Поражение кожи наблюдается у всех больных пурпурой Шенлейна—Геноха и является обязательным критерием диагностики. В большинстве случаев геморрагическая сыпь является первым клиническим проявлением болезни, к которому в дальнейшем присоединяется поражение других органов и систем. Наиболее типичная локализация кожных высыпаний: нижние конечности — голени и стопы. Нередко кожная сыпь распространяется на бедра, ягодицы, туловище, верхние конечности и исключительно редко на лицо. В процессе эволюции геморрагии постепенно бледнеют, трансформируются в коричневые пигментные пятна и затем исчезают. При длительном рецидивирующем течении кожа в области поражения может пигментироваться вследствие развития гемосидероза. В большинстве случаев геморрагическая сыпь представлена петехиями и пурпурой, однако в ряде случаев могут также наблюдаться эритематозно-макулярные и уртикарные элементы.
Поражение суставов, как правило, развивается параллельно с поражением кожи и протекает по типу мигрирующих полиартралгий, реже — артритов. Излюбленная локализация — коленные и голеностопные суставы, реже поражаются локтевые, лучезапястные и другие суставы. Эти проявления болезни всегда преходящи и доброкачественны, никогда не приводят к развитию стойких изменений в суставах.
Поражение ЖКТ отмечается у 60—80% больных детского возраста и у 40—65% взрослых больных. Наиболее постоянный симптом: боли в животе, усиливающиеся после еды, что нередко создает типичную картину «брюшной жабы». Частым осложнением абдоминального поражения при пурпуре Шенлейна—Геноха является кишечное кровотечение.
Поражение почек при пурпуре Шенлейна—Геноха может приобретать хроническое течение и является главным фактором, определяющим прогноз болезни в целом. Частота вовлечения почек варьирует от 30 до 70% в зависимости от возраста больных. У взрослых поражение почек выявляется почти в 2 раза чаще, чем у детей. Как правило, клинические признаки поражения почек выявляют в первые 3 месяца заболевания, тем не менее при хроническом рецидивирующем течении кожного васкулита возможно отсроченное возникновение признаков гломерулонефрита — спустя несколько месяцев или даже лет после дебюта болезни. Возможными предвестниками вовлечения в процесс почек у детей являются мужской пол, возраст старше 5 лет, абдоминальный синдром, персистирующая кожная пурпура и снижение уровня фактора XIII в плазме крови. У взрослых больных к факторам риска поражения почек относят наличие лихорадки и эпизоды инфекций в дебюте болезни, распространение кожной сыпи на туловище, тяжелый абдоминальный синдром и наличие лабораторных признаков воспалительной активности болезни. Тяжесть почечной патологии, как правило, не коррелирует с выраженностью кожных проявлений болезни, однако как у детей, так и у взрослых отмечена достоверная положительная корреляция между частотой поражения почек и развитием абдоминального синдрома, что требует более тщательного динамического наблюдения за соответствующим контингентом больных. У детей в половине случаев поражение почек имеет благоприятное течение с полным клинико-лабораторным выздоровлением, в то время как у большинства взрослых больных наблюдается тенденция к хроническому персистирующему течению нефрита.
У половины больных пурпурой Шенлейна—Геноха гломерулонефрит проявляется микрогематурией, которая, как правило, сочетается с минимальной или умеренно выраженной протеинурией. У трети больных наблюдается макрогематурия, которая чаще всего развивается в дебюте нефрита, но может возникать и на более поздних этапах почечного поражения во время обострений кожного васкулита или респираторных инфекций. Возможны и более тяжелые варианты почечного поражения, в том числе нефротический синдром, быстропрогрессирующий нефрит и острая почечная недостаточность. У 14—20% больных обнаруживается синдром артериальной гипертензии. Развитие хронической почечной недостаточности (ХПН) в исходе гломерулонефрита отмечается у 12—30% больных.
Диагностика
Диагностика пурпуры Шенлейна—Геноха основывается на выявлении типичных клинических признаков заболевания, в первую очередь двусторонних кожных геморрагических высыпаний в момент осмотра или в анамнезе. Специфических лабораторных тестов при пурпуре Шенлейна—Геноха не существует. Изменения в клиническом анализе крови — повышение скорости оседания эритроцитов (СОЭ) — могут отражать воспалительную активность болезни, а также выраженность осложнений (анемия при кишечном кровотечении). Наличие тромбоцитопении — критерий исключения пурпуры Шенлейна—Геноха. Выраженное повышение СОЭ и значительная диспротеинемия не характерны для пурпуры Шенлейна—Геноха. Активность болезни отражают уровень фактора Виллебранда и тромбомодулина в плазме крови. Обнаружение высокого уровня продуктов деградации фибрина/фибриногена в плазме при активных формах болезни не является признаком развития ДВС-синдрома, а лишь отражает высокую воспалительную активность заболевания. В план обследования всех больных необходимо включать вирусологическое и иммунологическое исследование крови для исключения других заболеваний, протекающих с кожной пурпурой.
Ключевую роль в подтверждении клинического диагноза играет биопсия кожи и/или почек, реже других органов, с обязательным проведением иммуногистохимического исследования, выявляющего фиксацию в сосудистой стенке IgA-содержащих иммунных комплексов. Следует учитывать, что кроме пурпуры Шенлейна—Геноха, IgA-депозиты обнаруживают при поражении кожи в рамках хронических воспалительных заболеваний кишечника (болезнь Крона, язвенный колит), хронических диффузных заболеваний печени алкогольной этиологии, целиакии, герпетиформного дерматита Дюринга.
Морфологическая картина поражения почек при пурпуре Шенлейна—Геноха идентична таковой при болезни Берже (первичной IgA нефропатии). Наиболее частый морфологический вариант поражения почек — мезангиопролиферативный гломерулонефрит, характеризующийся фокальной или диффузной пролиферацией мезангиоцитов. Иммуногистохимическое исследование выявляет гранулярные депозиты IgA, реже IgG, а также С3-компонента комплемента, фибрина. В более тяжелых случаях отмечается формирование эпителиальных «полулуний».
Широко используемые классификационные диагностические критерии пурпуры Шенлейна—Геноха, предложенные в 1990?г. Американской коллегией ревматологов и включающие возраст больного менее 20 лет, пальпируемую пурпуру, абдоминальный синдром и морфологическую картину кожного лейкоцитокластического васкулита (необходимо наличие 2 и более из 4 критериев), имеют малую практическую значимость вследствие их низкой чувствительности и специфичности (87,1 и 87,7%, соответственно).
Дифференциальная диагностика
Дифференциальная диагностика проводится с широким кругом заболеваний, протекающих с поражением сосудов мелкого калибра:
При поражении кожи могут быть эффективны такие лекарственные средства группы сульфаниламидов: сульфасалазин (внутрь по 500—1000 мг 2 раза в сутки), колхицин (внутрь, 1—2 мг 1 раз в сутки). Глюкокортикоиды эффективны у подавляющего числа больных, особенно в высоких дозах, однако их длительное применение у больных пурпурой Шенлейна—Геноха без вовлечения внутренних органов нежелательно, поскольку выраженность побочных эффектов в такой ситуации может превосходить тяжесть самой болезни. Назначение нестероидных противовоспалительных препаратов (НПВП) оправдано лишь при выраженном суставном синдроме и неэффективности других лекарственных средств. В остальных случаях от назначения НПВП следует воздерживаться вследствие неблагоприятного действия на слизистую оболочку кишечника и усиления кишечной проницаемости.
Поражение желудочно-кишечного тракта с интенсивными абдоминалгиями — абсолютное показание к назначению глюкокортикоидов:
преднизолон внутривенно капельно 300—500 мг/сут в течение 3 дней подряд с последующим переходом на прием внутрь 0,5 мг/кг 1 раз в сутки в течение 2—3 недель, затем быстрое снижение дозы по 5?мг каждые 3 суток до полной отмены.
Желудочно-кишечное кровотечение (в том случае, если оно обусловлено васкулитом, а не иными причинами) не является противопоказанием к назначению глюкокортикоидов внутрь, а, напротив, служит одним из основных показаний к такому лечению. Противопоказанием к назначению глюкокортикоидов внутрь при абдоминальном синдроме может быть только перфорация стенки кишки, которая в настоящее время крайне редко осложняет течение пурпуры Шенлейна—Геноха.
Наибольшие проблемы медикаментозного лечения пурпуры Шенлейна—Геноха связаны с выбором средств лечения хронического гломерулонефрита. Большинство авторов считают оправданным применение сверхвысоких доз глюкокортикоидов, цитостатиков и/или сеансов плазмафереза в случае тяжелого гломерулонефрита (нефротический синдром с нормальной или нарушенной функцией почек; более 50% клубочков с эпителиальными «полулуниями»).
В этом случае используется следующая схема:
В единичных неконтролируемых исследованиях показана эффективность при тяжелых вариантах поражения почек комбинации глюкокортикоидов и азатиоприна, а также комбинации глюкокортикоидов и циклофосфамида с антиагрегантами или антикоагулянтами.
Кроме того, для лечения больных с нефротическим и быстропрогрессирующим гломерулонефритом предлагается использовать внутривенные иммуноглобулины:
иммуноглобулин человеческий нормальный внутривенно по 400—1000 мг/кг в течение 1—5 сут, повторные курсы 1 раз в месяц в течение 6 месяцев.
В отношении менее тяжелых форм гломерулонефрита единства мнений нет. При изолированной микрогематурии, минимальной протеинурии (до 0,5 г/сут) и сохранной функции почек, как правило, активного иммуносупрессивного лечения не требуется. При умеренной протеинурии (0,5—1 г/сут) показано назначение лекарственных средств, влияющих на неиммунные механизмы прогрессирования поражения почек: ингибиторы ангиотензинпревращающего фермента и/или антагонисты рецепторов ангиотензина II (в связи с их способностью уменьшать внутриклубочковую гипертензию и выраженность протеинурии), статины (при нарушении липидного обмена). В некоторых ретроспективных исследованиях показан благоприятный эффект тонзиллэктомии на течение нетяжелых форм гломерулонефрита при пурпуре Шенлейна—Геноха.
Коррекция нарушений гемостаза, ранее считавшаяся первоочередной задачей в лечении пурпуры Шенлейна—Геноха, в настоящее время рассматривается лишь в качестве вспомогательного метода терапии, перспективы которого оцениваются скептически. В практическом плане представляют интерес сообщения японских исследователей о благоприятном долгосрочном клиническом и патоморфологическом эффекте фибринолитической терапии урокиназой на течение гломерулонефрита при пурпуре Шенлейна—Геноха:
урокиназа внутривенно медленно 5000 МЕ/кг 3 раза в неделю в течение 3—12?недель.
По мнению авторов, действие урокиназы может быть основано на уменьшении выраженности внутриклубочковой гиперкоагуляции и растворении депозитов фибриногена/фибрина.
Прогноз
Важным клиническим прогностическим фактором, определяющим частоту развития ХПН, является выраженность протеинурии. Так, если при минимальной протеинурии ХПН развивается у 5% больных, то при нефротическом синдроме этот показатель повышается до 40—50%. Наиболее неблагоприятным в отношении развития ХПН является сочетание нефротического синдрома с артериальной гипертензией и нарушением функции почек в дебюте гломерулонефрита.
Наиболее важным морфологическим критерием для определения прогноза поражения почек считают долю почечных клубочков с «полулуниями» от общего числа клубочков. Так, по данным французских авторов, наблюдавших 151 больного от 1 года до 18 лет, при наличии «полулуний» больше, чем в 50% клубочков терминальная почечная недостаточность развилась у 37% больных, а еще у 18% гломерулонефрит имел хроническое прогрессирующее течение. С другой стороны, у 85% пациентов, достигших терминальной почечной недостаточности, «полулуния» имелись более чем в половине почечных клубочков. У 70% больных с полным выздоровлением или минимальными изменениями в анализах мочи «полулуний» в клубочках не было найдено.
Важно, что у большинства больных с поздним прогрессированием гломерулонефрита отсутствуют клинические признаки активности почечных и внепочечных поражений, что объясняют преимущественным влиянием на течение почечного поражения неиммунных механизмов прогрессирования. В связи с этим у всех больных пурпурой Шенлейна—Геноха с поражением почек крайне важным является тщательный контроль артериального давления и коррекция метаболических нарушений, в частности гиперурикемии и дислипидемии.



